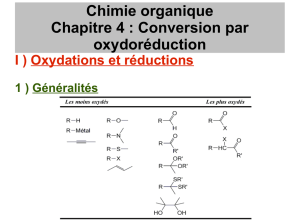
TD 07 Redox alcools carbonyles eleves

TD 7 : Relations rédox entre alcools, carbonyles et carboxyles
Exercice 1. Réactions d’oxydoréduction.
!"
#
!
$
%
Exercice 2. Oxydation par les ions dichromate.
& ' %
()*+
,
+
"
(
+m '
' - ./012
Masses molaires atomiques
3456+56"5)6,5'76+5/
Exercice 3. Etude du produit d’oxydation d’un alcool.
& A 8 B
9:
9%/;;
B
B"
AB- A2
' 9 C
<

Exercice 4. Oxydation d’alcools primaires
& = >
1
&=+
$
1
+
"&>
?
$
%
&@?A -B
1@CA=D1@?A
E1@+A>
[A]
[B] +
;
4
)
"
"4
F!-"
G
'
H1+4
+
+
"+
"
+"
'
4
-"
#
[C]
+
;
4
)
"
F=
>
F@CA@+A
' D@CA%@?A
# +@+A%@CA2
/ D@?A%@CA
Exercice 5. Réactivité de différents hydrures
& '1' [A] ;1/ HC4
#
[B] 9:%('
%'#.;
[A]
O O
O
O
O
F[B]
HC4
#
I1J[A]2
-%&?4
#
% 1[A][C]+
)
4
#
"
'
9:
)/;.;;
' F[C]&?4
#
4
# -%+"
'
[C] [D] [E] F
[D] [E]
/ F[C][D] [E]

Exercice 6. Action du borohydrure de sodium
&@?A%
D
&I2
Exercice 7. Une étape de synthèse
&AI&?4
#
B+
;
4
)
"
'
B’1
C+
.
4
;
"C9:%).;
1
%';;;
G:!H
41
%/1#41%/174
%1'4
FBB’
! < C
%FC %B’
' D2
Exercice 8. Chimiosélectivité de réducteurs
?1&?4
#
1C4
'
F9C?&4%
DA
" ?D>-
" " +""4!""+ ""
&C4
#
?D>-
C4
'
1>4=
?D>-
?K
L
D
A
-:!H
4A341171.64111/6'4111
-9:A3
A
"
"
+""G
[A]
"
H
1
/
3
100%