CHI242_CCmars_TP_2015-2016

Nom : Prénom : N° étudiant :
UE CHI242
Contrôle continu de TP CHIMIE ORGANIQUE
Mars 2016
Seule la calculatrice est autorisée, réponse sur la copie dans les espaces dédiés.
REACTION DE SUBSTITUTION
On souhaite réaliser la substitution nucléophile du 2-méthylbutan-2-ol (nom traditionnel : alcool
tertioamylique) par Cl- en milieux acide chlorhydrique.
1- Quelle est l’équation bilan de la réaction ?
2- Serait-il possible de réaliser la réaction en utilisant simplement une solution aqueuse
saturée de NaCl au lieu d’utiliser une solution aqueuse d’HCl ? Justifier.
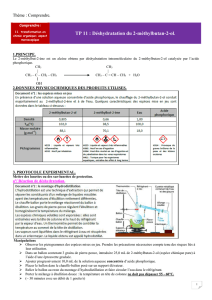
3- Mode opératoire
• Introduire (à l’aide d’un entonnoir) le volume correspondant à 0,4 mole d’HCl à 37% dans
une ampoule à décanter de 250 mL.
a-A quoi correspond ce pourcentage ?
b-Donner la concentration molaire de HCl
c-Quel volume sera-t-il nécessaire de prélever ?
• Dans un erlenmeyer de 50 mL, peser la masse correspondant à 0,1 mole de 2-méthylbutan-
2-ol et l’introduire dans cette même ampoule à décanter. Rincer l'erlenmeyer avec un peu de
solution acide.

Nom : Prénom : N° étudiant :
a-Sachant que les masses molaires sont pour C : 12 g.mol-1, H : 1 g.mol-1, O :
16 g.mol-1, quelle est la masse molaire de l’alcool ?
b-Quelle masse faudra-t-il prélever ?
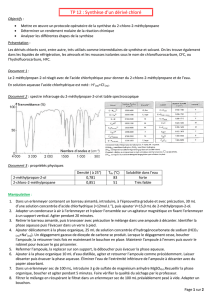
• Boucher le décanteur, le renverser en maintenant fermement le bouchon, agiter
énergiquement pendant cinq minutes, en prenant soin d'ouvrir fréquemment en début
d'agitation. Laisser décanter les deux phases liquides. Oter le bouchon du décanteur,
a- A quoi sert l’agitation ?
b-Pourquoi est-il nécessaire d’ouvrir régulièrement l’ampoule à décanter ?
c-A la fin de l’agitation pourquoi vous est-il demandé de laisser décanter avec
le bouchon enlevé ?
• Deux phases sont obtenues.
a-Qui sont-elles et que contiennent-elles ?
b- Ou se trouve la phase aqueuse ? Comment feriez-vous pour déterminer sa
position dans le décanteur ?
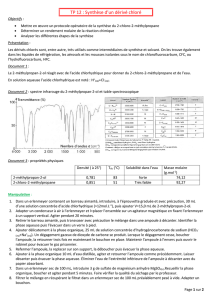
• Éliminer la phase aqueuse et "laver" la phase organique restant dans l'ampoule avec une
solution saturée d'hydrogénocarbonate ("bicarbonate") de sodium NaHCO3.
a- Quel est le rôle de ce lavage ?
b-Comment préparez-vous une solution saturée ?

Nom : Prénom : N° étudiant :
• ajouter 2 à 3 mL de cette solution à la phase organique, agiter modérément le décanteur en le
débouchant fréquemment
c-Qu’ observez-vous ?
d-Ecrire la réaction chimique qui se passe entre NaHCO3 et l’acide encore
présent dans le milieu.
•Laisser décanter et vérifier que la solution de lavage est basique au papier indicateur.
e- Pourquoi le pH est-il vérifié dans la phase aqueuse
f- Pourquoi ne pas utiliser NaOH au lieu de NaHCO3 ?
•laver rapidement deux fois par 2 à 3 mL d'eau
g-Quel est le but de ce lavage ?
• Recueillir le chlorure de tertioamyle dans un erlenmeyer de 50 mL sec et le "sécher" avec du
sulfate de sodium
h-Quelle est la formule du sulfate de sodium ?
i-Comment sait-on quelle quantité de sulfate de sodium ajouter ?
• Transvaser le chlorure "sec" dans un erlenmeyer taré et sec de 25 mL.
• Peser le produit brut obtenu

Nom : Prénom : N° étudiant :
j- On obtient 3,6 g de produit. Quel est le rendement de la réaction (avec Cl :
35,5 g.mol-1).
• En CPG, on observe la présence de deux produits minoritaires avec des temps de rétention
plus courts que le produit désiré.
k-Qui sont-ils ?
l- Pourquoi sortent-ils avant le chlorure de tertioamyle ?
m-A quoi correspond le temps de rétention ?
n- de quels facteurs est-il dépendant ?
o-Quel paramètre vous permet de déterminer la pureté du produit ?
Addition nucléophile
1-Nous souhaitons former du triphenyl methanol par synthèse magnésienne. Sachant que nous
souhaitons utiliser une cétone, donner la structure des réactifs dont vous auriez besoin.
2-Ecrire les équations bilan des trois étapes

Nom : Prénom : N° étudiant :
3-Faire le schéma clair (propre et annoté) du montage
4-Lors de la synthèse du magnésien,
a-Comment voit-on que la réaction a démarré ?
b-Pourquoi est-il nécessaire d’additionner lentement la solution du composé halogéné sur le
magnésium ?
5-La verrerie utilisée a été préalablement nettoyée avec de l’acétone. L’étudiant ne l’a pas
entièrement séché. Est-ce un problème ? Justifiez votre réponse.
7- a-Comment élimine-t-on le solvant de la réaction après hydrolyse et extraction ?
 6
6
1
/
6
100%