Acide phosphorique

Thème : Comprendre.
1
T.P : T.S. Déshydratation du 2-méthylbutan-2-ol.
1.PRINCIPE.
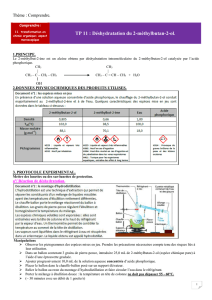
Le 2-méthylbut-2-ène est un alcène obtenu par déshydratation intramoléculaire du 2-méthylbutan-2-ol
catalysée par l’acide phosphorique.
CH3 CH3
CH3 – C – CH2 – CH3 CH3 – C = CH – CH3 + H2O
OH
2.DONNEES PHYSICOCHIMIQUES DES PRODUITS UTILISES.
2-méthylbutan-2-ol :
Teb = 102°C, densité d = 0,806,
Solubilité: eau (14% en masse à 30°C); infiniment soluble dans l’éthanol et l’éthoxyéthane.
Risques : R 10 ; R 23 ; R 24 ; R 25 ; R 36 ; R 37 ; R 38.
2-méthylbut-2-ène :
Teb = 38,6°C, densité d = 0,662,
Très peu soluble dans l’eau
Risques : R 11 ; R 36 ; R 37 ; R 38.
Acide phosphorique
Pureté 85% ; densité d = 1.69,
Risques : R 34.
3. PROTOCOLE EXPERIMENTAL.
Mettre des lunettes ou des sur-lunettes de protection.
1°/ Réaction de déshydratation.
Dans un ballon de 250 mL introduire :
Quelques grains de pierre ponce
31 mL de 2-méthylbutan-2-ol (distribué par le professeur),
10 mL d’acide phosphorique (distribué par le professeur),
Fixer le ballon dans le montage de distillation.
Placer l’erlenmeyer destiné à recevoir l’alcène dans un bain d’eau glacée, le fixer.
Distiller l’alcène, la température ne doit pas dépasser 55 °C.
Arrêter de distiller lorsque le débit devient négligeable ( ~ 30 minutes avec un débit de 1 goutte/s)
Pendant le distillation que surveille un élève, l’autre élève prépare :
15 mL de solution saturée de chlorure de sodium (Premier bécher étiqueté)
15 mL d’une solution d’hydroxyde de sodium à 2,5 mol.L-1 (Second bécher étiqueté).
2°/ Isolement du produit brut.
Mettre des gants.
Transvaser le mélange réactionnel dans l’ampoule à décanter en utilisant un entonnoir et en ayant soin de ne
pas introduire les grains de pierre ponce dans l’ampoule à décanter.
Rincer l’erlenmeyer avec la solution saturée de chlorure de sodium, ajouter dans l’ampoule à décanter.
Agiter, dégazer. Eliminer la phase aqueuse.
Ajouter les 15 mL d’hydroxyde de sodium.
Agiter, dégazer, laisser décanter. Eliminer la phase aqueuse.
Laver la phase organique avec 15 mL d’eau distillée prélevée à l’éprouvette, jusqu’à atteindre le pH de l’eau
de lavage (~ 6)
Recueillir la phase organique dans un erlenmeyer de 100 mL, ajouter une spatule de sulfate de magnésium
anhydre, agiter quelques minutes. Filtrer sur coton de verre dans un erlenmeyer de 100 mL préalablement
taré.
Peser le produit obtenu.

Thème : Comprendre.
2
4. EXPLOITATION.
1. Faire un schéma du montage.
2. Quel est le rôle de l’acide phosphorique ?
3. Justifier la position respective des phases aqueuse et organique dans l’ampoule à décanter.
4. Déterminer le rendement de la réaction.
5. Que permet de vérifier le spectre infrarouge du produit obtenu donné ci-dessous ?
6. Quel test peut être fait sur le produit obtenu ? Réaliser ce test après accord du professeur.
7. A partir des formules développées du réactif et du produit, justifiez le titre de ce t.p ?
8. Quels sont les rôles de :
- La pierre ponce
- La solution saturée du chlorure de sodium
- La solution d’hydroxyde de sodium
- Le lavage à l’eau distillée
9. Justifier la nécessité de recueillir le distillat dans un bain de glace.
10. Quel isomère peut se former en petite quantité lors de la déshydratation ? (nom et formule)

Thème : Comprendre.
3
Déshydratation du 2-méthylbutan-2-ol.
Fiche matériel.
Solutions :
Pierre ponce.
Acide phosphorique (10 mL / binôme)
2 méthylbutan-2ol (31 mL / binôme)
15 mL solution saturée de NaCl (dans bécher étiqueté n°1)
15 mL solution NaOH à 2,5 mol.L-1 (dans bécher étiqueté n°2)
Sulfate de magnésium anhydre
Eau distillée
Glaçons
Verreries :
Ballon 250 mL
Montage distillation
Erlenmeyer (qui doit se trouver dans un bain eau glacée) + thermomètre.
Ampoule à décanter
Papier pH
Erlenmeyer (n°2) 100 mL +coton + entonnoir ‘pour filtrer)
Gants + lunette de protection
Spatule
Bécher poubelle
1
/
3
100%