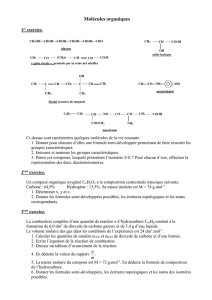
8 Groupes caractéri..

Chap 8 : GROUPES CARACTERISTIQUES ET REACTIVITE 1ère S
I] Six familles de composés définies par leur groupe caractéristique.
1. Définition.
Dans une molécule organique, on appelle groupes caractéristiques tous ceux qui correspondent à des liaisons autres que des
liaisons simples entre C et H.
Ex : but-1-ène : les deux C sont reliés par une double liaison et constituent le groupe caractéristique.
Le groupe caractéristique de la molécule lui confère l'appartenance à une famille ainsi que des propriétés caractéristiques.
Pour reconnaître la famille à laquelle une espèce appartient, il y a 2 possibilités :
On identifie le groupe caractéristique à partir de la formule correspondant à l'espèce .
On cherche à mettre en évidence, par un test , une des propriétés caractéristiques de la famille considérée.
2. Les principales familles chimiques.
3. Nomenclature. Le nom des espèces possédant un groupe caractéristique est constitué selon les cas par un radical auquel on a
adjoint un préfixe, et / ou un suffixe.
Famille
Suffixe
Préfixe
Alcool
ol
(hydroxy)
Composé halogéné
/
chloro, bromo, iodo
Cétone
one
(oxo)
Aldéhyde
al
(oxo)
Acide carboxylique
oïque
(carboxy)
Amines
Amine
(amino)

NB : les préfixes entre parenthèses dans le tableau ne s'utilisent que dans le cas de molécules possédant plusieurs groupes
caractéristiques. Ex : acide 2-aminopropanoïque.
Voir fiche jointe.
4. Utilisation des écritures topologiques. Les conventions vues pour les alcanes s'appliquent. Les atomes de C et H sont
obligatoirement indiqués ainsi que les atomes H qui leur sont attachés.
5. Les tests caractéristiques des différentes familles.

II] Réactivité des alcools.
1. Oxydation.
On distingue deux types d'oxydations.
a) Oxydation complète ou combustion.
Il s'agit de la transformation au cours de laquelle le carbone de la molécule est converti en CO2 et H2O. Elle s'accompagne donc de la
destruction de la chaîne carbonée. Ex :
CH3—CH2—OH (l) + 3O2 (g) 2CO2 (g) + 3H2O (g)
b) Oxydation ménagée.
La chaîne carbonée est ménagée c'est-à-dire conservée au cours de cette transformation. On n'observe que l'oxydation du carbone
fonctionnel porteur du groupe hydroxyle.
Oxydation de l'éthanol (alcool primaire) par O2 en présence du catalyseur cuivre :
2 CH3—CH2—OH + O2 2 CH3—CHO + 2H2O
L'éthanal (CH3—CHO) peut, à son tour, être oxydé en acide éthanoïque (CH3—COOH) suivant l'équation :
2 CH3—CHO + O2 2 CH3—COOH
On observe un passage d'une fonction alcool primaire à un aldéhyde puis éventuellement (si l'on dispose de suffisamment d'oxydant) à
un acide carboxylique.
2. Déshydrogénation catalytique de l'éthanol.
Par passage de l'éthanol gazeux sur du cuivre (catalyseur) à 300°C, on observe une déshydrogénation (élimination d'une molécule de
dihydrogène) de l'éthanol en éthanal.
3. Oxydation ménagée du butan-1-ol par les ions permanganate en milieu acide.
Cette oxydation conduit au butanal et à l'acide butanoïque si l'oxydant MnO4– en milieu acide est en excès. D'une façon plus générale,
un alcool primaire fait partie du couple rédox : R—CH2—OH / R—CHO et l'ion permanganate fait partie du couple : MnO4– / Mn2+.
R—CH2—OH
=
R—CHO + 2H+ + 2e-
x 5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x 2
5R—CH2—OH + 2MnO4– + 6H+
5R—CHO + 2Mn2+ + 8H2O
En présence d'un excès d'oxydant, l'aldéhyde peut, à son tour, subir une oxydation en acide carboxylique. Les couples mis en jeu sont
alors: R—COOH / R—CHO et MnO4– / Mn2+.
R—CHO+ H2O
=
R—COOH + 2H+ + 2e-
x 5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x 2
5 R—CHO+ 2MnO4– + 6H+
5R—COOH + 2Mn2+ + 3H2O
NB: Il est possible d'oxyder l'alcool R—CH2—OH directement en acide carboxylique soit en faisant la somme des deux dernières
équations, soit en considérant les couples mis en jeu : R—COOH / R—CH2—OH et MnO4– / Mn2+. l'équation de cette oxydation est :
5R—CH2—OH + 4MnO4– + 12H+ 5R—COOH + 4Mn2+ + 11H2O
4. Oxydation ménagée d'un alcool secondaire, le butan-2-ol, par les ions permanganate en milieu acide :
Cette oxydation ménagée conduit à une cétone (mise en évidence par sa réaction avec la DNPH et son absence de réaction avec le
réactif de Schiff). Elle ne se poursuit pas jusqu'à un acide carboxylique même en présence d'un excès d'oxydant.
Les couples mis en jeu sont : CH3—CH2—CO—CH3 / CH3—CH2—CHOH—CH3 et MnO4– / Mn2+.
CH3—CH2—CHOH—CH3
=
CH3—CH2—CO—CH3+ 2H+ + 2e-
x5
MnO4– + 8H+ + 5e-
=
Mn2+ + 4H2O
x2
5CH3—CH2—CHOH—CH3+ 2MnO4– + 6H+
5CH3—CH2—CO—CH3 + 2Mn2+ + 8H2O
Résumé :

5. Déshydratation des alcools.
Une molécule d'alcool peut se déshydrater en éliminant les atomes O et H de son groupe caractéristique et un atome H d'un
carbone voisin. Il se forme un alcène et de l'eau.
La déshydratation est 1 cas particulier de réaction d'élimination.
Ex : C4H9–CH2–CH2–OH C4H9 – CH = CH2 + H2O
L'alcène formé peut être mis en évidence par un test au dibrome.
Modification de la géométrie : les atomes C tétraédriques deviennent plans.
Modification des liaisons : apparition d'une double liaison C=C.
6. Substitution – passage d'un alcool à un composé halogéné.
Au cours d'une réaction de substitution, un groupe d'atome est remplacé par un autre groupe (ou 1 atome). Les alcools
peuvent subir une telle transformation; leur groupe caractéristique – OH peut, par exemple, être remplacé par un halogène.
Ex : réaction du méthylpropan-2-ol avec l'acide chlorhydrique :
C4H9–OH + H+(aq) + Cl-(aq) C4H9–Cl + H2O

III] Passage d'un groupe caractéristique à un autre.
1. Chimie créatrice.
Grâce au passage d'un groupe caractéristique à un autre, la chimie organique est une chimie créatrice de nouvelles molécules.
2. Chimie industrielle du méthanol.
Le méthanol est transformé industriellement en d'autres produits de base de l'industrie par réaction de substitution ou d'oxydation.
En outre, par déshydratation intermoléculaire avec le méthylpropan-2-ol, on obtient le MTBE C5H12O (méthyltertiobutyléther),
principal additif des essences : CH3OH + C4H9OH CH3–O–C4H9 + H2O
1
/
5
100%