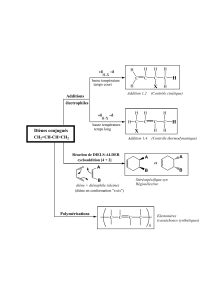
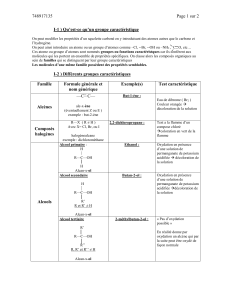
sujet - profdephysique

OH
OH
OH
OOOO
OH
HO
OH
O
OH
O
O
ACCOMPAGNEMENT PERSONNALISÉ TS
RÉVISIONS DE CHIMIE ORGANIQUE
Exercice 1 : Reconnaître la classe d’un alcool
Nommer et déterminer la classe des alcools dont la formule topologique est donnée
ci-dessous.
A : B : C :
D : E : F :
(phénylméthanol)
Exercice 2 : Identifier les aldéhydes et les cétones
Reconnaître et nommer les aldéhydes et les cétones parmi les composés oxygénés
dont les formules sont données ci-dessous.
a. b. c. d.
Exercice 3 : Passer du nom à la formule
Établir la formule topologique des molécules dont les noms sont donnés ci-dessous :
a. 3-méthylbutanal b. hexan-2-one c. acide butanoïque
d. acide 2-méthylpropanoïque e. 2,3-diméthylbutanal
f. 3-éthyl-3,5-diméthylheptan-2-one g. acide 2-éthyl-3,4-diméthylpentanoïque
Exercice 4 : Oxydation d’un alcool
1. Écrire les formules topologiques de tous les produits pouvant être obtenus lors de
l’oxydation en milieu acide des alcools ci-dessous par l’ion permanganate en excès
ou en défaut lorsque cette oxydation est possible.
a. CH3-OH b. CH3-CH(OH)-CH3
c. d. e.
2. Écrire la formule topologique des alcools qui ont donné, par oxydation, les
produits ci-dessous :
a. éthanal b. acide propanoïque
c. butanone d. cyclohexanone
Exercice 5 : Écrire des équations d’oxydoréduction
Établir l’équation de la réaction qui a lieu, en milieu acide, entre les ions
permanganate MnO4-(aq) et :
1. le pentan-1-ol CH3 – CH2 – CH2 – CH2 – CH2 – OH, pour donner :
a. du pentanal CH3 – CH2 – CH2 – CH2 – CH = O ;
b. de l’acide pentanoïque CH3 – CH2 – CH2 – CH2 – COOH.
2. le pentan-2-ol pour donner de la pentan-2-one.
DONNÉE : couple oxydant/réducteur MnO4-(aq) / Mn2+(aq).
Exercice 6 : Identification de composés oxygénés
On dispose de cinq flacons contenant des liquides inconnus A, B, C, D et E, tous
différents mais de formule brute C3HxOy.
Chaque composé ne présente qu’un seul groupe caractéristique oxygéné.
Les chaînes carbonées de ces composés ne contiennent ni double liaison C = C, ni
cycle.
Parmi les cinq composés, deux sont des alcools. L’oxydation de A conduit à C ou D ;
celle de B conduit à E.
1. Ces données sont-elles suffisantes pour identifier les cinq composés ?
2. Le composé C réagit avec la liqueur de Fehling, contrairement à D. En déduire la
formule topologique et le nom de ces cinq composés.
Exercice 7 : Déterminer un rendement
La butanone C4H8O est utilisée comme solvant dans des peintures, encres
d’imprimantes, colles, etc. Une quantité n’ = 0,151 mol de butanone a été obtenue
lors de la réaction en milieu acide mettant en jeu des quantités n1 = 0,177 mol de
butan-2-ol C4H10O et n2 = 0,177 mol d’ions permanganate MnO4-(aq) selon l’équation :
5 C4H10O(ℓ) + 2 MnO4-(aq) + 6 H+(aq) → 5 C4H8O(ℓ) + 2 Mn2+(aq) + 8 H2O(ℓ).
1. Quel est le réactif limitant ?
2. Déterminer le rendement de cette réaction.
Exercice 8 : Pourcentage massique et formule d’alcools
On appelle pourcentage massique P d’un élément dans une molécule, le quotient de
la masse de cet élément dans une mole de molécules par la masse molaire de la
molécule.
On considère un alcool A qui a la même chaîne carbonée qu’un alcane comportant n
atomes de carbone.
1. Exprimer la formule brute de l’alcool en fonction de n.
2. En déduire l’expression de la masse molaire de A en fonction de n.
3. Le pourcentage massique de l’élément oxygène dans la molécule A est
P(O) = 26,7 %.
a. Déterminer la valeur de n et la formule brute de A. En déduire les formules
topologiques possibles pour A.
b. Identifier A sachant que c’est un alcool primaire.
OH
OH
OH
O
1
/
1
100%