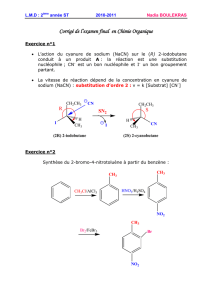
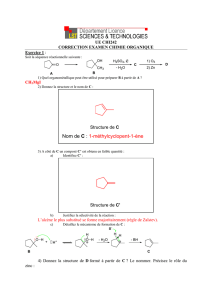
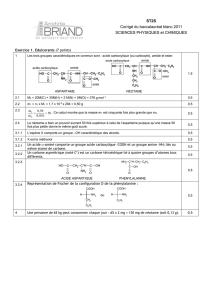
Corrigé - Université du Maine

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique Session 2-2002/2003-Corrigé
Chimie Organique – Examen(session 2 – 2002/2003)
Corrigé
1.Question de cours :
1) Mécanisme de réaction des dérivés d'acides R-CO-Z avec un nucléophile:
• Avec un nucléophile fort, chargé
RC
O
ZRC
Y
O
Z
R
Y
O
ZRC
O
Y
Addition + Y
Elimination + Z
• Avec un nucléophile faible avec catalyse acide.
C
Z
R
OC
Z
R
OHC
Z
R
OHH
Addition C
Z
R
OH
Y-H Y
+ H
C
Z
R
OH
Y
+ H
C
Z
R
OH
Y
H
RC
O
Y+ Z-H + H
Elimination
δ+ δ−
-I fort -I +( -M) -I -I+(+I) -I faible
2) Ordre de réactivité de ces composés R-CO-Z : il dépend du caractère positif du carbone soit des effets électroniques.
On peut considèrer que les effets mésomère sont identiques : orbitales 2s recouvrant une autre orbitale 2s (vrai en toute rigueur
pour le fluor ! ).
CRX
O
CRO
O
CROH
O
CROR
1
O
CRN
2
O
C
O
R
>>
diminution du caractère positif du carbone
diminution du pouvoir nucléofuge
>>
Effets électroniques sur le carbone :
H
3) Préciser si les transformations ci-dessous sont possibles et dans quelles conditions.
a) Chlorure d'acide → Acide : possible : addition d’eau ; réaction totale
b) Acide → Amide : possible : formation d’abord d’un sel (produit cinétique) puis en chauffant formation de
l’amide ( produit thermodynamique)
c) Amide → Chlorure d'acide :réaction impossible
d) Ester 1 → Ester 2 :possible : catalyse acide ou basique
d) Anhydride → Chlorure d'acide : réaction directe impossible
e) Amide → Ester : réaction difficile ! chauffage catalyse basique
2. Mécanismes :
1)
a) Halogènure benzylique formation facile du carbocation :
Cl
CH3
C6H5
HCH3
C6H5
H
OH
CH3
C6H5
H
OH
H3CC6H5
H
+
SN1 OH
b) Halogènure secondaire, bon nucléophile :

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique Session 2-2002/2003-Corrigé
Cl
C3H7
H3C
HOH
SN2 OH
CH3
C3H7
H
c) Halogènure secondaire, base forte , chauffage :
Br
HE
t
H
EtH
3
C
OH
E2 CH
3
E
t
H
Et
Z
2) C’est une AdE qui se fait sur la double liaison la plus riche en électrons. (Les autres doubles liaisons sont conjuguées avec
un groupe carbonyle et donc appauvries en électrons par effet –M). Cette addition se fait par le côté du plan le plus dégagé et
un iodonium est formé sur les liaisons e,a. L’attaque à 180° du nucléophile conduit alors au composé trans
O
CH
3
H
CH
3
I
2
/AgOAc
O
CH
3
H
CH
3
I
OCOCH
3
CH
3
H
I
O
CH
3
H
I
H
H
AcO
=
3) L'acide glucuronique contient une fonction acétal ; en milieu acide cette fonction conduit facilement à un carbocation
stabilisé. L’attaque de l’eau conduit à une racémisation de ce carbone.
H
COOH
H
HOH
OHH
OH
C
R'
RO
H
O-H
H
H
C
R'
RO
H
OC
R'
H
R
carbocation : racémisation
O
OH
4) Le" Flosal"
C H O
C H O
O
+
C HO
O H
O
CHO
C H O
O H
E
O
+ H
2
O
H
2
O
3. Synthèses
1) Synthèse de composés aromatiques :

Université du Maine - Faculté des Sciences ⌫ Retour LCU4 – Chimie Organique Session 2-2002/2003-Corrigé
NH
2
Et
NO
2
HNO
3
/H
2
SO
4
NO
2
Réduction
H
2
, Cat
SE
NO
2
EtBr/Ac Lewis
SE
D
EtBr/Ac Lewis
SE
Et
SE
H
2
SO
4
Et
SO
3
H
Et
SO
3
H
HNO
3
/H
2
SO
4
SE
H
2
O/H
2
SO
4
E
séparation
o,p
2) Synthèse de la phéromone 7
OH O
AdE
OBr OO
(CH2)7
SN
OO
(CH2)7
SN
OO
(CH2)7
SN
OO
(CH2)7
Réduction) OH
(CH2)7
Déblocage
OCOCH3
(CH2)7
1 2
3 4
5 6
7
La réduction de la double liaison par Na/NH3 conduit à un alcène de configuration E.
1
/
3
100%