Peut-on conseiller l`aspartame pendant la

Les sujets du mois
#
2
Nutrition
Élisabeth JOSSE, Sage-femme
DU Nutrition et maladies métaboliques, Université de Rennes,
Responsable pédagogique de Médic Formation
Les sages-femmes, quel que soit leur
mode d’exercice ou le moment où elles
interviennent auprès des patientes (en
préconceptionnel, en suivi de grossesse,
en préparation à la naissance, en post-
natal et même en suivi gynécologique),
ont de multiples occasions de conseiller
en matière de nutrition. Parfois le conseil
nutritionnel concerne la prévention de
pathologies (prise de poids excessive,
diabète gestationnel…) mais souvent il
ne fait que répondre aux interrogations
multiples de ces patientes. L’aspartame
fait partie de ces interrogations, tant les
messages à son sujet sont contradictoires.
Que doit répondre la sage-femme à une
femme enceinte qui demande si elle peut
consommer de l’aspartame ? La sage-
femme peut-elle spontanément conseiller
à une patiente d’utiliser l’aspartame afin
d’aider à une prise de poids modérée ou
à mettre en place un régime en cas de
diabète gestationnel avéré ?
Peut-on conseiller
l’aspartame pendant la
grossesse ?
L’ aspartame est classé dans la catégorie des
édulcorants intenses, parmi les substances
chimiques (avec la saccharine, le cyclamate,
l’acésulfame…). Il existe également des édulco-
rants intenses d’origine végétale (la stévioside plus
communément appelée la stévia, la thaumatine, la
monelline…). Le pouvoir sucrant de ce type d’édul-
corants atteint plusieurs centaines de fois celui du
sucre. Ils n’apportent pas (ou réellement très peu) de
calories, ce qui en fait les “stars” des produits allégés.
Après la saccharine, l’aspartame est le deuxième
édulcorant artificiel le plus utilisé dans le
monde. En ce qui concerne la consommation mon-
diale, l’aspartame représente 62 % de la valeur du
marché des édulcorants intenses (Fry, 1999). Il est
recensé dans plus de 5 000 produits dits “allégés”
dans le monde, dont environ 2 000 en Europe. Les
produits les plus susceptibles de contenir de l’as-
partame, en plus de l’édulcorant de table, sont les
boissons, les chewing-gums, les desserts, les produits
laitiers, les confitures, les produits de confiserie,
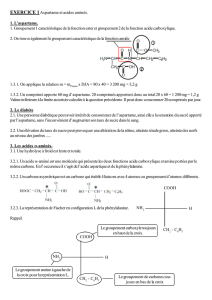
L’aspartame est l’ester méthylique d’un
dipeptide composé des acides aminés,
acide L-aspartique et L-phénylalanine. Il
se présente sous la forme d’une poudre
blanche, inodore, cristalline qui a un pouvoir
sucrant environ 200 fois supérieur à celui
du saccharose utilisé comme référence.
Molécule de l’aspartame. ©DR
JANVIER 2013 ⁛ N° 422 ⁛ Les Dossiers de l’Obstétrique 9

PEUT-ON CONSEILLER L’ASPARTAME
PENDANT LA GROSSESSE ? ÉLISABETH JOSSE
MÉTABOLISATION DU COMPOSÉ
Chez les animaux de laboratoire comme chez
l’homme, l’aspartame est métabolisé dans le tractus
gastro-intestinal en méthanol, acide aspartique et
phénylalanine. Sur une base pondérale, le méta-
bolisme de l’aspartame génère approximativement
50 % de phénylalanine, 40 % d’acide aspartique et
10 % de méthanol. Après absorption, ils sont ensuite
utilisés, métabolisés et/ou excrétés par le corps en
suivant les mêmes voies métaboliques que lorsqu’ils
sont consommés par l’alimentation ordinaire.
Si l’on s’attarde davantage sur les métabolites de
décomposition de l’aspartame, on retrouve les élé-
ments de suspicion qui pèsent sur l’aspartame depuis
plus de trente ans :
n La phénylalanine est un acide aminé naturellement
présent dans l’alimentation. Cependant, elle est dan-
gereuse pour les personnes atteintes de phénylcé-
tonurie qui ne peuvent pas la métaboliser [2]. C’est
pourquoi, dans le cadre de la phénylcétonurie, les re-
commandations sont clairement d’éviter l’aspartame.
n
L’acide aspartique est l’un des 20 acides-α-aminés
constituant les protéines. Chez les mammifères,
il est non essentiel. Il peut servir de neurotrans-
metteur excitant dans le cerveau sous sa forme
méthylée et participe à la gluconéogénèse. L’acide
aspartique a un point isoélectrique de 2,85 ce
qui en fait le plus acide des acides aminés. Ainsi
il pourrait être acidifiant pour l’organisme.
n
Le méthanol, contenu dans l’aspartame, se métabo-
lise en dioxyde de carbone et en eau. Cependant,
il se transforme en formaldhéhyde puis en acide
formique lorsque la température d’exposition de
l’aspartame dépasse les 86 °F soit environ 30 °C
(par un phénomène d’oxydation prolongée).
L’aspartame n’est donc pas utilisable dans des
produits alimentaires qui vont être chauffés. Il va
d’ailleurs perdre de son pouvoir sucrant et devenir
plus amère. La problématique reste le stockage des
produits contenant de l’aspartame lors du cycle
de production-distribution, en particulier pour les
boissons car l’aspartame est moins stable dans des
solutions aqueuses, qui exposent la molécule à
une température parfois supérieure à 30 °C (stoc-
kage des palettes au soleil pendant plusieurs jours)
ou l’utilisation de l’aspartame dans des boissons
chaudes (café, thé…). Or, la majorité des ventes de
l’aspartame est attribuée à des boissons gazeuses.
En outre, la transformation en acide formique
augmenterait l’acidose métabolique. Cependant
il est à noter que l’alimentation apporte des doses
de méthanol aussi importantes que la consomma-
tion d’aspartame et que le méthanol est produit
naturellement par le métabolisme des organismes
anaérobies de nombreuses variétés de bactéries.
les produits hypocaloriques et amaigrissants, mais
également certains médicaments et vitamines et
minéraux à croquer, destinés aussi bien aux adultes
qu’aux enfants.
L’aspartame a été découvert par hasard en 1965 au
laboratoire Searle, aux États-Unis, par un chimiste qui
cherchait à mettre au point un médicament contre
les ulcères. En goûtant une pincée de sa poudre, il
se serait rendu compte qu’elle avait un goût éton-
namment sucré. Cette découverte tombait au bon
moment pour l’industrie alimentaire, qui cherchait
une solution de rechange aux cyclamates et à la
saccharine, interdits dans les aliments par le gou-
vernement depuis que des études chez les animaux
avaient révélé qu’ils entraînaient des cancers.
C’est la configuration de la molécule de l’aspar-
tame qui permet d’activer plus de récepteurs sur la
langue (les papilles) donnant alors l’impression d’un
goût plus sucré que celui du saccharose. Pour activer
les récepteurs linguaux du goût sucré, une molécule
doit comporter trois régions caractéristiques :
• un groupement NH ou OH,
• un atome d’oxygène ou d’azote,
• un groupement hydrophobe.
Il faut que ces régions moléculaires soient espacées
d’une certaine distance et variant peu, c’est le cas
de l’aspartame.
Figure 1 : Formule chimique de
l’aspartame (Source : Additifs et
auxiliaires de fabrication dans les
industries agroalimentaires [1]).
Repères historiques de l’Autorisation
de Mise sur le Marché (AMM)
1974 Première AMM aux USA puis suspension de l’AMM pour
possibles effets toxiques et cancérogènes sur le cerveau
de ce composé ou de ses métabolites.
1981
Nouvelle AMM accordée par la FDA pour utilisation dans
les aliments solides.
1983 Autorisation étendue aux boissons gazeuses.
1988 Autorisation de l’aspartame en France.
1995 Harmonisation de son utilisation au niveau de l’Union
Européenne grâce à la directive 94/35/CE. Approbation
dans plus de 90 pays et Dose Journalière Admissible (DJA)
confirmée à 40 mg/kg de poids corporel.
Mai 2011 La Commission européenne invite l’Autorité européenne
de sécurité des aliments (EFSA) à anticiper la réévaluation
complète de la sécurité de l’aspartame suite à deux études
publiées (Soffritti sur le cancer et Halldorsson sur les ac-
couchements prématurés).
Fin 2012 Attente des résultats de cette réévaluation.
10 Les Dossiers de l’Obstétrique ⁛ N° 422 ⁛ JANVIER 2013

Nutrition
Une seconde étude, cette fois-ci norvégienne
(Englund-Ogge et al. 2012 [4]), confirme une associa-
tion statistique sur 60 000 femmes enceintes, entre
l’augmentation du risque de prématurité et la consom-
mation quotidienne de boissons, qu’elles soient édul-
corées ou sucrées, sans établir de lien de causalité.
Ces deux études, à elles seules, seraient suffisantes
pour répondre à la question que pose cet article : la
consommation d’aspartame, comme celle de sucre
ajouté, semble avoir un effet délétère sur l’issue de
la grossesse.
Mais allons plus loin sur les effets de la consom-
mation d’aspartame.
DÉSORDRES NEUROLOGIQUES
Les auteurs ne sont pas d’accord sur l’hypothèse
du passage des métabolites de l’aspartame à travers
la barrière hémato-placentaire et la barrière hémato-
encéphalique du fœtus. Or, certains métaboliques
sont classés parmi les neurotoxiques dont l’effet est
difficile à évaluer pendant la période d’embryogé-
nèse. Ainsi, plusieurs études attestent-elles l’augmen-
tation du taux de certains neurotransmetteurs après
l’ingestion d’aspartame, dont celle de Coulombe
RA Jr, Sharma RP [5]. Ces deux auteurs expliquent
dans le contexte de leur étude que l’aspartame a été
signalé responsable de troubles neurologiques
et comportementaux chez les personnes
sensibles. L’aspartame interfère également avec
le traitement anti-épileptique et augmente le seuil
des crises convulsives [6].
Le Dr Russell L. Blaylock, professeur en neurochi-
rurgie à l’Université de médecine du Mississippi, a pu-
blié récemment un ouvrage détaillant les dommages
causés par l’ingestion excessive d’acide aspartique
issu de l’aspartame. Il fait mention de près de 500
références scientifiques afin de démontrer comment
un excès d’acides aminés libres excitateurs tel que
l’acide aspartique dans notre alimentation peut causer
de sérieux désordres neurologiques chroniques.
Une étude publiée en 2006
[7]
conclut que
des symptômes neurologiques, y compris les
processus d’apprentissage et de mémoire,
peuvent être liés à des concentrations élevées ou
toxiques des métabolites de l’aspartame.
Une autre étude publiée en 2008
[8]
précise que la
phénylalanine joue un rôle important dans la régula-
tion des neurotransmetteurs, tandis que l’acide aspar-
tique joue un rôle en tant que neurotransmetteur
n Quant au formaldhéhyde, il est classé comme
substance cancérogène avérée pour l’homme
uniquement pour les cancers du nasopharynx
par inhalation. À ce jour, il n’y a pas de données
épidémiologiques concernant l’induction de tu-
meurs par la voie orale et les résultats des études
chez l’animal sont équivoques.
n Pour finir, en solution, l’aspartame tend à se dégra-
der en dicétopipérazine, substance qui, lorsqu’elle
est chauffée, est soupçonnée de pouvoir conduire
à la formation de nitrosamines, produits cancéri-
gènes. La dicétopipérazine est formée dans des
produits liquides contenant de l’aspartame au
cours d’un stockage prolongé.
DOSE JOURNALIÈRE ADMISSIBLE OU DJA
Malgré ces données assez préoccupantes pour la
santé, de nombreuses études contradictoires ont été
publiées depuis 1974. L’obligation pour un expert
ou un chercheur de déclarer des conflits d’intérêts
avec des industriels date seulement de 2004. Ainsi,
sur la base des études disponibles, un comité mixte
OMS (Organisation Mondiale de la Santé)/FAO
(Organisation pour l’Alimentation et l’Agriculture)
a établi l’innocuité de l’aspartame en 1981 et a fixé
une DJA de 40 mg/kg de poids corporel/jour en
Europe, ce qui correspond, en termes de saveur su-
crée, à 5 fois la consommation journalière moyenne
de saccharose pour une personne de 60 kg.
Lorsque l’on procède à une revue des publications
récentes, trois axes d’études sont particulièrement
préoccupants : l’influence de la consommation d’as-
partame sur :
• Les risques d’accouchements prématurés,
• Les risques de cancers,
• Les désordres neurologiques et psychiques.
LES ACCOUCHEMENTS PRÉMATURÉS
Au Danemark, l’équipe d’Halldorsson [3] a effec-
tué une étude de cohorte prospective avec 59 334
femmes enceintes sur la prise de boissons gazeuses
sucrées artificiellement et le risque d’accouchement
prématuré. Les résultats montrent qu’il y avait pour
cette cohorte importante une association entre la
consommation de boissons édulcorées gazéifiées
et non gazéifiées non alcoolisées et un risque accru
d’accouchement prématuré provoqué, et cela dès
une portion de boisson gazeuse édulcorée consom-
mée par jour.
Dans cette étude, il serait intéressant de connaître
les indications de l’induction des accouchements
prématurés. En fonction des pathologies qui indi-
quaient les interruptions prématurées de grossesses,
on pourrait évaluer plus précisément les risques liés
à l’aspartame.
…il y avait une association entre la consommation
de boissons édulcorées gazéifiées et non
gazéifiées non alcoolisées et un risque accru
d’accouchement prématuré provoqué…
JANVIER 2013 ⁛ N° 422 ⁛ Les Dossiers de l’Obstétrique 11

PEUT-ON CONSEILLER L’ASPARTAME
PENDANT LA GROSSESSE ? ÉLISABETH JOSSE
Il faut savoir également que les scientifiques ne
s’entendent pas sur les relations entre les édulcorants
et les lymphomes, les leucémies, le syndrome de fa-
tigue chronique, la maladie de Parkinson, la maladie
d’Alzheimer, la sclérose en plaques, l’autisme, et le
lupus systémique (Whitehouse CR et al. 2008 [11]).
SI L’ASSOCIATION FAIT LE POISON… ?
En une cinquantaine d’années, notre alimentation
a été totalement modifiée. De nombreux additifs
alimentaires n’existaient pas. La difficulté des au-
torités actuellement est de, non seulement définir
une dose sécuritaire pour un additif donné, mais
également d’anticiper sur les éventuelles interactions.
Ainsi l’effet “cocktail”, comme on le nomme, est-il
sujet à de nombreuses recherches à venir. Ainsi dé-
couvre-t-on dans l’étude publiée en juin dernier par
Collison et al.
[12]
, que l’aspartame et le glutamate
monosodique entrent en synergie lorsqu’ils sont
ingérés ensemble et favorisent l’hyperglycémie et
l’intolérance à l’insuline.
ÉVALUATION BÉNÉFICES-RISQUES
Tout d’abord, nous pouvons définir que l’essentiel
des personnes, femmes enceintes comprises, qui
consomment des produits édulcorés, le fait pour
éviter de prendre du poids, pour maigrir ou parce
qu’elles sont diabétiques et veulent éviter les hy-
perglycémies.
Même si l’aspartame utilisé en remplacement
du sucre réduit la valeur calorique du produit ali-
mentaire, nous ne retrouvons pas de preuve que
l’utilisation d’édulcorants ait un effet pour
réduire la surcharge pondérale. C’est ce que
confirme Lean dans son article déjà cité [13] : « […]
Mais la preuve que l’aspartame empêche la prise de
poids ou l’obésité est généralement peu concluante… ».
Peut-être les produits allégés n’ont-ils pas le même
effet satiétogène qu’un produit non allégé même si
aujourd’hui aucune étude ne l’atteste ? Une autre
hypothèse serait que l’on a tendance à compenser le
déficit énergétique à moyen ou long terme, par des
portions plus importantes car allégées, par exemple.
Cependant, l’étude récente d’Anton SD and al. [14]
semble contredire cette hypothèse. En effet, lors
de la consommation de stévia et d’aspartame, les
participants n’ont pas compensé en mangeant plus à
chaque repas (déjeuner ou dîner) et ont déclaré des
niveaux semblables de satiété par rapport à quand ils
ont consommé plus de calories avec le saccharose.
Compte tenu du fait qu’il n’est pas prouvé que
l’utilisation d’aspartame réduit la surcharge pon-
dérale, il n’y a pas de bénéfice à conseiller aux
patientes enceintes de consommer de l’aspartame
dans le but de réduire leur prise pondérale pendant
la grossesse.
excitateur du système nerveux central. Les auteurs
concluent que l’ingestion excessive d’aspartame
pourrait être impliquée dans la pathogénie de
certains troubles mentaux (DSM-IV-TR, 2000)
et aurait des effets sur l’apprentissage et le
fonctionnement émotionnel.
L’étude de Walton, Hudak et Green-Waite en 1993
pointait déjà l’aspartame comme favorisant poten-
tiellement des symptômes dépressifs chez cer-
taines personnes vulnérables [9]. Cette étude était
conçue pour déterminer si les personnes souffrant
de troubles d’humeur sont particulièrement vulné-
rables aux effets néfastes de l’aspartame. Bien que le
protocole ait nécessité le recrutement de 40 patients
souffrant de dépression unipolaire et d’un nombre
similaire d’individus sans antécédents psychiatriques,
le projet a été interrompu par l’Institutional Review
Board, en raison de la gravité des réactions au sein du
groupe de patients ayant des antécédents de dépres-
sion. Au moment de l’interruption du projet, il y avait
déjà une différence significative entre l’aspartame et
le placebo en nombre et en gravité des symptômes
chez les patients ayant des antécédents de dépression.
A contrario, aucune différence n’avait été observée
dans le groupe des individus sans antécédents psy-
chiatriques. Les auteurs concluaient que les individus
avec un trouble de l’humeur étaient particulièrement
sensibles à l’aspartame et son utilisation dans cette
population devrait être découragée.
CANCER
Un article [10] présente une sélection d’études me-
nées dans les laboratoires du Centre de recherche
sur le cancer de la Fondation européenne Ramazzini,
dans lequel l’exposition à des agents chimiques du
monomère d’acétate de vinyle, l’alcool éthylique et
de l’aspartame a été lancée en prénatal et a conti-
nué jusqu’à l’âge adulte. Les résultats de ces études
fournissent des preuves à l’appui que si l’exposition
à des agents cancérigènes commence pendant le dé-
veloppement prénatal, on observe une augmentation
globale des effets cancérogènes. En outre, lorsque l’on
compare l’exposition prénatale et postnatale, les don-
nées démontrent que le développement des cancers
peut apparaître plus tôt dans la vie si l’exposition est
plus précoce. L’âge d’exposition aux agents cancéri-
gènes est donc désormais un facteur supplémentaire
dans le processus de cancérogénèse à prendre en
considération. Les organes concernés par un risque
accru de cancérisation sont la vessie et le cerveau.
L’âge d’exposition aux agents cancérigènes
est donc désormais un facteur
supplémentaire dans le processus de
cancérogénèse à prendre en considération.
12 Les Dossiers de l’Obstétrique ⁛ N° 422 ⁛ JANVIER 2013

Nutrition
Une autre alternative, dans une vision à plus long
terme, serait d’accentuer les consultations d’ajustement
nutritionnel et/ou les consultations qui s’apparente-
raient à un trouble de type addictif. Pour diminuer
la consommation de saveur sucrée, donnée par l’as-
partame ou une autre substance, il convient de revoir
tout l’équilibre nutritionnel en équilibrant la glycémie,
en évitant les à-coups qui favorisent les appels au
sucre, en prenant en compte la dimension “apaisante”
émotionnellement de la prise de saveur sucrée… La
grossesse est un moment clé où les modifications de
l’hygiène de vie, dont l’alimentation, sont facilitées.
Nous avons en France un système de santé perfor-
mant, un suivi, pendant la grossesse, fiable et porté
sur la prévention autant que sur le dépistage. Outre
les consultations prénatales, pourquoi ne pas utiliser
la consultation préconceptionnelle pour réajuster
l’alimentation des futures parturientes ?
CONCLUSION
Trop d’inconnues subsistent quant à l’innocuité de
l’aspartame pour pouvoir en conseiller la consomma-
tion à nos patientes pendant la grossesse. Entendons
la dépendance au sucre au même titre qu’une autre
dépendance et envisageons-la en prenant en consi-
dération la femme enceinte dans sa globalité pour
que nos conseils ne soient pas vains. ●
Dans un communiqué publié en juin 2012,
l’ANSES précise qu’aucun intérêt nutritionnel, propre
à la consommation d’édulcorants intenses pendant
la période de grossesse, n’a été démontré.
QUELLES ALTERNATIVES PEUT-ON PROPOSER
POUR LES PATIENTES DIABÉTIQUES ?
La consommation de sucre a explosé depuis sa dé-
couverte et sa démocratisation. Aujourd’hui la consom-
mation évaluée pour les occidentaux est comprise
entre 50 et 70 kg/an soit entre 136 et 190 g/jour !
L’aspartame offre aux diabétiques la possibilité
d’apprécier la saveur sucrée de nombreux produits.
Cependant, il entretient l’appétence au goût sucré,
certainement également l’addiction au goût sucré.
Bien sûr, nous pourrions remplacer l’aspartame
par un autre édulcorant, par exemple la stévia qui
vient d’être autorisée. Mais nous ne réglerions pas le
problème de la dépendance au goût sucré. De plus,
nous manquons encore d’études suffisamment fiables
concernant la consommation pendant la grossesse.
Nous n’avons pas de recul, non plus, sur l’utilisa-
tion industrielle d’un composé isolé de la stévia, le
rébaudioside A, alors que la plante était utilisée de
manière traditionnelle par les Indiens du Paraguay
sous forme de tisane.
1. M
ulton
J-L. Additifs et auxiliaires
de fabrication dans les industries
agroalimentaires. Sciences et
Techniques alimentaires. Tec § Doc,
Lavoisier. 1992, p 45-54-59-61-73-
316-318-330.
2. EndrEs W. Inherited metabolic di-
seases affecting the carrier. J Inherit
Metab Dis. 1997 Mar ; 20 (1) : 9-20.
Review. Source Université Hôpital
des Enfants, Innsbruck, Autriche.
3. Halldorsson T.I. et al., Intake of
artificially sweetened soft drinks
and risk of preterm delivery : a
prospective cohort study in 59334
Danish pregnant women. Am. J. Clin.
Nutr. 2010, 92 : 626-633.
4. Englund-ÖggE L, BrantsætEr AL,
Haugen M, sEngpiEl V, KHatiBi a,
M
yHrE
r, M
yKing
s, M
EltzEr
HM,
K
acEroVsKy
M, n
ilsEn
rM, J
acoBsson
B. Association between intake of
artificially sweetened and sugar-
sweetened beverages and preterm
delivery : a large prospective cohort
study. Am J Clin Nutr. 2012 Sep ; 96
(3) : 552-9. Epub 2012 Aug 1.
5. couloMBE ra Jr, sHarMa R P.
Neurobiochemical alterations induced
by the artificial sweetener aspartame
(NutraSweet). Toxicol Appl Pharmacol.
1986 Mar 30 ; 83 (1) : 79-85.
6. MaHEr tJ, WurtMan RJ. Possible
neurologic effects of aspartame, a
widely used food additive. Environ
Health Perspect. 1987 Nov ; 75 :
53-7. Review.
7. t
saKiris
s, g
iannoulia
-K
arantana
a,
siMintzi i, scHulpis KH. The effect of
aspartame metabolites on human
erythrocyte membrane acetylcho-
linesterase activity. Pharmacol Res.
2006 Jan ; 53 (1) : 1-5. Epub 2005
Aug 29. Source Département de
physiologie expérimentale, Faculté
de Médecine, Université d’Athènes,
Grèce.
8. HuMpHriEs p, E prEtorius, naudé H.
Direct and indirect cellular effects
of aspartame on the brain. Eur J
Clin Nutr. Avr. 2008, 62 (4) : 451-
62. Epub août 2007. Département
d’Anatomie, Université de Pretoria,
Pretoria, Gauteng, Afrique du Sud.
9. Walton rg, HudaK r, grEEn-WaitE RJ.
Adverse reactions to aspartame :
double-blind challenge in patients
from a vulnerable population. Biol
Psychiatry 1993 ; 34 (1-2) : 13-7.
10. s
offritti
M, B
Elpoggi
f, E
sposti
dd,
falcioni l, Bua L. Consequences of
exposure to carcinogens beginning
during developmental life. Basic Clin
Pharmacol Toxicol. 2008 Feb ; 102
(2) : 118-24. Review.
11. WHitEHousE cr, Boullata J, MccaulEy
LA. The potential toxicity of artificial
sweeteners. AAOHN J. 2008 Jun ; 56
(6) : 251-9 ; quiz 260-1. Review.
12. c
ollison
Ks, M
aKHoul
nJ, z
aidi
Mz,
a
l
-r
aBiaH
r, i
nglis
a, a
ndrEs
B, u
BungEn
r, sHouKri M, al-MoHanna fA. Effects
of neonatal exposure to monosodium
glutamate and aspartame on glucose
homeostasis. Nutr Metab (Lond).
2012 Jun 14 ; 9 (1) : 58.
13. l
Ean
M
icHaEl
E J, professor. Aspartame
and its effects on health ; The swee-
tener has been demonised unfairly
in sections of the press and several
websites. BMJ. 2004 October 2 ;
329 (7469) : 755 – 756. Catherine
R Hankey, lecturer, University
Department of Human Nutrition.
14. a
nton
sd, M
artin
cK, H
an
H, c
oulon
s, cEfalu Wt, gEisElMan p, WilliaMson
DA. Effects of stevia, aspartame, and
sucrose on food intake, satiety, and
postprandial glucose and insulin le-
vels. Appetite. 2010 Aug ; 55 (1) : 37-
43. Epub 2010 Mar 18. Pennington
Biomedical Research Center, Baton
Rouge, LA, United States.
15. soffritti M., BElpoggi f, MansErVigi M,
tiBaldi E, lauriola M, falcioni l, Bua
l. Aspartame administered in feed,
beginning prenatally through life
span, induces cancers of the liver
and lung in male Swiss mice, Am.
J. Ind. Med. 2010, 53, 1197-1206.
16. soffriti M, BElpoggi f, dEgli Esposti d,
laMBErtini l, tiBaldi E, rigano a. First
experimental demonstration of the
multipotential carcinogenic effects of
aspartame administered in the feed to
Sprague-Dawley rats. Environ Health
Perspect. 2006 ; 114 : 379 – 385.
17. soffritti M, BElpoggi f, tiBaldi E, dEgli
Esposti d, lauriola M. Life-span expo-
sure to low doses of aspartame be-
ginning during prenatal life increases
cancer effects in rats. Environ Health
Perspect. 2007 ; 115 : 1293 – 1297.
18. JacoB sE, stEcHscHultE S.
Formaldehyde, aspartame, and
migraines : a possible connection.
rmatitis. 2008 May-Jun ; 19 (3) :
E10-1. Department of Dermatology
and Cutaneous Surgery, University
of Miami, Miami, FL, USA.
BIBLIOGRAPHIE
JANVIER 2013 ⁛ N° 422 ⁛ Les Dossiers de l’Obstétrique 13
1
/
5
100%