L Dysautonomie du diabète : détection et prise en charge M

La Lettre du Neurologue - n° 3 - vol. IV - juin 2000 143
MISE AU POINT
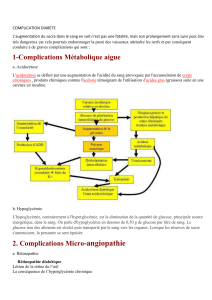
a dysautonomie est une complication chronique et
grave du diabète, qui affecte les diabétiques insuli-
nodépendants et non insulinodépendants. Sa fré-
quence est certainement sous-estimée, dans la mesure où elle est
rarement symptomatique. Elle peut être révélée à un stade infra-
clinique par des techniques appropriées. Elle peut toucher les
systèmes sympathique et parasympathique, des preuves histopa-
thologiques d’atteinte des deux systèmes ayant été obtenues.
La physiopathologie de la dysautonomie diabétique est com-
plexe, rendant compte d’un traitement également complexe.
PHYSIOPATHOLOGIE
Cette complexité résulte de différents facteurs, en particulier du
fait de l’atteinte de différents appareils, qui peuvent être tou-
chés de façon inégale et variable dans le temps, et d’une histoire
naturelle encore insuffisamment connue. C’est la neuropathie
autonome cardiaque (NAC), une des conséquences les plus
mesurables de la dysautonomie, qui a permis les recherches
physiopathologiques les plus fructueuses.
L’influence de l’équilibre métabolique est suggérée par la mise
en évidence précoce de la NAC, par des données transversales
(1,2) et par l’effet favorable de l’équilibre optimisé du diabète
de type 1 (insulinodépendant) (3). Les facteurs métaboliques
impliquent une série de conséquences de l’hyperglycémie
chronique : augmentation d’activité de la voie de l’aldose réduc-
tase, conduisant à une accumulation de sorbitol, une déplétion
en myo-inositol, une réduction d’activité de la Na+/K+ ATPase
dans le nerf, une accumulation des produits finaux de glycation
(AGE : Advanced Glycated Endproducts), une activation des
processus d’oxydation.
Le rôle de facteurs immunologiques peut être soupçonné
devant l’infiltration des ganglions autonomes par des lympho-
cytes et des plasmocytes (4) et la mise en évidence d’anticorps
antimédullo-surrénales et antiganglions sympathiques, chez les
diabétiques ayant une dépression de la réponse catécholergique
à l’orthostatisme (5).
L’implication de facteurs microcirculatoires, à l’instar de ceux
vraisemblablement en cause dans la neuropathie périphérique,
est possible.
Enfin, des facteurs nutritionnels révélés dans le diabète expéri-
mental, mais également suggérés dans le diabète humain, pour-
raient être impliqués. L’influence de la malnutrition a ainsi été
Dysautonomie du diabète : détection et prise en charge
● P. V alensi*
* Service d’endocrinologie-diabétologie-nutrition,
CHU Jean-Verdier - Université Paris-Nord, Bondy.
L
■La dysautonomie est une complication potentiellement
grave du diabète.
■D’expression très polymorphe, la dysautonomie diabé-
tique peut toucher le système cardiovasculaire, le tractus
digestif, l’appareil urogénital, la motricité pupillaire et
le système sudoral.
■Dans chacune de ces localisations, la dysautonomie
peut être mise en évidence au stade infraclinique par des
examens complémentaires non invasifs.
■La neuropathie autonome cardiaque (NAC) constitue
l’atteinte dysautonomique la plus fréquente et la plus
précoce du diabète.
■La NAC peut être recherchée de façon simple par l’étude
des variations de fréquence cardiaque au cours d’épreuves
standardisées, en tenant compte de l’influence de l’âge.
■La NAC expose à différents risques, en particulier aux
conséquences de l’hypotension orthostatique, de l’ischémie
myocardique silencieuse, des anomalies de la repolarisa-
tion ventriculaire et des variations nycthémérales de la
pression artérielle.
■Le traitement des manifestations dysautonomiques
s’appuie encore sur les traitements symptomatiques. Mais
l’amélioration de l’équilibre glycémique, qui se révèle
effective au moins partiellement, reste fondamentale
en l’attente des traitements spécifiques de la neuropathie
diabétique.
POINTS FORTS
POINTS FORTS

MISE AU POINT
La Lettre du Neurologue - n° 3 - vol. IV - juin 2000
144
suggérée. L’obésité, très fréquente chez les diabétiques de type 2
(non insulinodépendant), peut aussi s’associer à un dysfonc-
tionnement autonome cardiovasculaire et peut rendre compte,
dans une certaine mesure, des altérations des épreuves auto-
nomes cardiaques chez les diabétiques (6).
EXPRESSION CLINIQUE
DE LA DYSAUTONOMIE DIABÉTIQUE
L’expression clinique peut être patente, avec des symptômes
parfois invalidants. Elle est beaucoup plus souvent latente,
mise en évidence par des examens de complexité et de sensibi-
lité variables. Dans les formes patentes, le diagnostic est délicat
en raison du caractère non spécifique des symptômes et de
l’atteinte souvent dissociée des différents organes. Enfin,
la dysautonomie n’est pas spécifique du diabète, et d’autres
étiologies, comme l’éthylisme chronique et l’insuffisance rénale,
peuvent être en cause.
La neuropathie autonome cardiovasculaire
La NAC, au stade infraclinique, est une complication très
fréquente, retrouvée chez 20 à 70 % des diabétiques selon les
séries. Elle survient précocement, touchant près de 10 % des
patients atteints d’un diabète de type 1 récent et environ 6 % des
patients atteints d’un diabète de type 2 récemment diagnostiqué.
•Valeur pronostique
La NAC, au stade infraclinique, s’associe à une augmentation
de la mortalité, en particulier d’origine cardiovasculaire, révé-
lée par plusieurs séries prospectives (7). Ainsi, le taux de mor-
talité est multiplié par un facteur 5. Un allongement du seg-
ment QT et la survenue d’arythmies ventriculaires pourraient
être le mécanisme de certaines morts subites.
Les corrélations significatives entre NAC, rétinopathie et sévérité
de la néphropathie diabétique (2,7) sont bien cohérentes avec la
notion que la NAC pourrait être un marqueur précoce de
microangiopathie diabétique.
•Les manifestations patentes
L’hypotension orthostatique en est la plus classique, parfois
invalidante. Elle est définie par la baisse de la pression artérielle
systolique d’au moins 30 mmHg et/ou de la pression diastolique
d’au moins 20 mmHg après une minute d’orthostatisme. L’hy-
potension orthostatique, strictement d’origine autonomique, est
en relation avec une atteinte sympathique, ainsi qu’en témoigne
une baisse des taux plasmatiques de noradrénaline. Au contraire,
la variété hyperadrénergique de l’hypotension orthostatique est
associée à une hypovolémie ou à une anémie, et non à une
NAC. Enfin, l’hypotension orthostatique ne peut être rattachée
à la dysautonomie qu’après avoir écarté des facteurs iatro-
gènes, comme des diurétiques, des vasodilatateurs, des dérivés
nitrés, des antidépresseurs tricycliques ou des phénothiazines,
ou encore, dans quelques cas, le rôle propre de l’insuline (qui
intervient par une vasodilatation périphérique et par une
augmentation de la perméabilité capillaire responsable d’une
hypovolémie).
Quelques études autopsiques ont fortement suggéré que
l’infarctus du myocarde silencieux pouvait être relié, dans
quelques cas, à des lésions des fibres nerveuses autonomes
issues du myocarde. Toutefois, le lien entre NAC et caractère
silencieux de la cardiopathie ischémique avant infarctus n’est
pas établi de façon formelle.
La tachycardie permanente est une autre manifestation clas-
sique de la NAC, encore que son authenticité soit discutable
à la lumière des enregistrements Holter ECG sur 24 heures.
Des œdèmes des membres inférieurs peuvent également résulter
de la dysautonomie, du fait de la levée du tonus sympathique
vasoconstricteur périphérique.
Lorsqu’une de ces manifestations patentes est présente, il existe
en règle des signes cliniques de neuropathie périphérique.
•La NAC au stade infraclinique
a - Épreuves standardisées
Différentes méthodes ont été proposées pour mettre en évidence
la NAC au stade infraclinique. Les plus fréquemment utilisées,
en raison de leur faisabilité et de leur reproductibilité (8),sont
les épreuves proposées par Ewing et al. (9). Ces auteurs ont
développé une batterie de cinq épreuves standardisées, réali-
sables au lit du malade ou en ambulatoire, dans les conditions
d’un repos d’au moins trente minutes et à distance d’un effort
physique récent.
Trois de ces épreuves explorent les variations de la fréquence
cardiaque, essentiellement sous contrôle parasympathique.
À l’aide d’un cardiographe simple ou, mieux, en recourant à
des systèmes informatisés, il est possible de mesurer précisé-
ment les espaces RR et d’examiner les variations de
fréquence cardiaque au cours d’épreuves de respiration
profonde, d’orthostatisme actif et de Valsalva (10).
L’épreuve de respiration profonde doit être effectuée en
demandant au patient de s’adapter préalablement à ce type de
respiration. Le sujet doit réaliser en décubitus six cycles respi-
ratoires profonds en une minute. La fréquence cardiaque (FC)
maximale est atteinte en inspiration (I) et la FC minimale
en expiration (E). Le résultat est exprimé par le rapport I/E.
L’épreuve d’orthostatisme actif induit d’abord une accélération
de la FC dans les premières secondes suivant le passage à la
position debout, pour atteindre un maximum vers la 15eseconde,
qui laisse place secondairement à un ralentissement, maximal
vers la 30eseconde. Le résultat est exprimé par le rapport de la
FC maximale à la FC minimale.
L’épreuve de Valsalva,réalisée en position assise, consiste à
expirer dans un embout buccal relié à un manomètre à mercure
et à maintenir une pression de 40 mmHg pendant 15 secondes.
Au cours de la phase active se produit une accélération
cardiaque. Lorsque le Valsalva est relâché, la FC ralentit.
Le rapport de Valsalva est égal au rapport FC maximale/FC
minimale. Il est préférable de répéter le test trois fois et d’éta-
blir la moyenne des trois résultats. Il faut rappeler que cette
épreuve ne doit pas être réalisée chez les patients ayant une
rétinopathie diabétique sévère, car il existe un risque potentiel
d’induire une hémorragie rétinienne.

La Lettre du Neurologue - n° 3 - vol. IV - juin 2000 145
L’interprétation des résultats de ces trois épreuves doit se faire
en fonction de l’âge, dans la mesure où, physiologiquement,
les variations de la fréquence cardiaque décroissent de façon
notable avec l’âge (11).
Les deux autres épreuves explorent la réponse tensionnelle,
essentiellement sous contrôle sympathique. Leur sensibilité
dans le dépistage d’une atteinte sympathique est faible, et leur
reproductibilité est limitée. Il s’agit de la recherche d’une
hypotension orthostatique et de l’étude de la réponse tension-
nelle à une contraction isométrique de la main (Handgrip).
Celle-ci consiste, à l’aide d’un dynamomètre à main, à détermi-
ner la contraction maximale, puis à maintenir un tiers de cette
contraction pendant 5 minutes. Une augmentation de la pres-
sion artérielle diastolique inférieure à 10 mmHg est en faveur
d’une atteinte sympathique.
Les épreuves le plus souvent perturbées sont les épreuves de
respiration profonde et d’orthostatisme, tandis que l’épreuve de
Valsalva l’est exceptionnellement de façon isolée. Quant aux
deux épreuves sous contrôle essentiellement sympathique, elles
sont, en général, perturbées uniquement s’il existe des altéra-
tions parasympathiques.
b - Méthodes modernes
Les variations spontanées de fréquence cardiaque peuvent être
étudiées sur des enregistrements ECG de quelques minutes ou
de 24 heures. Les variations de fréquence cardiaque et de pres-
sion artérielle peuvent aussi être étudiées sur un enregistrement
continu par pléthysmographie digitale, puis décomposition par
analyse spectrale (Finapres) (12). Cette analyse révèle deux
pics intéressants : une composante de basse fréquence (autour
de 0,10 Hz, ou ondes de Mayer), associée au baroréflexe, et
une composante de haute fréquence (autour de 0,25 Hz), liée à
l’activité respiratoire. Pour les variations de fréquence
cardiaque, la composante de haute fréquence dépend de la
respiration et reflète l’activité parasympathique, la composante
de basse fréquence est sous dépendance mixte, surtout sympa-
thique mais aussi parasympathique. Pour les variations de pres-
sion artérielle systolique, le pic de basse fréquence (autour
de 0,10 Hz) dépend quasi exclusivement de l’activité sympa-
thique, lorsque l’enregistrement est effectué en orthostatisme.
Cette méthode séduisante offre une meilleure spécificité que
les épreuves standardisées, et une neuropathie sympathique
peut être dépistée avec une plus grande sensibilité qu’avec ces
dernières. Mais elle impose un matériel encore onéreux, et les
résultats doivent toujours être interprétés en fonction de l’âge.
L’atteinte sympathique peut aussi être révélée au niveau vascu-
laire périphérique, en étudiant la vasomotricité par pléthysmo-
graphie ou par un système de laser-doppler, au cours
d’épreuves activant le sympathique (13).
Certaines méthodes permettent de mesurer directement l’activité
nerveuse sympathique. Citons la scintigraphie myocardique à
la MIBG, qui se développe dans certains centres, et la mesure
de l’activité nerveuse musculaire périphérique.
•En pratique
La NAC devrait être recherchée chez le plus grand nombre de
diabétiques, en pratiquant au minimum deux épreuves standar-
disées qui évaluent les variations de fréquence cardiaque
(épreuves respiratoire et d’orthostatisme). Sa recherche est éga-
lement justifiée pour rattacher à la dysautonomie des manifes-
tations cliniques isolées (cardiovasculaires patentes, digestives
ou urogénitales) ou des hypoglycémies sans symptômes
adrénergiques. La NAC au stade infraclinique doit aussi être
recherchée s’il existe une neuropathie périphérique clinique.
Mais il faut signaler qu’elle est souvent retrouvée en l’absence
de signes cliniques de neuropathie périphérique.
La mise en évidence d’une NAC doit conduire à un bilan
et une prise en charge complémentaires (14) :
•recherche d’une hypotension orthostatique ;
•recherche d’une ischémie myocardique silencieuse au mini-
mum par ECG standard et, mieux, par une épreuve d’effort chez
les patients ayant d’autres facteurs de risque cardiovasculaire ;
•recherche d’un allongement du segment QT sur l’ECG
standard et d’un trouble du rythme ventriculaire paroxystique
par l’ECG de 24 heures, si le segment QT est allongé ;
•enregistrement ambulatoire de la pression artérielle, qui peut
révéler une modification du profil nycthéméral physiologique,
avec perte de la chute nocturne, voire élévation paradoxale
nocturne de la pression artérielle ;
•arrêt ou remplacement des médicaments susceptibles de favo-
riser une hypotension orthostatique ;
•vigilance particulière vis-à-vis de l’anesthésie générale (car
des accidents ont été décrits à l’induction anesthésique chez
des patients atteints de NAC) ;
•enfin, une NAC devrait rendre plus particulièrement attentif
au dépistage des autres complications du diabète, en particulier
micro-angiopathiques.
•Traitement
L’amélioration de l’équilibre glycémique se révèle capable de
stabiliser, et même d’améliorer, les épreuves autonomes
cardiaques. Les autres thérapeutiques fondées sur une approche
physiopathologique, en particulier les inhibiteurs de l’aldose
réductase, n’ont pas encore fait la preuve de leur efficacité chez
les diabétiques, même si certaines d’entre elles sont très effi-
caces dans le diabète expérimental.
Le traitement de l’hypotension orthostatique repose d’abord
sur l’éviction des facteurs iatrogènes potentiels : suppression
d’un régime désodé ou des drogues mentionnées plus haut. Les
méthodes physiques destinées à améliorer le retour sanguin au
cœur, notamment les bandes de contention, s’asseoir au bord
du lit au lieu de se lever brutalement, la natation, peuvent être
préconisées. La dihydroergotamine, un antagoniste alpha-2
adrénergique, peut être essayé. Le traitement médicamenteux
le plus efficace repose sur les minéralo-corticoïdes : fludrocorti-
sone à la dose de 100 à 300 µg/jour, avec un régime normosalé.
Mentionnons aussi que la midodrine, un agoniste alpha-1

MISE AU POINT
La Lettre du Neurologue - n° 3 - vol. IV - juin 2000
146
adrénergique, ou le pindolol, un bêtabloquant doté d’une action
sympathomimétique intrinsèque, ou encore l’octréotide, un
analogue de la somatostatine, des inhibiteurs de la synthèse des
prostaglandines (comme l’indométacine ou l’ibuprofène),
ou encore des antagonistes dopaminergiques, comme le méto-
clopramide, ont pu être utilisés avec succès dans quelques cas.
La dysautonomie digestive
Tous les segments du tractus digestif peuvent être touchés.
Les signes cliniques sont en général tardifs.
•L’atteinte du tractus digestif supérieur
Les symptômes digestifs reflètent une atteinte œsophagienne
(dysphagie, brûlures rétrosternales, signe de reflux gastro-
œsophagien) et/ou gastrique (anorexie, nausées, vomissements,
douleurs abdominales, ballonnements, sensation de satiété pré-
coce ou de lenteur à la digestion). Exceptionnellement apparaît
une gastroplégie avec intolérance digestive totale.
La dysautonomie digestive peut également induire un déséqui-
libre glycémique. En effet, une gastroparésie, du fait du retard
d’absorption du bol alimentaire, peut provoquer typiquement
des hypoglycémies postprandiales immédiates et des hypergly-
cémies à distance des repas et un retard à la correction par voie
orale d’une hypoglycémie pouvant être responsable d’un coma
hypoglycémique.
L’examen clinique retrouve parfois la distension abdominale,
avec le classique clapotage à jeun. Surtout, il recherche des
signes pouvant rendre compte de la symptomatologie fonction-
nelle et appelant des explorations spécialisées (hépatomégalie,
masse abdominale...).
Du fait du manque de spécificité de ces manifestations, une
fibroscopie œsophago-gastrique est souhaitable, afin d’éliminer
un obstacle mécanique, une œsophagite, un ulcère gastrique
ou une mycose. Si l’endoscopie se révèle négative, la vidange
gastrique doit être explorée. La scintigraphie gastrique double
phase, liquide et solide, constitue la méthode de référence pour
l’étude de la vidange gastrique, en utilisant des marqueurs
radioactifs incorporés dans des repas tests. Habituellement, un
retard d’évacuation des solides et/ou une vidange des liquides
ralentie ou accélérée sont mis en évidence. Selon
la scintigraphie, la gastroparésie toucherait 30 à 60 % des dia-
bétiques, dont la moitié ne se plaignent d’aucun symptôme
digestif.
Le traitement de la gastroparésie repose sur l’amélioration du
contrôle glycémique, mais aussi sur l’utilisation de molécules
qui accélèrent la vidange gastrique. Le cisapride, la dompérido-
ne ou le métoclopramide sont souvent utilisés avec succès.
L’érythromycine, par son effet agoniste de la motiline, est un
puissant accélérateur de la vidange gastrique.
Une hospitalisation est nécessaire en cas de gastroplégie,
permettant la mise au repos du tractus digestif, l’alimentation
par voie parentérale et l’utilisation de l’érythromycine par voie
veineuse.
L’existence d’une gastroparésie justifie la pratique plus étroite
de l’autosurveillance glycémique par les patients, des essais de
modification des horaires d’injection d’insuline, souvent la
mise en route d’une insulinothérapie intensive par la pompe à
insuline, enfin la réduction de la consommation de fibres
alimentaires.
•L’atteinte du tractus digestif inférieur
Cette atteinte peut donner lieu à une diarrhée ou une constipa-
tion. Typiquement, la diarrhée est impérieuse, nocturne
et explosive. L’atteinte du sphincter anal est responsable
d’incontinence.
Sur le plan diagnostique, rappelons que la diarrhée chez les
diabétiques peut avoir des origines diverses : traitement par
biguanides ou inhibiteurs de l’alphaglucosidase, hyperthyroïdie,
maladie cœliaque, insuffisance pancréatique exocrine, enfin
une cause infectieuse. Il n’est donc possible de rapporter ces
symptômes digestifs à la dysautonomie qu’après avoir écarté
ces différentes étiologies et, en cas de persistance, après avoir
réalisé une exploration endoscopique. La mise en évidence
d’une NAC apporterait un argument supplémentaire en faveur
d’une dysautonomie digestive.
Une diarrhée chronique doit faire soupçonner une cause infec-
tieuse, même si la coproculture est négative, et doit faire réaliser
un test thérapeutique aux tétracyclines pendant deux à quatre
semaines. Les traitement antidiarrhéiques habituels peuvent
être utilisés à la demande : lopéramide, diphénoxylate, choles-
tyramine, diphénylhydantoïne ou clonidine. Enfin, l’améliora-
tion de l’équilibre glycémique s’accompagne souvent d’une
régression de la diarrhée.
La neuropathie vésicale
Environ 50 % des diabétiques souffriraient de troubles du
contrôle vésico-sphinctérien, en relation, le plus souvent, avec
une atteinte mixte touchant le système nerveux somatique (voies
sensitives principalement) et le système nerveux végétatif, aussi
bien sympathique que parasympathique.
Certains signes d’appel aident à typer le comportement vésico-
sphinctérien :
•vessie hypoactive, hypocontractile, hypoesthésique, se carac-
térisant par un trouble de la perception du besoin d’uriner qui
est réduite et retardée, une diminution de la perception du
passage urétral des urines, une dysurie avec nécessité de pous-
sées abdominales pour vider totalement la vessie, parfois une
rétention chronique avec perception d’un résidu postmictionnel
par le patient ;
•vessie hyperactive, caractérisée par un besoin beaucoup trop
précoce, impérieux, aboutissant parfois à des mictions impé-
rieuses, avec fuites.
L’examen clinique neuro-périnéal peut retrouver certaines ano-
malies non corrélées aux désordres urinaires et non spécifiques.
Les examens complémentaires sont essentiels pour confirmer
et caractériser les troubles vésicaux. Ils sont dominés par les

La Lettre du Neurologue - n° 3 - vol. IV - juin 2000 147
explorations urodynamiques : débitmétrie, cystomanométrie
(examen de référence), sphinctérométrie, voire des tests phar-
macologiques utilisant des parasympathomimétiques directs
ou des anticholinergiques (15). Les explorations neurologiques
périnéales peuvent aussi contribuer au diagnostic.
L’échographie vésicorénale permet de dépister un résidu post-
mictionnel et de juger de l’état de la vessie et du haut appareil.
L’urographie intraveineuse, l’uréthrocystoscopie et l’uréthro-
cystographie rétrograde avec clichés permictionnels sont discutés
selon le cas par l’urologue, s’il existe un syndrome obstructif.
Il faut insister sur le fait que les troubles vésicaux sphinctériens
chez les diabétiques peuvent résulter de différents facteurs
associés. Aussi, un bilan urologique est toujours utile en cas de
dysurie avec rétention chez l’homme, ainsi qu’une exploration
urodynamique, si le bilan urologique est négatif ou s’il existe
une suspicion de vessie hyperactive, et enfin un bilan
gynécologique.
Sur le plan thérapeutique, une vessie hypoactive peut bénéficier
d’un traitement par un parasympathicomimétique direct (uré-
choline) ou indirect par un inhibiteur de la cholinestérase,
ou par un alphabloquant. Une vessie hyperactive peut être
traitée par l’oxybutynine, un parasympathicolytique anticholi-
nergique et éventuellement un inhibiteur calcique ou un anti-
spasmodique. Enfin, une rétention chronique d’urine impose
des autosondages permettant de supprimer le résidu et de limiter
le risque d’infection.
Enfin, rappelons que la surveillance par la glycosurie ne revêt
plus aucune valeur en présence d’une neurovessie.
La neuropathie génitale
Environ 50 % des hommes et 30 % des femmes diabétiques
présenteraient des troubles génitaux. L’origine neurologique est
parfois impliquée et repose sur l’atteinte du système nerveux
autonome et des nerfs somatiques.
Chez l’homme, il peut s’agir d’une éjaculation rétrograde –
pouvant être perçue par le patient ou décelée par la présence de
spermatozoïdes à l’examen des premières urines émises après
un rapport sexuel et pouvant être source d’infécondité – mais
aussi et surtout de troubles de l’érection. L’impuissance, chez
le diabétique, peut relever de différentes causes :
–facteurs psychogènes, très souvent présents mais rare-
ment isolés ;
–origine endocrinienne : hypogonadisme ou hyperprolactiné-
mie, de façon exceptionnelle ;
–origine artérielle ;
–fuite veineuse ;
–alcoolisme chronique ;
–facteurs iatrogènes ;
–déséquilibre glycémique pouvant induire une impuissance
“fonctionnelle”, réversible avec le retour à un équilibre
glycémique correct ;
–enfin, une origine neuropathique, dysautonomique ou
somatique.
Aussi, le bilan d’une impuissance ne doit être entrepris que si
celle-ci est véritable depuis au moins trois mois, si le patient
est demandeur et motivé, et si l’équilibre du diabète est satis-
faisant, avec un taux d’HbA1c ne dépassant pas 8 % ; enfin,
après avoir écarté un facteur iatrogène ou alcoolique.
Chez la femme, la dysautonomie peut induire une baisse des
sécrétions vaginales et une anorgasmie.
L’examen clinique peut trouver des signes d’orientation en
faveur d’une endocrinopathie, d’une artériopathie. Une origine
dysautonomique peut être soupçonnée, lorsque les troubles de
l’érection s’associent à une neurovessie de type vessie hypoactive,
ou devant une NAC. Une neuropathie somatique peut être envi-
sagée devant une hypotonie musculaire périnéale.
Après avoir écarté une origine hormonale, iatrogène, toxique
(alcool) ou dysmétabolique (grand déséquilibre glycémique),
un traitement oral peut être entrepris en première intention,
recourant à un alphabloquant, comme l’alfuzosine ou la nicer-
goline. En cas d’échec, une prise en charge spécialisée est
souhaitable (14) :
–soit multidisciplinaire, incluant le concours de diabéto-
logues, de psychologues et d’un laboratoire d’explorations
fonctionnelles neurovasculaires ; on pourra effectuer un enre-
gistrement pléthysmographique pénien nocturne ou diurne,
un bilan neurologique recherchant d’autres signes de dysauto-
nomie ainsi qu’une neuropathie génitale somatique par des
explorations neurophysiologiques périnéales en particulier
(14,15) et un bilan artériel ;
–soit d’emblée un test thérapeutique consistant en l’injection
intracaverneuse de prostaglandines PGE1 ou de moxisylyte.
Toutefois, ce test ne permet pas de rapporter formellement les
troubles à une étiologie précise mais permet, en revanche,
de proposer au long cours un traitement par auto-injections.
Ce traitement ne peut être proposé que par une unité présentant
une structure d’accueil et offrant les moyens d’un soutien
psychothérapique et d’une décompression en urgence des corps
caverneux en cas de priapisme. Compte tenu de ce risque,
la posologie doit être augmentée progressivement et prudemment.
Les “pompes à vide”, qui provoquent un afflux sanguin et une
érection, représentent une alternative sans risque aux auto-
injections intracaverneuses. La prothèse pénienne est d’indica-
tion très limitée chez les diabétiques.
Enfin, le recours au sildénafil pour les diabétiques est possible
en dehors de l’angor instable. Chez les diabétiques coronariens
stables, l’usage du sildénafil est autorisé, si tout traitement par
dérivés nitrés peut être suspendu pendant les 24 heures qui
encadrent la prise de ce produit.
Si l’impuissance est d’origine neuropathique, les agents vaso-
actifs intracaverneux sont très souvent efficaces, et la “pompe
à vide” peut être essayée, avant d’envisager la prothèse pénienne.
Toutefois, il faut bien rappeler que l’origine de l’impuissance est
très souvent multifactorielle, et qu’une prise en charge mixte
est souvent nécessaire.
 6
6
 7
7
1
/
7
100%