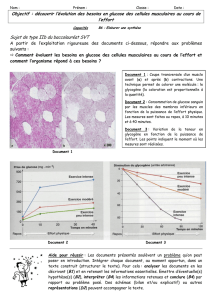
La glycémie post prandiale : du normal au pathologique

La glycémie postprandiale :
du normal au pathologique
L. Monnier*, C.Colette
48ème JAND 25 janvier 2008
* Institut Universitaire de Recherche Clinique, Avenue du doyen-Giraud, 34093 Montpellier Cedex


L. Monnier - C. Colette 3
La dysglycémie du diabétique est la résultante de plusieurs désordres glycémiques que l'on peut
schématiquement regrouper sous 2 rubriques : a) l'hyperglycémie chronique soutenue et b) les
fluctuations aiguës de la glycémie entre pics et nadirs [1]. L'hyperglycémie chronique peut être évaluée
à court et à moyen terme par 2 marqueurs qui sont respectivement la glycémie moyenne et l'HbA1c
[2]. Elle est constituée en priorité par l'hyperglycémie "basale" c'est à dire par l'élévation des glycémies
de jeûne et interprandiales au dessus d'une ligne de base égale à la limite supérieure de la normalité
à jeun, soit 5,5 mmole/L, d'après la définition donnée par les standards internationaux [3].
L'hyperglycémie chronique soutenue est également liée à l'hyperglycémie postprandiale qui, par sa
durée et son amplitude, contribue à l'exposition à l'hyperglycémie. D'une manière un peu schématique
on peut d'ailleurs considérer que l'hyperglycémie postprandiale contribue aux deux désordres
fondamentaux de la dysglycémie du diabète. Par sa composante horizontale, c'est à dire sa durée,
l'hyperglycémie postprandiale participe à l'hyperglycémie chronique, tandis que par sa composante
verticale l'amplitude elle participerait plutôt à la variabilité aiguë de la glycémie. En fait les deux
composantes sont plus ou moins indissociables. Ceci explique que la mesure de l'aire sous la courbe
des profils glycémiques au dessus d'une ligne horizontale fixée à la valeur préprandiale pour un repas
donné soit la meilleure manière de quantifier le degré de l'hyperglycémie postprandiale. Pour se
résumer, l'hyperglycémie basale et l'hyperglycémie postprandiale (figure 1) sont les 2 composantes
de l'exposition chronique et soutenue à l'hyperglycémie. Toutes deux participent aux complications
diabétiques en sachant que les variations aiguës de la glycémie entre pics et nadirs peuvent également
jour un rôle qui n'est pas marginal [4]. Dans ces conditions, il est important de pouvoir déterminer
Résumé
L'hyperglycémie postprandiale contribue à la fois à l'hyperglycémie chronique dont l'HbA1c est le
marqueur de référence et aux fluctuations aiguës de la glycémie entre pics et nadirs. La physiologie
nous apprend qu'un sujet non diabétique passe environ la moitié de sa vie en état postprandial.
Toutefois, chez le sujet normal, les montées glycémiques postprandiales restent limitées en durée
et en amplitude. Le passage de l'état normal au diabète patent se fait par étapes successives. La
première qui va de l'état normal à l'intolérance au glucose est caractérisée par une dégradation du
contrôle glycémique limitée à la phase postprandiale. La deuxième qui va de l'intolérance au glucose
au diabète patent se traduit par l'apparition de désordres glycémiques en fin de nuit (phénomène de
l'aube), par une dégradation progressive de la glycémie à jeun, et par une aggravation progressive
et supplémentaire des désordres glycémiques dans les périodes qui suivent les repas. Cette
évolution est expliquée par 3 anomalies désignées sous le terme de triumvirat biologique : a) un
déficit progressif de l'insulinosécrétion endogène; b) un état d'insulinorésistance qui évolue au cours
du temps; c) une exagération de la production hépatique du glucose qui est à son maximum en fin
de nuit et dans la matinée. Ces observations indiquent que la surveillance des désordres
glycémiques chez le diabétique de type 1 doit porter sur les 3 éléments suivants désignés sous le
terme de "triade glucose": l'HbA1c, la glycémie à jeun, les glycémies postprandiales. De manière
plus générale, l'évaluation des profils glycémiques est d'une grande utilité dans le choix et
l'adaptation des traitements qui doivent être plus ou moins ciblés sur l'hyperglycémie prandiale ou
basale selon que l'une prédomine par rapport à l'autre.
LA GLYCÉMIE POSTPRANDIALE : DU NORMAL AU PATHOLOGIQUE

L. Monnier - C. Colette 4
chez le diabétique les contributions respectives de l'hyperglycémie basale et prandiale et d'analyser
le "spectre" des désordres glycémiques postprandiaux quand on se déplace de la physiologie vers la
pathologie, c'est à dire de l'état normal vers un diabète sucré patent, en passant par l'étape
intermédiaire de l'intolérance au glucose. Le choix des thérapeutiques dépend de cette détermination
et de cette analyse.
LES LEÇONS DE LA PHYSIOLOGIE :
L'ÉTAT POSTPRANDIAL CHEZ LE NON DIABÉTIQUE
L'état postprandial, dérivé du latin "postprandium", s'étale sur une période de 4 heures après ingestion
d'un repas [5]. Pendant cette période, les glucides alimentaires (en majorité les amidons et à un degré
moindre les oligosaccharides et les disaccharides) sont progressivement hydrolysés par les enzymes
du tube digestif. Les monosaccharides (essentiellement des unités glucose) qui sont libérés par cette
hydrolyse sont ultérieurement absorbés par l'intestin pour pénétrer dans le système porte et pour
être déversés in fine dans la circulation sanguine systémique. La conséquence est une montée de la
glycémie qui peut être plus ou moins intense. L'état postabsorptif qui suit l'état postprandial
correspond à une période de 6 heures pendant laquelle, chez une personne non diabétique, la glycémie
reste dans la zone normale. Au cours de cette période, l'utilisation périphérique du glucose est
compensée par une production équivalente de glucose par le foie à partir de l'hydrolyse du glycogène
qui a été stocké dans la glande hépatique au cours de la période précédente.
L'état de jeûne réel débute seulement à la fin de l'état postabsorptif c'est à dire approximativement 10
à 12 heures après le début du dernier repas. Pendant les états de jeûne et postabsorptifs, les glycémies
restent stables et normales chez les personnes qui ne sont pas diabétiques. Cette stabilisation est
due au fait que la production hépatique de glucose passe progressivement de la glycogénolyse à la
néoglucogenèse c'est à dire à la production de glucose à partir des lactates, d'alanine ou de glycérol.
Il apparaît ainsi que chez les personnes qui ne sont pas diabétiques et qui prennent 3 repas quotidiens
à des heures relativement fixes, le nycthémère peut être divisé en 3 périodes qui correspondent aux
états de jeûne, postprandiaux et postabsorptifs [6]. Les périodes postprandiales (4 heures chacune)
couvrent donc un intervalle de temps de l'ordre de 12 heures, c'est à dire une demie journée. L'état de
jeûne est limité uniquement à une période de 3 à 4 heures en fin de nuit. Par ailleurs, compte tenu des
superpositions entre états postprandiaux et postabsorptifs, on peut considérer qu'une dizaine d'heures
sont passées en période postabsorptive .
Dans la mesure où nous passons la moitié de notre vie en période postprandiale, il semble important
de s'intéresser aux variations glycémiques au cours de cette période. Chez les personnes qui ne sont
pas diabétiques, les montées glycémiques postprandiales restent limitées dans leur intensité et leur
durée. En particulier, la montée glycémique au dessus de la ligne de base excède rarement 2 heures
alors que l'état postprandial (passage des glucides à travers la barrière intestinale) dure environ
4 heures. En effet, chez les personnes qui ne sont pas diabétiques, la montée glycémique est
parfaitement contrôlée par la stimulation de la sécrétion insulinique et par la réduction de la
glucagonémie [7]. Ces deux phénomènes sont en partie contrôlés par la sécrétion de plusieurs
hormones gastro-intestinales, les incrétines [8]. La plus représentative est le "glucagon-like-peptide
1" (GLP1). Sa sécrétion au niveau des entérocytes est initiée par la présence de nutriments tels que le
glucose, le galactose, le saccharose ou le maltose. Son mode d'action original a conduit à la production
de médicaments antidiabétiques capables d'améliorer la tolérance glucidique postprandiale. Ces
médicaments désignés sous le terme d'insulino-mimétiques appartiennent à 2 classes : les analogues
du GLP1 dont le premier représentant commercialisé est l'exenatide [9] et les gliptines qui agissent
en inhibant l'acitivité de la dipeptidyl petpidase-IV, c'est à dire de l'enzyme qui assure la dégradation
physiologique du GLP1 [10]. La stimulation de la sécrétion de l'insuline et la freination de la sécrétion
du glucagon au cours de la période postprandiale ont deux conséquences au niveau des flux de

L. Monnier - C. Colette 5
glucose: une diminution de la production hépatique de glucose et une stimulation de son utilisation
périphérique [7]. Ces modifications se poursuivent avec une intensité variable sur la totalité de la
période postprandiale, c'est à dire sur un intervalle de temps de l'ordre de 4 heures pendant lesquelles
les hydrates de carbone alimentaires sont hydrolysés puis absorbés au niveau de l'intestin. La
conséquence de ces phénomènes est une limitation de la montée glycémique postprandiale dans son
intensité et sa durée qui n'excède pas 2 heures. Chez un sujet non diabétique, la glycémie postprandiale
est considérée comme normale lorsqu'elle reste inférieure à 140 mg/dL (7,8mmole/L) à la 2ème heure
d'une charge en glucose (75 grammes) [3].
LES LEÇONS DE LA PATHOLOGIE : MONTÉES GLYCÉMIQUES POSTPRANDIALES
DANS L'INTOLÉRANCE AU GLUCOSE
De la normalité à l'intolérance au glucose
L'intolérance au glucose est un état caractérisé par le maintien d'une glycémie à jeun inférieure à
126mg/dL (7 mmole/L) mais par une montée anormale de la glycémie en période postprandiale. Cet
état est mis en évidence par la pratique d'une hyperglycémie provoquée orale (75 grammes de glucose
per os) et par l'observation d'une glycémie à la deuxième heure de l'épreuve comprise entre 140 et 199
mg/dL [3]. L'exploration métabolique plus poussée des états d'intolérance au glucose a montré qu'ils
s'accompagnent, au moins chez l'obèse, d'une diminution de la sensibilité à l'insuline (figure 2) et
d'un hyperinsulinisme réactionnel (figure 3) [11]. Alors que l'exagération de la sécrétion insulinique
est suffisante chez l'obèse normotolérant au glucose (figure 3) [11] pour compenser
l'insulinorésistance, elle devient insuffisante chez l'obèse intolérant au glucose (figure 3). La
conséquence est une dérive anormale des glycémies postprandiales. Dans ces conditions on peut
considérer que l'obésité commune, avec normotolérance glucidique, est un état intermédiaire entre
la normalité et l'obésité avec intolérance au glucose. Ce dernier état peut être considéré comme un
véritable prédiabète dans la mesure où plusieurs études [12,13] ont montré que chez l'adulte le taux
de conversion annuel de l'intolérance au glucose en diabète patent est de l'ordre de 10%.
De l'intolérance au glucose au diabète de type 2 patent
Le diabète patent est caractérisé par une augmentation permanente de la glycémie à jeun qui devient
≥126 mg/dL [3]. Les excursions glycémiques postprandiales sont plus longues et plus intenses que
chez le sujet exempt de diabète sucré [14]. Sur le plan physiopathologique, le diabète de type 2 est
caractérisé par 3 anomalies définies il y a quelques années par De Fronzo sous le terme de triumvirat
biologique [15]. Trois organes sont concernés :
- La cellule béta dont la sécrétion est altérée par 2 modifications fondamentales : une
disparition de l'insulinosécrétion précoce [16] et une déficit relatif ou absolu de
l'insulinosécrétion. Au moment de la découverte du diabète sucré il a été démontré que
l'insulinosécrétion résiduelle relative est environ de l'ordre de 50% par rapport à
l'insulinosécrétion d'un sujet normal (figure 4) [17]. Ce déficit insulinosécrétoire s'aggrave
avec le temps
- La cellule musculaire devient de moins en moins insulinosensible. L'insulinorésistance des
tissus périphériques s'intensifie rapidement dans les 2 ou 3 années qui précèdent le
diagnostic pour atteindre ensuite un plateau plus ou moins stable (figure 4) [17].
L'aggravation de l'insulinorésistance est toutefois possible au cours de la maladie car
l'hyperglycémie soutenue et chronique exerce un effet toxique sur les tissus périphériques
[18]. Cet état de glucotoxicité qui est proportionnelle au degré de l'hyperglycémie contribue
à la dégradation de la sensibilité des tissus périphériques à l'insuline.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%