BACCALAUREAT TECHNOLOGIQUE - SESSION 2012 SCIENCES ET TECHNOLOGIES DE LABORATOIRE

1/5
BACCALAUREAT TECHNOLOGIQUE - SESSION 2012
SCIENCES ET TECHNOLOGIES DE LABORATOIRE
Spécialité : Chimie de Laboratoire et de Procédés industriels
Epreuve Techniques de laboratoire
Durée : 4 heures Coefficient : 7
SUJET N° 26
PREPARATION DU PENTAN-3-OL
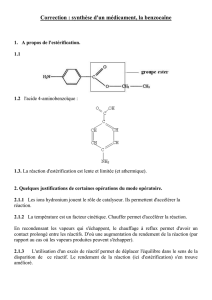
Le pentan-3-ol est obtenu par réduction de la pentan-3-one par le tétrahydruroborate de sodium
(NaBH
4
).
I. DONNEES
Pentan
-
3
-
ol
M = 88,15 g.mol
–
1
d = 0,82 ; T
eb
= 116°C
Forme un azéotrope avec l’eau.
Peu soluble dans l'eau et soluble dans l’éthanol, l’éther diéthylique, la
propanone.
Inflammable, nocif par inhalation, irritant pour les voies respiratoires.
Pentan
-
3
-
one
M = 86,13 g.mol
–
1
d = 0,81 ; T
eb
= 102°C ; pureté : 96 %
Peu soluble dans l'eau et soluble dans l’éthanol, l’éther diéthylique, la
propanone.
Très inflammable.
Ether diéthylique
(éthoxyéthane) M = 74,1 g.mol
-
1
; d = 0,71 ; T
eb
= 35 °C
Extrêmement inflammable ; peut former des peroxydes explosifs.
Tétrahydruroborate
de sodium M = 37,8 g.mol
-
1
; pureté (en masse) : 98 %
Décomposition violente et exothermique avec l’eau. Insoluble dans les
solvants organiques.
Inflammable et toxique ; toxique en cas d’ingestion ; provoque des
brûlures.
Ethanol absolu M = 46,1 g.mol
-
1
; d = 0,79 ; T
eb
= 78 °C
Miscible à l’eau, l’éther, l’acétone.
Facilement inflammable.

2/5
II. MODE OPERATOIRE
1. Réduction de la pentan-3-one
• Dans un tricol de 250 mL équipé d’un réfrigérant, d’une ampoule de coulée, d’un système
d’agitation et d’un thermomètre, dissoudre 3,0 g de tétrahydruroborate de sodium dans
60 mL d’éthanol absolu (on obtient une suspension trouble).
• Verser progressivement 20 mL de pentan-3-one en agitant.
• Régler le débit de façon à maintenir le milieu réactionnel au-dessous de 50 ° C. Refroidir
éventuellement dans un bain d’eau glacée.
• À la fin de l’addition, laisser agiter le milieu réactionnel 30 min à température ambiante.
• Verser 100 mL d'eau sous forte agitation jusqu’à dissolution totale du solide.
2. Obtention du pentan-3-ol
• Transvaser le contenu du tricol dans une ampoule à décanter avec 25 mL d’éther
diéthylique.
• Après séparation de la phase organique, traiter la phase aqueuse par deux fois 25 mL
d’éther diéthylique.
• Réunir les trois phases organiques puis les laver par des fractions de 25 mL de solution
saturée de chlorure de sodium jusqu’à pH voisin de 7.
• Vérifier le pH de la phase aqueuse, à l'aide d'un papier indicateur, et noter sa valeur sur la
feuille de résultats.
• Sécher la phase organique brute sur sulfate de magnésium anhydre. Filtrer.
• Procéder à une distillation simple pour éliminer le maximum d’éther diéthylique.
3. Purification et contrôle de pureté
• Rectifier le mélange sous pression atmosphérique.
• Recueillir le pentan-3-ol dans un flacon préalablement taré et étiqueté (nom du candidat, nom
du produit, tare, masse avec produit).
• Peser le produit rectifié, soit m la masse obtenue.
• Mesurer l'indice de réfraction du produit purifié, en présence de l'examinateur. Noter la
température.
• Effectuer la correction de température pour donner l’indice à 20 °C grâce à la relation :
n
20
= n
T
+ 0,00045 (T - 20), T en °C.

3/5
III. COMPTE RENDU
Compléter la feuille de résultats donnée en page 5/5.
1. On indique que la réaction de réduction met en jeu 4 moles de pentan-3-one pour une mole de
tétrahydruroborate de sodium et donne théoriquement 4 moles de pentan-3-ol après hydrolyse.
Calculer la quantité de matière totale des réactifs introduits. En déduire, en justifiant, le réactif
limitant. Calculer la masse théorique de pentan-3-ol attendue.
2. Expliquer pourquoi on doit contrôler la température lors de l’addition de la pentan-3-one.
3. Décrire la technique utilisée pour identifier la phase organique lors de la décantation.
4. Schématiser la position des phases après les lavages avec la solution de chlorure de sodium
(paragraphe 2.). Indiquer sur le schéma leur composition dans l’ampoule à décanter.
5. Justifier l’intérêt d’utiliser l’éther diéthylique.
6. Expliquer l’intérêt du traitement réalisé avec le chlorure de sodium (paragraphe 2.).
7. Quelle est l’intérêt du séchage sur sulfate de magnésium ? Que se passe-t-il s’il est incomplet ?
8. Donner l’expression du rendement en produit rectifié. Calculer sa valeur.
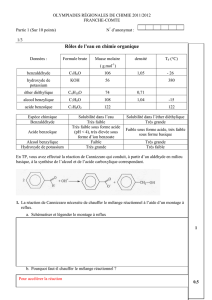
9. Les spectres IR de la pentan-3-one de départ et du pentan–3–ol purifié sont fournis en annexe,
page 4/5. Expliquer comment, à l’aide des spectres, on peut vérifier que la réaction de réduction a
bien eu lieu.
10. Proposer un test chimique simple qui permettrait de montrer que la fonction cétone a disparu
au cours de la transformation.

4/5
ANNEXE
Spectres IR

5/5
NOM : PRENOM :
FEUILLE DE RESULTATS
pH de la solution aqueuse :
pH =
Masse de produit rectifié :
m =
Rendement en produit rectifié :
R =
Aspect du produit rectifié :
Indice de réfraction :
n =
à la température de °C
Indice de réfraction corrigé, à 20 °C :
n
20
=
1
/
5
100%