L L’intérêt de la prévention du cancer du sein É

e tamoxifène est utilisé depuis plus de vingt ans dans
le traitement adjuvant du cancer du sein. Son effet
bénéfique dans les tumeurs ER+ et sur la prévention
du deuxième cancer est largement acquis (1). Cette diminution
du risque de deuxième cancer a amené à proposer son utilisa-
tion dans la prévention du cancer des femmes à risque. Trois
cohortes ont été publiées récemment, provenant de différents
pays. L’essai américain (Breast Cancer Prevention Trial
[BCPT]) concernait les femmes de 35-39 ans ayant un risque de
1,66 % de développer un cancer dans les 5 ans, les femmes de
plus de 60 ans ou celles ayant un cancer lobulaire in situ (2).
L’essai anglais (3) a inclus des femmes avec antécédents fami-
liaux, et l’essai italien des femmes hystérectomisées âgées de
35 à 70 ans (4). La France a refusé d’entreprendre de tels essais
en raison des effets secondaires potentiels du tamoxifène,
considérés comme acceptables chez les femmes ayant un can-
cer du sein mais pas chez des femmes seulement à risque.
Parmi ces effets secondaires figurent la stimulation ovarienne
chez les femmes non ménopausées (effet “clomid-like”), le
risque de cancer de l’endomètre et le risque thromboembolique.
Les résultats de l’étude américaine ont été considérés comme
tellement favorables que les auteurs n’ont pas souhaité
attendre le terme prévu : ils ont donc été publiés par le NCI
(National Cancer Institute) 14 mois avant la fin de l’étude. Le
rapport final a ensuite été publié (2). Cependant, les deux
autres essais en cours, dont les résultats viennent d’être publiés
(3, 4), ne retrouvent pas le même effet protecteur.
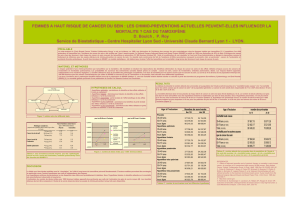
❑Résultats des trois essais de prévention du tamoxifène (2-4)
Un certain nombre de différences existent dans la méthodolo-
gie de ces essais qui peuvent permettre d’expliquer celles
notées dans les résultats.
– L’âge des patientes est plus élevé dans l’étude BCPT : 60 %
des femmes ont plus de 59 ans, contre 62 % qui, dans l’étude
de Powles et coll., ont moins de 50 ans. Dans l’étude de Vero-
nesi et coll., 36 % des femmes ont moins de 50 ans. Le BCPT
rapporte en effet une diminution du RR plus marquée chez les
femmes plus âgées :
• RR = 0,45 si âge > 60 ans ;
• RR = 0,49 si âge = 50-60 ans ;
• RR = 0,56 si âge < 50 ans.
– La fréquence des antécédents familiaux : l’étude italienne
concerne des femmes hystérectomisées dont seulement 18,2 %
avaient un antécédent familial, alors que l’étude anglaise n’a
concerné que des femmes avec un antécédent familial de pre-
mier degré et que le BCPT en a inclus 55 %.
– La puissance des trois études est différente ; en particulier,
le nombre important de perdues de vue dans l’étude de Vero-
nesi lui fait perdre toute puissance significative.
Il est possible que ces différences de populations en termes de
qualité mais aussi de nombre expliquent les résultats contra-
dictoires obtenus. Il faut aussi prendre en compte les effets
secondaires, qui ne sont pas négligeables.
❑Principaux événements dans l’étude BCPT
Veronesi et coll. signalent 64 accidents veineux, dont 38 sous
tamoxifène (42 phlébites superficielles, 9 profondes ou embo-
lies pulmonaires), 14 AVC ischémiques (5 sous placebo et
9 sous tamoxifène) et 5 infarctus sous tamoxifène, ainsi qu’une
fréquence d’hypertriglycéridémie plus importante. Powles rap-
ÉDITORIAL
3
La Lettre du Gynécologue - n° 242 - mai 1999
L’intérêt de la prévention du cancer du sein
par le tamoxifène est-il démontré ?
●
A. Gompel*
* Service de gynécologie de l’Hôtel-Dieu, service du Pr Ph. Poitout, 2, rue
d’Arcole, 75181 Paris Cedex 04.
L
Étude n Moyenne Années- Cancer/1 000
de suivi femmes années-femmes
placebo tamoxifène
Américaine 13 388 69 mois 52 401 6,76 3,43
(BCPT)
Anglaise 2 471 70 mois 12 355 5 4,7
Italienne 5 408 46 mois 20 731 2,3 2,1
13 388 femmes Tamoxifène Placebo
Cancers du sein 85 154
Cancers de l’endomètre 36 15
Embolies pulmonaires 18 6
Phlébites 35 22
Infarctus du myocarde 31 28
AVC 38 24
AIT 19 25
Fractures 137 111
Total 399 385

porte aussi un risque plus élevé de cancer de l’endomètre et de
thromboses, mais avec une incidence plus faible, sans doute en
rapport avec l’âge de sa population, qui est plus jeune.
Un des intérêts majeurs du BCPT est en fait de suggérer que la
diminution du risque pourrait concerner les femmes ayant des
hyperplasies atypiques et des cancers lobulaires in situ (CLIS),
et donc porteuses de lésions précancéreuses : RR = 0,44 (IC :
0,16-1,06) si CLIS, contre 0,51 (IC : 0,39-0,68) sans CLIS, et
RR = 0,14 (IC : 0,03-0,47) pour les hyperplasies atypiques.
Cependant, ces essais laissent persister beaucoup de questions
concernant le rôle préventif des antiestrogènes.
Ces molécules n’ont-elles un effet préventif que sur les
tumeurs hormonodépendantes, qui sont celles de meilleur pro-
nostic ? Cela a été suggéré par les résultats du BCPT et par
ceux encore préliminaires obtenus avec le raloxifène. Le
raloxifène a été expérimenté dans des essais de prévention de
l’ostéoporose et des fractures ; ce produit est développé dans
cette indication, et les études ont été conduites avec comme
objectif primaire la prévention osseuse et non la prévention
mammaire, qui a été évaluée secondairement, ce qui retire un
peu de valeur aux résultats. Ces essais, d’une durée encore
relativement courte, rapportent un effet favorable sur l’inci-
dence des nouveaux cancers du sein chez des femmes recevant
le traitement par rapport à un groupe placebo (5, 6), pour une
médiane de suivi de 28,9 mois, RR = 0,24 (IC : 0,13-0,52), ce
qui suggère un effet suspensif sur l’émergence du nouveau
cancer. Cependant, la réduction du risque ne concerne que les
tumeurs ER+. La question posée est : peut-on créer des trans-
formations phénotypiques de tumeurs ER+ en ER- avec un
traitement prolongé par antiestrogènes, compte tenu de l’émer-
gence décrite de résistances au tamoxifène dans les tumeurs du
sein ?
Si l’on confirme les résultats optimistes du BCPT en matière
de nouveaux cas de cancer, il resterait à prouver qu’on amé-
liore le taux de mortalité par cancer du sein, l’effet du traite-
ment pouvant n’être que suspensif et ne faire que retarder
l’émergence de la maladie et/ou, comme nous venons de le
dire, que transformer le phénotype de la tumeur.
Ainsi, compte tenu de l’absence de consensus sur les résultats
des trois cohortes et du nombre non négligeable d’effets secon-
daires, il est impossible à l’heure actuelle de conseiller
l’emploi du tamoxifène en prévention primaire du cancer
du sein, et la position de la Société française de sénologie
(SFS) est restée inchangée (7). Il est possible qu’une autre
voie d’administration puisse offrir un intérêt particulier dans
cette indication. Ainsi, afin de pallier les effets systémiques de
l’administration de tamoxifène, une forme percutanée du
dérivé actif est actuellement développée, le 4OH-tamoxifène
(8). L’administration sur l’aire mammaire de ce gel permet
d’obtenir des concentrations intramammaires de 4OH-tamoxi-
fène très supérieures à ce qui est retrouvé dans le plasma. Des
essais cliniques démarrent avec ce produit, dont les indications
pourraient s’étendre à la prévention du cancer du sein.
Il est enfin certainement utile, comme le proposait la SFS, de
disposer d’essais complémentaires chez les femmes à très haut
risque, comme celles porteuses de lésions précancéreuses. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Early breast cancer trialists’collaborative group. Tamoxifen for early breast
cancer : an overview of the randomized trials. Lancet 1998 ; 351 : 1451-67.
2. Fisher B., Costantino J.P., Wickerham D.L. et coll. Tamoxifen for prevention
of breast cancer : report of the National Surgical Adjuvant Breast and Bowel
Project P-1 Study. J Nat Cancer Inst 1998 ; 90 : 1371-88.
3. Powles T., Eeles R., Ashley S. et coll. Interim analysis of the incidence of
breast cancer in the Royal Marsden Hospital Tamoxifen Randomised Chemo-
prevention trial. Lancet 1998 ; 352 : 98-101.
4. Veronesi U., Maisonneuve P., Costa A. et coll. Prevention of breast cancer
with tamoxifen : preliminary findings from the Italian randomised trial among
hysterectomised women. Lancet 1998 ; 352 : 93-7.
5. Cummings S.R., Norton L., Eckert S. et coll. Raloxifene reduces the risk of
breast cancer and may decrease the risk of endometrial cancer in post-meno-
pausal women. Two-year findings from the Multiple Outcomes of Raloxifene
Evaluation (MORE) trial. ASCO 1998 ; abstr. 3.
6. Jordan V.C., Glusman J.E., Eckert S. et coll. Incident primary breast cancers
are reduced by raloxifene : integrated data from multicenter, double-blind, ran-
domized trials in 12 000 postmenopausal women. ASCO 1998 ; abstr. 466.
7. Eisinger F., Espié M. et coll. La chimioprévention du cancer du sein. Bull
Cancer 1998 ; 85 : 725.
8. Mauvais-Jarvis P., Baudot N., Castaigne D., Banzet P., Kuttenn F. Trans-4-
hydroxytamoxifen concentration and metabolism after local percutaneous admi-
nistration to human breast. Cancer Res 1986 ; 46 : 1521-5.
4
La Lettre du Gynécologue - n° 242 - mai 1999
ÉDITORIAL
1
/
2
100%