Lire l'article complet

u terme de ces deux premières
années du troisième millénaire,
les “résultats révolutionnaires”
concernant la cancérologie digestive
peuvent, sans doute au cours d’une ana-
lyse trop superficielle, apparaître bien
rares. Cependant, dans l’énorme
richesse des publications de cette dis-
cipline active (20137 références dans
PUBMED), de très nombreuses, sou-
vent fruits d’études débutées dans les
années 1990, rapportent des progrès
majeurs, tant dans les connaissances
épidémiologiques ou des mécanismes
fondamentaux que dans les stratégies
préventives, diagnostiques ou théra-
peutiques.
Du point de vue
épidémiologique
Le scoop attendu (mais scoop tout
de même) est l’étude prospective
d’Uemura et al. établissant de façon
indiscutable l’association infection par
Helicobacter pylori (Hp) et dévelop-
pement du cancer gastrique, probable-
ment par le biais d’une gastrite atro-
phique. Parmi les 3 % de cancers
gastriques survenus chez 1 526 patients
suivis endoscopiquement à long terme
pour des pathologies gastroduodénales
variables, tous étaient porteurs de Hp
recherché selon trois méthodes diffé-
rentes. Aucun cancer n’était rapporté
chez les patients Hp négatif ou chez les-
quels Hp a été éradiqué. Ces résultats
poussent à la recherche de Hp chez les
patients porteurs d’une dyspepsie non-
ulcéreuse correspondant au groupe le
plus à risque dans cette population
japonaise à haute incidence de cancer
gastrique (26). Ces résultats, pour
autant qu’ils soient transposables dans
nos populations, poussent à revoir la
conférence de consensus en incitant à
la recherche et à l’éradication systé-
matique de Hp dans la dyspepsie
pseudo-ulcéreuse.
Les registres nationaux suédois ont été
utilisés dans le cadre de trois études
rétrospectives successives. Elles ont
porté respectivement sur 278 400,
268 312 et 268 332 patients cholécys-
tectomisés pour lithiase entre 1965 et
1997, montrent que la cholécystecto-
mie est un facteur de risque modéré
d’apparition d’adénocarcinome de l’œ-
sophage, du grêle et du côlon droit, par
rapport à des groupes contrôles de
patients non cholécystectomisés appa-
riés en termes de sexe, âge, poids, prise
de tabac, pathologie ulcéreuse ou
inflammatoire intestinale associée… Il
n’est pas retrouvé d’accroissement du
risque pour les tumeurs du pancréas ou
celles du côlon gauche. Ces résultats
insistent sur l’intérêt de ces registres,
même si leurs conséquences pratiques
sont probablement faibles (12, 5, 27).
Du point de vue
des connaissances
fondamentales
La possibilité d’étudier simultanément
l’expression de milliers de gènes grâce
aux puces à ADN (16) ou d’analyser
des milliers de protéines cellulaires
grâce aux progrès de la spectrométrie
et des procédures de chromatographie
(18) permet d’espérer pouvoir étudier
l’intégralité de l’ADN (génome), des
ARN (transcriptome) ou des protéines
(protéinome) produites par une cellule
donnée, normale ou pathologique.
Ainsi sont nées la génomique et la pro-
téomique qui révolutionnent la voie de
la compréhension des mécanismes
moléculaires intimes des tumeurs dont
les applications cliniques sont poten-
tiellement nombreuses : diagnostic
précoce et précis, pronostic évolutif,
susceptibilité thérapeutique… Plu-
sieurs publications rapportent l’impact
de ces techniques en cancérologie
digestive.
Bien que l’étude génomique de Roo-
ney et al., qui utilise les techniques
d’hybridation génomique comparative,
ne porte que sur 29 cancers coliques
sporadiques stade III, elle montre des
aberrations chromosomiques multiples
au niveau des cellules tumorales, soit
à type de pertes de fragments chromo-
somiques (dans 41 % des cas), soit à
type de gains (76 %), sans pouvoir
30
Act. Méd. Int. - Gastroentérologie (17), n°1 - janvier-février 2003
G. Tordjman*
Progrès en cancérologie
* Créteil.
RétroSPECTIVE
PerSPECTIVE
2
0
0
1
-
2
0
0
2
A

cependant en tirer un impact pronos-
tique, même si la coexistence de plus
de deux aberrations paraît défavo-
rable (20). La survenue de cancer
colique est liée à des mutations
secondaires, soit à une instabilité
chromosomique, soit à une instabilité
des microsatellites sans que l’on
sache si le mode de mutation a une
conséquence clinique sur la présen-
tation ou l’évolutivité des tumeurs
qu’elle détermine. En étudiant
607 cancers du côlon chez des
patients de moins de 50 ans, Gryfe et
al. ont montré que l’existence d’une
instabilité des microsatellites (retrou-
vée dans 17 %) était un facteur pré-
dictif d’évolution plus favorable et
avec une plus faible extension méta-
statique (6). Dans une étude portant
sur 10 tumeurs coliques, le profil pro-
téique de la matrice cellulaire des cel-
lules cancéreuses se révélait différent
de celui des cellules des tissus péri-
tumoraux ou coliques normales,
confirmant, d’une part, les diffé-
rences d’expression du génome
tumoral et, d’autre part, l’intérêt
éventuel de la connaissance de ces
profils protéiques dans le diagnostic
précoce et le dépistage (1).
La cyclooxygénase de type 2
(COX-2), surexprimée en cas d’adé-
nome et d’adénocarcinome colique,
carcinome gastrique et œsophagien,
semble avoir un rôle certain dans la
carcinogenèse même si ses méca-
nismes sont encore mal connus : acti-
vation de la prolifération cellulaire
favorisant la dysplasie, inhibition de
l’apoptose, augmentation des pro-
priétés invasives des cellules tumo-
rales, accroissement de la néoangio-
genèse… L’action des anti-COX-2
dans une indication préventive reste
bien sûr à prouver même si leur rôle
semble intéressant mais incomplet
dans la prévention des adénomes
coliques en cas de polypose familiale
adénomateuse (23) et l’utilisation de
Rofecoxib®25 mg par jour semble
diminuer l’apparition de la dysplasie
sur œsophage de Barrett (11).
Du point de vue préventif
et diagnostique
Sans insister sur l’endoscopie faisant
l’objet d’un chapitre particulier, il
paraît illusoire de parler de cancéro-
logie digestive sans rappeler le rôle
fondamental de cette technique dans
la prévention, le diagnostic et le trai-
tement des cancers digestifs. Ce rôle,
prouvé par le passé, a, quoi qu’on en
dise, un très bel avenir. De nombreux
travaux mettent en évidence l’intérêt
croissant de la chromoendoscopie,
de la magnification, de la spectro-
scopie et de la tomographie de cohé-
rence optique couplée à l’endosco-
pie dans le diagnostic précoce des
lésions néoplasiques tant œsopha-
giennes ou gastriques que coliques,
notamment en matière de lésions
planes. La coloscopie de dépistage
chez les patients aux antécédents per-
sonnels ou familiaux de polypes adé-
nomateux ou de néoplasie colique est
chose admise (conférence de consen-
sus). Le dépistage de la population
générale est plus discuté, mais Lie-
berman et al. incitent, dans deux
études de grande puissance, à pro-
poser la coloscopie systématique
dans cette indication, en montrant
notamment que l’association d’un
Hémoccult®et d’une rectosigmoïdo-
scopie laissent échapper une lésion
néoplasique avancée du côlon droit
dans 24 % des cas… (14, 15). La
conclusion de l’éditorial du New
England accompagnant la seconde
publication est édifiante lorsqu’au
terme d’une revue des cinq princi-
pales raisons qui n’ont pas fait rete-
nir la coloscopie dans les “guide-
lines” du dépistage colique (absence
de niveau de preuve suffisant, risque
de non adhésion des patients à un
examen désagréable, sévérité des
effets secondaires éventuels de la
technique, coût élevé, inadéquation
entre les besoins et les moyens en
homme et en matériel), elle propose
une coloscopie systématique à tout
sujet de 50 ans, asymptomatique et
sans antécédent, avec un contrôle à
10 ou 15 ans en cas d’examen néga-
tif... (3).
Cette attitude n’étant pas retenue par
tous, l’intérêt du dépistage du cancer
côlon par Hémoccult II®est démon-
tré pour la troisième fois par une étude
danoise effectuée entre 1985 et 2002
sur 30 967 sujets âgés de 45 à 75 ans.
La réalisation d’un test systématique
tous les deux ans avec coloscopie en
cas de positivité permet de diminuer
le taux de mortalité par cancer du
côlon par rapport à un groupe
contrôle. Le risque relatif est à 0,82 et
diminue à 0,70 avec un suivi de 7 ans,
mais rejoint celui des témoins en cas
d’arrêt prématuré du suivi (9). Com-
bien d’études seront-elles nécessaires
avant d’institutionaliser ce type de test
de dépistage, peu coûteux et certai-
nement plus simple que les méthodes
de détection par biologie moléculaire
de mutation de gènes dans les selles
(analyse de p53 et de K-ras) (4) ?
La TEP (tomographie par émission de
positrons) confirme dans deux études
son rôle fondamental dans le dia-
gnostic de récidive de cancer colique
chez des patients ayant eu un premier
traitement chirurgical curateur et pré-
sentant une élévation isolée de l’anti-
gène carcino-embryonnaire (ACE).
Cet examen est proposé au terme d’un
bilan morphologique complet (colo-
scopie, TDM abdomino-pelvien, scin-
tigraphie osseuse, IRM) négatif.
Libutti et al. retrouvent chez
26 patients, une récidive dans 94 %
des cas et précise sa localisation dans
81 % des cas (13). Taïeb et al. dia-
gnostiquent une récidive dans 79 %
des cas permettant une prise en charge
chirurgicale chez 18 patients dont 16
résections complètes (24). Ces études
n’évaluent pas le bénéfice d’un dia-
gnostic plus précoce en termes de sur-
vie, mais permettent d’affirmer son
intérêt dans la stratégie thérapeutique:
laparotomie à visée d’exérèse com-
plète si une lésion résécable a été
repérée ou s’il y a discussion d’un
traitement systémique si aucune
31
Act. Méd. Int. - Gastroentérologie (17), n°1 - janvier-février 2003
RétroSPECTIVE
PerSPECTIVE
2
0
0
1
-
2
0
0
2

lésion n’a été retrouvée ou s’il y a irré-
sécabilité. Le suivi régulier de l’ACE
après premier traitement curateur
reste donc de mise en regrettant la fai-
blesse actuelle du parc des PETscan
en France.
Du point de vue
thérapeutique
L’élaboration de stratégies thérapeu-
tiques précises fait l’objet du plus
grand nombre des publications rap-
portées. La place de la chimiothéra-
pie en cancérologie digestive se voit
encore renforcée tant en adjuvant à la
chirurgie qu’en palliatif.
Dans l’adénocarcinome gastrique ou
du cardia, l’intérêt d’un traitement
adjuvant à la chirurgie est discuté. En
montrant une augmentation de la sur-
vie de 9 % à trois ans chez les patients
ayant une radiothérapie (45 Gy sur
5semaines) couplée à 2 cures de chi-
miothérapie de type FUFol (première
et cinquième semaine) après une
résection macroscopiquement com-
plète de la tumeur, Mac Donald et al.
ont institué pour certaines équipes un
standard thérapeutique. La prudence
reste cependant de mise en raison
d’une chirurgie incomplète (R0) dans
54 % des cas et d’un groupe chimio-
thérapie seule non optimale (17).
Rapportée par Neoptolemos dans le
Lancet, l’étude multicentrique de
l’European Study Group for Pancrea-
tic Cancer (ESPAC-1) montre l’effet
bénéfique d’une chimiothérapie adju-
vante à une résection pancréatique
curative dans le traitement de l’adé-
nocarcinome ductal du pancréas
(médiane de survie à 2 ans de
19,7 mois chez les 238 patients rece-
vant une chimiothérapie adjuvante
versus 14 mois chez les 235 patients
non traités). Par ailleurs, cette étude
met en évidence un effet délétère de
la radiochimiothérapie (médiane de
survie de 15,5 mois chez les
175 patients recevant une radiochi-
miothérapie adjuvante versus
16,1 mois chez les 178 patients non
traités). Même si l’on peut regretter
que cet essai, pragmatique, n’ait pas
prévu un bras contrôle de chirurgie
seule, ou que le protocole de chimio-
thérapie utilisé (5-FU + acide foli-
nique) soit non optimal et sans gem-
citabine, dans l’attente des résultats
de l’essai ESPAC-2, l’opportunité
d’une chimiothérapie adjuvante sans
radiothérapie doit être systématique-
ment discutée (19). Par ailleurs, la
gemcitabine est devenue le nouveau
standard thérapeutique des cancers
avancés du pancréas. Comparée au
5-FU ou à des inhibiteurs des métal-
loprotéinases, la supériorité de la
gemcitabine apparaît en termes de
survie, de temps de réponse sans pro-
gression, de tolérance et surtout du
bénéfice clinique (maintien de l’in-
dex de Karnofsky ou diminution des
besoins en antalgiques morphi-
niques). Dans cinq essais contrôlés,
l’association gemcitabine/cisplatine
augmente la survie en permettant une
stabilisation de la croissance tumo-
rale. Cela n’est pas retrouvé avec l’as-
sociation gemcitabine/5-FU et non
encore prouvé sur des premiers résul-
tats prometteurs pour des combinai-
sons gemcitabine avec oxaliplatine,
irinotécan, docétaxel, capécitabine
ou, plus récemment, inhibiteurs des
métalloprotéinases, inhibiteurs du ras
farnesyltransférase ou des anticorps
monoclonaux anti epidermal growth
factor (7).
La colectomie totale reste le traite-
ment préventif de l’adénocarcinome
colique en cas de polypose familiale
adénomateuse devant l’inefficacité du
Sulindac®dans la prévention du déve-
loppement de polypes chez les sujets
porteurs d’une PAF. Ces résultats à
4ans démentent ceux publiés après
6 mois de suivi, en suggérant ainsi
l’apparition d’une résistance. Ces
résultats ne remettent cependant pas
en cause l’action éventuelle des AINS
ou des anti-COX-2 dans l’apparition
ou la prévention des récidives des
polypes sporadiques.
La place de la chimiothérapie adju-
vante à la chirurgie est confirmée dans
les adénocarcinomes coliques stade III
mais ne semble pas devoir être propo-
sée dans les stade II comme le montre
l’étude rétrospective d’une cohorte de
3725 patients dont 31 % avaient reçu
une chimiothérapie adjuvante à une
chirurgie considérée comme curative
d’un adénocarcinome colique stade II:
pas de modification significative de la
survie à 5 ans entre les groupes traités
ou non (22). Un des problèmes de cette
chimiothérapie adjuvante était la
limite d’âge alors même que ces
tumeurs sont diagnostiquées préfé-
rentiellement après 65 ou 70 ans… La
méta-analyse de Sargent et al. regrou-
pant 3 351 patients met en évidence
une efficacité comparable des
chimiothérapies adjuvantes classiques
(5-FU/ levamisole ou 5-FU/acide foli-
nique), sans accroissement significa-
tif (hormis la leucopénie) avant ou
après 70ans (21). L’âge ne semble plus
une limite, mais cela reste à réévaluer
car seuls 15 % des patients de cette
étude étaient âgés de plus de 75 ans…
Pour les cancers coliques métastasés,
la capécitabine, prodrogue orale du
5-FU, semble aussi efficace en termes
de survie globale ou sans progression
(13 mois), que l’association 5-FU/
acide folinique avec moins de mucite,
d’alopécie ou de neutropénie mains
avec plus de syndrome main-pied (8).
Le standard actuel de la chimiothéra-
pie des cancers coliques métastasés
reste une trithérapie par 5-FU + acide
folinique + oxaliplatine (FolFOX) ou
irinotécan (FolFIRI). La meilleure
séquence thérapeutique FolFOX /Fol-
FIRI ou inversement reste discutée
(25).
Kapiteijn et le Dutch Colorectal Can-
cer Group ont validé, sur 1861 adé-
nocarcinomes rectaux non métasta-
sés, l’intérêt de :
– l’exérèse du mésorectum précé-
demment rapportée par l’équipe
danoise de Martling et al.
– la radiothérapie préopératoire
(25 Gy en 5 semaines), en termes de
32
Act. Méd. Int. - Gastroentérologie (17), n°1 - janvier-février 2003
RétroSPECTIVE
PerSPECTIVE
2
0
0
1
-
2
0
0
2

récidive locale, quels que soient le
stade et le siège de la tumeur, même
si les résultats sont statistiquement
plus nets pour les lésions du moyen et
du bas rectum, de stade II ou III (10).
Une revue de cancérologie digestive
serait incomplète sans aborder le sujet
des tumeurs stromales gastro-intesti-
nales métastatiques ou non résécables
considérées comme incurables jus-
qu’à l’avènement récent de l’inhibi-
teur de la tyrosine-kinase (KIT) :
l’imatinib-mésylate (Glivec®). Deme-
tri et al. ont montré sur 147 patients
porteurs d’une tumeur stromale diges-
tive, une réponse partielle dans 53,7 %
des cas, une stabilité lésionnelle dans
27,9 % des cas et une réponse soute-
nue de plus de 24 semaines dans
86,4 %. La tolérance de ce traitement,
à la posologie de 400à 600 mg par
jour, semble excellente, hormis 5 %
de complications hémorragiques
loco-régionales (2).
L’ exercice de la revue rétrospective
expose au dangereux biais de la par-
tialité de son auteur. Cet article n’y
a certainement pas échappé en per-
mettant toutefois de se rendre compte
de l’énorme richesse des avancées
récentes qu’a connue la cancérologie
digestive alors que ce siècle n’a
“que” 2 ans… Avec l’avènement de
la génomique et de la protéomique,
des puces à ADN, la sensibilité crois-
sante des techniques diagnostiques,
l’apparition de nouvelles chimiothé-
rapies plus spécifiques et à la galé-
nique plus simple, la meilleure com-
préhension des facteurs de réponse
des tumeurs aux cytotoxiques asso-
ciés à une politique rigoureuse de
dépistage, on peut rêver que si le XXe
siècle a vu la défaite de la maladie
bactérienne, le XXIesera celui de la
victoire de la médecine sur la mala-
die cancéreuse.
Références
1. Brunagel G, Dietmeier BN, Bauer AJ
et al. Identification of nuclear matrix
protein alterations associated with
human colon cancer. Cancer Res 2002 ;
62 : 2437-42.
2. Demetery GD, Von Mehren M, Blanke
CD et al. Efficacy and safety of imatinib
mesylate in advanced gastrointestinal
stromal tumors. N Eng J Med 2002 ;
347 : 472-80.
3. Detsky AS. Screening for colon cancer –
Can we afford colonoscopy ? N Engl J med
2001 ; 345 : 607-8.
4. Dong SM, Traverso G, Jonhson C et
al. Detecting colorectal cancer in stool
with the use of multiple genetic target. J
Natl Cancer Inst 2001 ; 93 : 858-65.
5. Freedman J, Ye W, Näslund E et al.
Association between cholecystectomy
and adenocarcinoma of esophagus.
Gastroenterology 2001 ; 121 : 548-53.
6. Gryfe R, Kim H, Hsieh ETK et al.
Tumor microsatellite instability and cli-
nical outcome in young patients with
colorectal cancer. N Eng J Med 2000 ;
342 : 69-77.
7. Heinemann Volker. Present and futur
treatment of pancreatic cancer. Seminars in
oncology 2002 ; (29) 3 (suppl 9) : 23-31.
8. Hoff PM, Ansari R, Batist G et al.
Comparison of oral capecitabine versus
intravenous Fluorouracile plus Leucovorin
in patients with metastatic colorectal can-
cer : results of a large Phase III study. J
Clin Oncol 2001 ; 19 : 4097-106.
9. Jorgensen OD, Kronborj O, Fenjer G
et al. A randomized study of screening
for colorectal cancer using faecal occult
blood testing : results after 13 years and
seven biennial screenings rounds. Gut
2002 ; 50 : 29-32.
10. Kapiteijn E, Marijnen CA,
Nagtegaal ID, Dutch Colorectal Cancer
Group. Preoperative radiotherapy com-
bined with total mesorectal excision for
resectable rectal cancer. N Engl J Med
2001, 345 : 638-46.
11. Kaur BS, Khamnehei N, Iravani M et
al. Rofecoxib inhibits cyclooxygenase 2
expression and activity and reduces cell
proliferation in Barrett’s oesophagus.
Gastroenterology 2002 ; 123 : 60-7.
12. Lagergren J, Ye W, Ekbom A.
Intestinal cancer after cholecystectomy :
is bile involved in carcinogenesis ?
Gastroenterology 2001 ; 121 : 542-7.
13. Libutti SK, Alexander HR, Choyke P
et al. A prospective study of 2-[18F]
fluoro-2-deoxy-D-glucose/positron emis-
sion tomography scan, 99mTc-labeled
arcitumomab (CEA-Scan), and blind
second look laparotomy for detecting
colon cancer recurrence in patients with
increasing carcinoembryonic antigen
levels. Ann Surg Oncol 2001 ; 8 : 779-86.
14. Lieberman DA, Weiss DG, Bond JH
et al. Use of colonoscopy to screen
asymptomatic adults for colorectal can-
cer. N Engl J Med 2000 ; 343 (3) : 162-8.
15. Lieberman DA, Weiss DG et al. One-
time screening for colorectal cancer with
combined fecal occult-blood testing and
examination of the distal colon. N Engl J
Med 2001 ; 345 : 555-60.
16. Lockhart DJ, Winzeler EA.
Genomics, gene expression and DNA
arrays. Nature 2000 ; 405 : 827-36.
17. Macdonald JS, Smalley SR,
Benedetti J et al. Chemoradiotherapy
after surgery compared with surgery
alone for adenocarcinoma of the stomach
or oesophageal junction. N Engl J Med
2001 ; 345 : 725-30.
18. Mann M, Hendrickson RC, Pandley
A. Analaysis of proteins ant proteomes by
mass spectrometry. Annu Rev Biochem
2001 ; 70 : 437-73.
19. Neoptolemos JP, Dunn JA, Stocken
DD et al. for the members of the
European Study Group for Pancreatic
Cancer. Adjuvant chemoradiotherapy
and chemotherapy in resectable pancrea-
tic cancer : a randomised controlled
trial. Lancet 2001 ; 358 : 1576-85.
20. Rooney PH. Colorectal cancer
genomics : evidence for multiple geno-
types which influence survival. Br J
Cancer 2001 ; 85 : 1492-8.
21. Sargent DJ, Goldberg RM, Jacobson
SD et al. A pooled analysis of adjuvant
chemotherapy for resected colon cancer
in elderly patients. N Engl J Med 2001 ;
345 : 1091-7.
22. Schrag D, Gelfand S, Bach P et al.
Adjuvant chemotherapy for stage II
colon cancer : insight from a SEER-
Medicare cohort. Pro Am Soc Clin oncol
2001, 20 : 123a.
23. Steinbach G, Lynch PM, Phillips RK
et al. The effect of celecoxib, a cyclooxy-
genas-2 inhibitor, in familial adenoma-
tous polyposis. N Engl J Med 2000 ;
342 : 1946-52.
24. Taïeb J, Lumbroso J, Auperin A et al.
33
Act. Méd. Int. - Gastroentérologie (17), n°1 - janvier-février 2003
RétroSPECTIVE
PerSPECTIVE
2
0
0
1
-
2
0
0
2

Intérêt de la tomographie par émission
de positrons (TEP) au [18F]-2-deoxy-D-
glucose dans la prise en charge des
patients présentant une augmentation
isolée de l’antigène carcino-embryon-
naire (ACE) après traitement curatif
d’un cancer colorectal. Gastroenterol
Clin Biol 2002 ; 26 : A51.
25. Tournigand C, Louvet C, Quinaux E
et al. FOLFIRI followed FOLFOX versus
FOLFOX followed by FOLFIRI in
metastatic colorectal cancer : final
results of a phase III study. Pro Am Soc
Clin oncol 2001, 21 : 124a.
26. Uemura N, Okamoto S, Yamamoto S
et al. Helicobacter pylori infection and
the development of gastric cancer. N
Engl J Med 2001 ; 345 : 784-9.
27. Ye W, Lagergren J, Nyren O, Ekbom
A. Risk of pancreatic cancer after chole-
cystectomy : a cohort study in Sweden.
Gut 2001 ; 49 : 678-81.
34
Act. Méd. Int. - Gastroentérologie (17), n°1 - janvier-février 2003
RétroSPECTIVE
PerSPECTIVE
2
0
0
1
-
2
0
0
2
Interview du
Pr P. Piedbois*
*Chef du service
d’oncologie médicale
de l’hôpital Henri-Mondor
(AP-HP), Créteil.
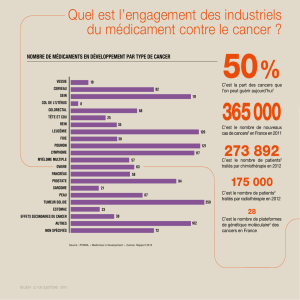
Avis de l’expert De nouvelles pistes thérapeutiques médicamenteuses différentes de
la chimiothérapie anticancéreuse classique semblent enfin appa-
raître. S’agit-il encore d’un mythe ou déjà d’une réalité ?
Il est exact que le développement actuel des médicaments anticancé-
reux s’oriente vers des pistes nouvelles. Même si la recherche clinique
et biologique consistant en la mise au point de substances cyto-
toxiques, et donc peu sélectives, est toujours d’actualité, les progrès
réalisés ces 20 dernières années dans la compréhension des phéno-
mènes de cancérisation combinés aux progrès de la biotechnologie
permettent d’espérer pour la première fois l’utilisation de médicaments
mieux ciblés, tirant en quelque sorte mieux profit des particularités des
cellules cancéreuses.
En cancérologie digestive, on a beaucoup parlé du Glivec®. Mais ce
médicament est tout de même réservé à une catégorie rare de
tumeurs. Peut-on attendre d’autres avancées du même genre pour
des cancers beaucoup plus fréquents comme les cancers coliques par
exemple ?
Le Glivec® est effectivement un excellent exemple. Conceptuellement,
l’idée est très élégante. Certains cancers, comme les tumeurs stromales
digestives (GIST), peuvent exprimer une mutation du proto-oncogène
c-kit. Le Glivec® inhibe l’activité tyrosine-kinase du récepteur KIT et, en
clinique, s’est montré particulièrement efficace chez les malades atteints de GIST. Il s’agit bien sûr de tumeurs
relativement rares, et il est trop tôt pour dire si le Glivec® sera actif sur d’autres types de cancers, même si le
même effet a déjà été observé in vitro sur certaines lignées de cellules coliques. Il s’agit en réalité d’un for-
midable encouragement pour le développement de médicaments mieux ciblés. D’autres éléments clés sont en
effet l’objet de recherches. Par exemple, les métalloprotéinases de la matrice extracellulaire (MMP), qui sont
des enzymes protéolytiques impliquées dans la croissance tumorale et le caractère métastasant des cancers en
dégradant la membrane basale et en modifiant la composition de la matrice extracellulaire. Des inhibiteurs des
MMP (MMPI), comme le BAY12-9566, ont été mis au point et sont l’objet de développement clinique, notam-
ment dans les cancers colorectaux. On peut encore citer les inhibiteurs de la farnesyl-transférase, qui bloquent
la farnélysation de ras, oncogène aux rôles majeurs dans la cancérisation, notamment colique, et dans les phé-
nomènes de résistance, notamment à la radiothérapie. Là encore, le développement clinique a débuté. Il y a
aussi bien sûr les inhibiteurs de l’angiogenèse, ou plus simplement, les anti-COX-2. On peut aussi citer les anti-
corps monoclonaux dirigés contre des antigènes membranaires, tel l’Edrocolomab développé en situation adju-
vante et pour lequel les résultats actuels sont contradictoires. Parmi ces voies nouvelles, une des plus intéres-
santes, et aux retombées possibles en matière de cancérologie digestive, est celle des inhibiteurs du récepteur
à l’EGF (Epidermal Growth Factor). On connaît les rôles clés de l’EGF dans les phénomènes de cancérisation :
autonomisation vis-à-vis des signaux de prolifération, insensibilité aux signaux antiprolifératifs, échappement
à l’apoptose, participation à l’angiogenèse, invasion tissulaire et pouvoir métastasant.
 6
6
1
/
6
100%