Lire l'article complet

Dossier
Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume II, n°4, août 1998
22
La différenciation
de l’appareil génital
Si, dès la fécondation, le sexe génétique de
l’œuf est déterminé, l’appareil génital de
l’embryon passe par un stade indifférencié
doué d’une bipotentialité, grâce à la coexis-
tence d’un double système de canaux : les
canaux de Wolff qui seront à l’origine de
l’épididyme, des canaux déférents et des
vésicules séminales chez l’homme, et les
canaux de Müller qui se différencieront en
utérus, trompes de Fallope et partie supé-
rieure du vagin chez la femme. Comme
l’avait envisagé Alfred Jost dès 1947, on
sait bien maintenant que cette différencia-
tion sexuelle est provoquée par l’action de
deux hormones (figure 1) produites par le
testicule immature, la testostérone et l’hor-
mone anti-müllérienne (AMH). Elles sont
produites après la différenciation de la
gonade fœtale en testicule, qui est observée
à partir de la fin de la 7esemaine de gesta-
tion sous l’action du facteur déterminant
testiculaire SRY, dont le gène est porté par
le chromosome sexuel Y. C’est la testosté-
rone, produite par les cellules de Leydig,
qui maintient les canaux de Wolff ; c’est
elle aussi qui, métabolisée en dihydro-tes-
tostérone par la 5α-réductase, est respon-
sable de la masculinisation du sinus urogé-
nital et des organes génitaux externes.
C’est l’AMH, produite par les cellules de
Sertoli dès les premiers stades de différen-
ciation du testicule, qui est responsable de
la régression des canaux de Müller.
L’AMH continue à être produite par le tes-
ticule fœtal après la naissance, mais sa pro-
duction diminue progressivement pour dis-
paraître au moment de la puberté. On peut
la détecter dans le sérum. Un test ELISA de
l’AMH sérique a été récemment commer-
cialisé par la société Immunotech
(Marseille) sous licence INSERM ; il per-
met de la suivre chez le garçon jusqu’à la
puberté. L’AMH sérique s’est ainsi révélée
être un excellent marqueur de la présence
d’un testicule dans les cas de cryptorchidie
ou d’ambiguïté sexuelle, son dosage est
jusqu’à la puberté plus facile que celui de la
testostérone qui, chez le garçon impubère,
ne peut être dosée qu’après une stimulation
par la gonadotrophine chorionique.
La production d’AMH n’est pourtant pas
l’apanage du sexe mâle. Une production
d’AMH a également été mise en évidence
dans l’ovaire adulte ; l’AMH y est produite
par les cellules de la granulosa du follicule,
et son rôle éventuel n’est pas connu. Chez
l’animal, un effet de l’AMH a, d’autre part,
été mis en évidence sur l’ovaire fœtal, qui
normalement n’est pas exposé à l’hormone.
Des ovaires fœtaux placés en culture en
présence d’AMH présentent une masculini-
sation morphologique, avec une “inversion
endocrine”, puisqu’ils produisent de la tes-
Les récepteurs de l’hormone
anti-müllérienne
J.-Y. Picard*
✎
L’hormone anti-müllérienne
(AMH) est produite par les cellules
de Sertoli du testicule immature.
Elle est responsable de la régres-
sion des canaux de Müller,
ébauches des trompes de Fallope,
de l’utérus et de la partie supé-
rieure du vagin.
✎
L’AMH est une glycoprotéine
dimère qui appartient à la famille
du TGF-ß.
✎
L’AMH peut être directement
dosée dans le sérum chez le garçon
jusqu’à la puberté.
✎
Son récepteur primaire, aussi
appelé récepteur de type II, est une
sérine-thréonine kinase à un seul
domaine transmembranaire. La
transduction du signal pourrait
passer par un récepteur de type I et
la famille des protéines SMAD.
✎
Le syndrome de persistance des
canaux de Müller (PMDS) est un cas
particulier de pseudo-hermaphro-
disme masculin qui se présente
avec la persistance d’un utérus
et/ou de trompes chez des garçons
normalement masculinisés.
✎
Le signe d’appel du PMDS est
une hernie inguinale ou une cryp-
torchidie.
✎
Le PMDS est généralement dû à
une anomalie du gène de l’AMH ou
du gène de son récepteur primaire.
Le récepteur de type I, encore
inconnu, pourrait être impliqué
chez les patients PMDS n’ayant pas
de mutation de ces deux gènes.
* INSERM U493, École normale supérieure, 92120 Montrouge.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume II, n°4, août 1998
23
tostérone au lieu de l’œstradiol, en raison
de la répression de la synthèse d’aromatase
par l’AMH.
L’AMH, un membre de la famille
du TGF-ß
Contrairement à la testostérone, l’AMH
n’est pas un stéroïde mais une glycoprotéi-
ne qui a été purifiée. C’est un dimère formé
de deux sous-unités de 72 000 daltons liées
par des ponts disulfures. Son gène a été
cloné (1), il est autosomique et localisé à
l’extrémité du bras court du chromosome
19. L’AMH se rattache à une famille de
protéines dimères, dont le membre le plus
connu est un facteur de régulation de la
prolifération cellulaire, le “transforming
growth factor” TGF-ß. Appartiennent entre
autres à cette famille très nombreuse les
activines, inhibines, les “bone morphoge-
netic” protéines. Comme le TGF-ß,
l’AMH est activée par un clivage de la par-
tie C-terminale de sa molécule, qui est res-
ponsable de son activité biologique. Mais,
contrairement au TGF-ß, la partie C-termi-
nale reste associée à la partie N-terminale,
qui potentialise son activité biologique.
Les récepteurs des protéines
de la famille du TGF-ß
À la famille du TGF-ß correspond une nou-
velle famille de récepteurs membranaires,
dont les premiers clonés ont été les récep-
teurs du TGF-ß et de l’activine. Il s’agit de
récepteurs à un seul domaine transmembra-
naire, dont le domaine intracellulaire a une
activité sérine-thréonine kinase. Cette
famille est en réalité double, deux récep-
teurs membranaires différents s’associant
pour lier l’hormone et transmettre ou
“transduire” le signal (figure 2, page 24) :
– un récepteur primaire, dit récepteur de
type II, qui fixe le ligand et peut s’auto-
phosphoryler ;
– un récepteur secondaire, dit récepteur de
type I, qui seul est incapable de lier le
ligand, mais qui reconnaît le complexe
ligand-récepteur de type II, lequel peut
alors le phosphoryler au niveau de ses
sérines et thréonines dans un domaine par-
ticulier, proche de sa partie transmembra-
naire, appelé “domaine GS”, car il est riche
en glycines et sérines.
Le récepteur de type I est alors activé et
transduit le signal qui pourrait passer par la
voie des protéines SMAD (2). Il s’agit d’un
système complexe de différentes molécules,
dont certaines ne semblent pas spécifiques
d’un facteur de la famille du TGF-ß, alors
que d’autres paraissent être spécifiques
d’un seul ou plusieurs systèmes.
Les récepteurs de l’AMH
Pour le moment, seul le récepteur de type II
de l’AMH est connu. Son gène a d’abord
été cloné chez le lapin (3) et chez le rat (4),
puis chez l’homme (5) où il est localisé sur
un autosome, au début du bras court du
chromosome 12. Il est composé de onze
exons, dont trois codent pour le domaine
extracellulaire qui lie l’AMH et sept pour le
domaine intracellulaire sérine-thréonine
kinase.
Des expériences d’hybridation in situ ont
montré que le récepteur de type II de
l’AMH était exprimé comme attendu dans
son organe cible naturel, le tractus génital
du fœtus, ainsi que dans l’ovaire fœtal. Il a
été plus inattendu de le trouver exprimé
dans l’ovaire et dans le testicule adultes.
Le syndrome de persistance
des canaux de Müller (PMDS)
Le PMDS est un cas peu fréquent de pseudo-
hermaphrodisme masculin dont le signe
d’appel est généralement, chez des garçons
Cellule
de Leydig
Cellule
de Sertoli
Testostérone
DHT
Épididyme
Déférent
Vésicule séminale Utérus
Récepteur
aux androgènes Sinus urogénital
et organes génitaux
externes
Récepteur
AMH type II
AMH
Figure 1. Schéma des effets hormonaux impliqués dans la différenciation de l’appareil génital mâle.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume II, n°4, août 1998
24
Dossier
dont les organes génitaux externes sont nor-
malement masculinisés, une cryptorchidie
ou une hernie inguinale. L’exploration de
ces patients permet d’observer la persistan-
ce de dérivés müllériens, utérus et/ou
trompes, étroitement liés au testicule (6), ce
qui explique la cryptorchidie de ces patients,
à l’origine de l’appellation “homme à uté-
rus” parfois utilisée (figure 3). Le traite-
ment classique consiste en un abaissement
chirurgical des testicules dont, sans avoir
encore un recul suffisant, on peut penser
qu’il permettra de préserver la fertilité des
patients (6). La prévalence du PMDS en
France a été estimée à au moins un cas sur
100 000 naissances de garçons.
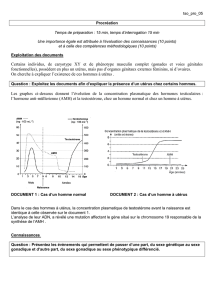
Une soixantaine de patients ont été explo-
rés (7). Le dosage de l’AMH sérique a per-
mis de constater une hétérogénéité du
PMDS, un même tableau clinique étant
retrouvé chez des patients dont l’AMH est
basse ou effondrée et chez des patients pré-
sentant un taux d’AMH normal voire supé-
rieur à la normale (figure 4). Chez les pre-
miers ont été principalement observées des
mutations du gène de l’hormone anti-mül-
lérienne (figure 5a), alors qu’une majorité
des patients présentant un taux élevé
d’AMH ont une mutation du gène du
récepteur de type II de l’AMH (figure 5b).
Ces mutations sont très diverses (7), muta-
tions ponctuelles, faux sens ou d’arrêt de la
traduction, mutations d’épissage de l’ARN
messager, microdélétions. Toutes les muta-
tions détectées jusqu’à présent sont réces-
sives. Il est à noter qu’il s’agit générale-
ment de mutations “privées” que l’on
retrouve rarement dans deux familles non
apparentées. Une seule mutation, une délé-
tion de 27 bases dans le 10eexon du gène
du récepteur de type II, est retrouvée fré-
quemment, à l’état homo- ou hétérozygote,
chez plus de la moitié des patients ayant
une mutation du récepteur de type II. Elle
provoque la synthèse d’une molécule de
récepteur tronquée de 9 acides aminés à
proximité immédiate de l’un de ses
domaines sérine-thréonine kinase.
L’étude génétique réalisée sur une soixan-
taine de cas a montré qu’environ 40 % des
patients PMDS avaient une mutation de
l’AMH et 40 % une mutation du récepteur.
Il subsiste donc environ 20 % des patients,
avec des taux d’AMH souvent à la limite
P P P
P
II II II
II
Liaison du TGF-ß Recrutement
du récepteur
de type I
Phosphorylation
du récepteur de type I
et activation
membrane
Transmission
du signal
domaine
GS
Figure 2. Mécanisme probable de transduction du signal par le TGF-ß, qui fait intervenir deux récepteurs
différents.
Trompe de Fallope Utérus
Col
Testicule
Épididyme
Canal
déférent
Figure 3. Anatomie des organes génitaux internes dans le syndrome de persistance des canaux de Müller.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume II, n°4, août 1998
25
de la normale, n’ayant aucune mutation
dans les deux gènes. Il pourrait s’agir de
mutations du gène du récepteur de type I,
encore inconnu dans le cas de l’AMH.
Le rôle des mutations des gènes de l’AMH
et de son récepteur a été vérifié grâce à des
lignées de souris transgéniques ayant une
inactivation (knock-out) de l’hormone ou
de son récepteur (8), obtenues par R.
Behringer. Ces knock-out aboutissent à des
situations très proches de celles observées
chez les patients PMDS.
Conclusion
Les facteurs impliqués ou susceptibles de
l’être dans la régression müllérienne com-
mencent à être mieux connus. À l’occa-
sion de l’étude de souris transgéniques
hyperexprimant l’AMH, la question a été
à nouveau posée d’éventuels effets extra-
müllériens de l’AMH. La présence de
récepteur à l’AMH de type II a été mise en
évidence dans l’ovaire adulte, qui produit
de l’AMH, et récemment sur les cellules
de Leydig du testicule (9) dans lequel
l’AMH paraît réguler négativement les
enzymes de la stéroïdogenèse. Le rôle
physiologique de l’AMH dans les interac-
tions entre cellules de Sertoli et de Leydig
reste à préciser. ■
Références
1. Cate R.L., Mattaliano R.J., Hession C. et
coll. Isolation of the bovine and human genes
for müllerian inhibiting substance and expres-
sion of the human gene in animal cells. Cell
1986 ; 45 : 685-98.
2. Massagué J., Hata A., Liu F. TGF-ß signa-
ling through the Smad pathway. Trends Cell
Biol 1997 ; 7 : 187-92.
3. di Clemente N., Wilson C.A., Faure E. et coll.
Cloning, expression and alternative splicing of
the receptor for anti-müllerian hormone. Mol
Endocrinol 1994 ; 8 : 1006-20.
120
100
80
60
40
20
002468101214161820
AMH (ng/ml)
Âge (années)
PMDS : gène muté
AMH
Récepteur de type II
Pas de mutation
a Gène de l'AMH
∆ 25-26
b Gène du récepteur de type II de l'AMH
R95 Stop
∆ 353-356 ∆ 1074-1087 R191 Stop E382 Stop
∆ 2277-2292
2632
(TGA)
0,5 kb
V477A C525Y
H506Q
( )
fragment C-terminal
portant l'activité biologique
R194C
Y167C
R123W
V12G
L70P
G101V
ATG ATT
1
∆ 27bp
7616
(TAA)
0,5 kb
R80 Stop
R97 Stop
G40 Stop
∆ 84-87
1
R54C G142V H282Q D426G R504C
D491H
V458A
( )
domaine extracellulaire
( )
domaine intracellulaire sérine-thréonine kinase
TM
MUTATIONS
Épissage
Faux sens
Délétion
Stop
Figure 4. Concentration d’AMH sérique chez les garçons PMDS, en relation avec la présence de mutations
des gènes de l’AMH et de son récepteur de type II. L’intervalle normal est représenté en clair (moyenne pour
l’âge ± 2 ds).
Figures 5a et 5b. Mutations des gènes de l’AMH et de son récepteur de type II détectées chez les patients
PMDS. Une seule mutation est détectée avec une fréquence élevée, elle est encadrée sur la figure, c’est une
délétion de 27 bases dans le dixième exon du gène du récepteur.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume II, n°4, août 1998
26
Dossier
4. Baarends W.M., van Helmond M.J.L., Post
M. et coll. A novel member of the transmem-
brane serine-threonine kinase receptor family
is specifically expressed in the gonads and in
mesenchymal cells adjacent to the müllerian
duct. Development 1994 ; 120 : 189-97.
5. Imbeaud S., Faure E., Lamarre I. et coll.
Insensitivity to anti-müllerian hormone due to a
spontaneous mutation in the human anti-mülle-
rian hormone receptor. Nature Genet 1995 ;
11 : 382-8.
6. Loeff D.S., Imbeaud S., Reyes H.M. et coll.
Surgical and genetic aspects of persistent müllerian
duct syndrome. J Ped Surg 1994 ; 29 : 61-5.
7. Imbeaud S., Belville C., Messika-Zeitoun L.
et coll. A 27 base-pair deletion of the anti-mül-
lerian type II receptor gene is the most common
cause of the persistent Müllerian duct syndro-
me. Hum Molec Genet 1996 ; 5 : 1269-79.
8. Mishina Y., Rey R. , Finegold M.J. et coll.
Genetic analysis of the müllerian-inhibiting
substance signal transduction pathway. Genes
and Develop 1996 ; 10 : 2577-87.
9. Racine C., Rey R., Forest M.G. et coll.
Receptors for anti-müllerian hormone on
Leydig cells are responsible for its effects on
steroidogenesis and cell differentiation. Proc
Natl Acad Sci USA 1998 ; 95 : 594-9.
AUTO-TEST
AUTO-TEST
Vrai ou faux ?
1. L’AMH est produite :
– par le testicule fœtal ;
– par le testicule adulte ;
– par l’ovaire fœtal ;
– par l’ovaire adulte.
2. Le récepteur de type II de l’AMH :
– a un seul domaine transmembranaire ;
– a une activité tyrosine kinase.
3. Le récepteur de type II de l’AMH est produit :
– par le testicule fœtal ;
– par le testicule adulte ;
– par l’ovaire fœtal ;
– par l’ovaire adulte.
4. Le syndrome de persistance des canaux de Müller est révélé :
– par une ambiguïté des organes génitaux externes ;
– par une cryptorchidie ou une hernie inguinale.
réponses page 55
1
/
5
100%