A l’aube d’une nouvelle ère de soins Oncologie

Après le congrès
de l’ASCO, quelles
sont les informations
significatives à retenir ?
Le principal “scoop” vient
d’un nouveau concept.
C’est en effet la première
fois qu’une molécule spé-
cialement dessinée permet
de bloquer un mécanisme
de progression du cancer. Le STI 571 agit comme
un inhibiteur sélectif de plusieurs tyrosines ki-
nases qui interviennent dans la transmission du si-
gnal de prolifération cellulaire. C’est une molé-
cule de synthèse chimique, issue de la recherche
en biotechnologie. Elle produit des réponses cli-
niques extrêmement favorables chez les patients
atteints de sarcome stromal du tube digestif, peu
sensible à la chimiothérapie, et surtout chez ceux
atteints de leucémie myéloïde chronique. Les au-
teurs ont montré des images impressionnantes de
régression tumorale rapide, attestée par l’image-
rie conventionnelle et par PET scan. Ce sont
certes des cancers rares, mais c’est une piste in-
novante. Il ne s’agit plus de détruire ces tumeurs
de façon frontale, avec les risques que l’on connaît
de dégâts collatéraux, mais de faire agir un anta-
goniste dont la cible est un mécanisme identifié.
Les autres informations essentielles de l’ASCO
ont porté sur l’utilisation de la chimiothérapie
avant l’ablation de la vessie dans les tumeurs at-
teignant cet organe, cette méthode améliorant si-
gnificativement la survie, et sur des combinai-
sons chimiothérapie/radiothérapie dans les
cancers du larynx qui permettent une préserva-
tion du larynx et donc de la phonation.
Il y a également eu une sensibilisation appuyée
aux nouvelles exigences des patients qui reven-
diquent notamment, aux États-Unis, au travers
de puissantes associations, le droit à la qualité
de vie. Jusqu’à ces dernières années, la priorité
était de guérir à tout prix. D’autres valeurs pren-
nent le pas. La voie d’avenir s’affirme dans l’adap-
tation des traitements, en tenant compte du pro-
fil de l’individu. On peut envisager des tests
biologiques, une cartographie des tumeurs par
individu, etc.
L’esprit est de donner ses chances à un malade,
chaque fois qu’on le peut, mais en s’adaptant si
possible à la chimiosensibilité de chacun.
Ces dernières années, quels sont les progrès
et les déceptions ?
Les progrès sont réels, notamment dans les can-
cers du sein, ceux du tube digestif, et l’on soigne
des tumeurs déjà métastasées. L’éventail théra-
peutique s’est élargi avec l’apparition de traite-
ments efficaces en cas de récidive. Dans
Sommaire
• Épidémiologie :
des inégalités
selon le sexe
et la géographie
• Cancer du sein :
les traitements
hormonaux
• Radiothérapie :
inédits bienfaits
• Cancer
de la prostate :
informer et choisir
le traitement
• Cancer bronchique :
je “tabac-stoppe” !
• Besoins des patients :
recommandations
et ergonomie des soins
• Fatigue :
une véritable
souffrance
• Hadronthérapie :
le premier centre
àLyon
Oncologie
A l’aube d’une nouvelle
ère de soins
Le congrès ASCO (American Society of Clinical Oncology)
qui s’est tenu à San Fransisco, est le rendez-vous mondial
des cancérologues. Cette année, pas de nouveautés majeures.
Si ce n'est une évolution vers des axes thérapeutiques
originaux. Ainsi, on peut citer les médicaments cytotoxiques,
des médicaments qui modifient le comportement biologique
de la cellule tumorale ou qui agissent sur le tissu normal.
Ils s’attaquent aux mécanismes déclenchants du cancer.
Questions au Pr Jean-François Morère,
de l’hôpital Avicenne de Bobigny (93).
●●●
*DOSSIER PSII 27-28 19/12/01 16:38 Page 19

le cancer du sein, l’hormonothérapie est
mieux tolérée, rendant le traitement moins
toxique, la chirurgie est moins mutilante et la ra-
diothérapie est encore mieux maîtrisée avec la
mise au point de l’irradiation conformationnelle.
Certes, les thérapies géniques déçoivent par rap-
port à l’enthousiasme généré au début, l’immu-
nothérapie s’essouffle pour des raisons essentiel-
lement techniques. Si la prise en charge, en
France, est, selon certains critères, diversement
satisfaisante, elle s’adapte davantage à une pré-
servation de la qualité de vie du patient.
Ce souci de qualité de vie s’exprime
pourtant depuis quelques années ?
Certes, mais davantage aux États-Unis qu’en
France. Par exemple, la banalisation du mot can-
cer est beaucoup plus difficile pour nos menta-
lités latines. Or, pour les patients américains,
plus le cancer sera considéré comme une mala-
die pareille à une autre, moins le patient se sen-
tira exclu de la société dans laquelle il vit. C’est
une composante essentielle de la qualité de vie.
Interviennent aussi les traitements et leurs effets
indésirables. Grâce à une meilleure connaissance
des mécanismes de la maladie, aux nouvelles
technologies, aux nouvelles molécules plus affi-
nées, il y a moins de traumatismes liés aux soins.
Cela concourt à une meilleure réponse de l’or-
ganisme du patient face au cancer. D’autres va-
leurs se sont insérées dans notre façon de soigner.
On ira de moins en moins vers un acharnement
de chimiothérapie et l’on développera des soins
palliatifs de qualité dans les phases de maladies
réfractaires.
Quand on parle de qualité de vie,
il s’agit de qualité des soins
mais aussi de qualité du relationnel ?
Un changement de mentalité s’exerce au niveau
de la qualité des informations données au pa-
tient. Un rendez-vous comme l’ASCO nous sen-
sibilise à la communication. Il faut que les soi-
gnants apprennent à communiquer. Il ne s’agit
pas d’asséner une information ou de rester vague.
Il faut écouter, et saisir le moment propice pour
expliquer, avoir l’intuition d’une question for-
mulée parfois maladroitement. Il faut aussi éva-
luer le degré de demande, discuter avec l’équipe
soignante pour rester cohérent. Il ne s’agit pas
de se réfugier derrière son ressenti émotionnel
et de fuir. Cette attitude engendre une angoisse
parfois intolérable pour le patient. Toute vérité
peut être appréhendée. Il ne faut pas oublier que
l’acte de communiquer est aussi un des fonde-
ments de la médecine.
Pour l’infirmière, communiquer n’est pas
toujours facile. Elle est en première ligne,
et les questions les plus embarrassantes
lui sont en général réservées.
Il est vrai que l’infirmière est confrontée à des res-
ponsabilités très lourdes sur le terrain alors que
en théorie, ces responsabilités ne lui sont pas re-
connues, voire lui sont refusées. D’où une cer-
taine réticence, une crainte du “jusqu’où ne pas
aller trop loin ?” dans le dialogue et de sortir de
son devoir de réserve. Dans l’idéal, il faudrait que
les réunions avec tous les personnels soignants
concernés soient fréquentes, au moins pour les
cas médicaux épineux afin d’expliquer et de par-
tager le projet de soin. Il faut aussi parler des ma-
lades présentant des difficultés psychologiques
ou émotionnelles. On ne sait pas encore si le
mental peut être à l’origine de cancers, on sait en
revanche parfaitement que le mental agit pour
que le malade puisse avoir envie de se battre et
accepte ses traitements. Les soignants ne doivent
pas seulement se focaliser sur des soins tech-
niques mais aussi encourager, soutenir, expliquer
sereinement. La personne malade n’est pas seule
à se battre, il faut lui faire comprendre qu’il y a
toute une équipe derrière elle, qui fonde des es-
poirs dans un projet thérapeutique.
Est-ce aussi simple dans la réalité ?
Ce n’est pas simple parce que, souvent, le temps
manque. Or, c’est un facteur important. Mais
l’idéal est d’être formé à la communication. Car
même si la relation soignant/soigné n’est jamais
dénuée d’émotions, elle doit se faire sur des bases
techniques qui s’apprennent. Connaître une ré-
ponse appropriée ne peut s’improviser et cette ré-
ponse est d’autant mieux adaptée que le soignant
a côtoyé, au cours de sa formation, une situation
à peu près semblable. Les infirmières devraient
Oncologie
●●●
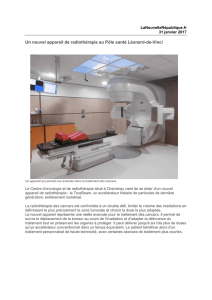
©V.Burger/Phanie
*DOSSIER PSII 27-28 19/12/01 16:38 Page 20

exiger ce type de formation, car l’intuition seule
ne suffit pas, même dans une relation très proche
avec un malade. Ne serait-ce que pour maîtriser
leur propre charge émotionnelle et éviter les
“burn-out”.
Les patients ont évolué ; ils font reconnaître
leurs droits et se plaignent de la façon
dont ils sont traités à l’hôpital...
Ils ont hélas parfois raison. Quand on parle de
patient client, le mot client n’est pas du tout pé-
joratif et devrait tous nous interpeller. On res-
pecte un client, on l’informe, on lui reconnaît le
droit de poser des questions. On doit être à son
service. Ce qui ne veut pas dire faire tout ce qu’il
désire et accepter en retour le non-respect. C’est
se dire au contraire que, si le client fait appel à
nous, c’est qu’il a besoin de conseils éclairés et
qu’il va faire confiance à nos compétences. Cette
relation de confiance ne peut donc s’établir que
par la communication. Chacun y trouve sa
propre satisfaction. Pour l’un, celle d’avoir soigné
le mieux possible et, pour l’autre, celle d’avoir été
bien soigné.
Ce n’est pas toujours facile, car il y a des manques
évidents. Notamment un personnel insuffisant.
Les personnes atteintes de maladies graves ont
besoin d’être accueillies, et sont angoissées de
suivre un cursus compliqué, avec un personnel
toujours débordé. Idéalement, la prise en charge
doit reposer sur une organisation qui tient
compte du respect des moments d’attente, du
temps nécessaire pour parler et envisager avec
le malade des projets thérapeutiques. Il y a
d’ailleurs une réflexion, dans les organismes de
tutelle, sur l’uniformisation des informations
dans les dossiers, uniformisation qui est loin
d’exister aujourd’hui. Rendre cohérent l’accès
aux informations médicales devient urgent et fe-
rait gagner en efficacité.
Toujours à propos de la qualité de vie,
une enquête signale encore
que 30 % des patients se plaignent
de douleur et de fatigue
Cette enquête revient souvent, mais elle est diver-
sement commentée selon qu’elle l’est par le soi-
gnant ou par le malade. La douleur comme la fa-
tigue étant des symptômes subjectifs, il n’est pas
toujours facile de les appréhender. L’existence des
centres antidouleurs permet de diriger les malades
vers des spécialistes qui instaurent un dialogue
très positif dans le soulagement de la douleur.
La fatigue est, il est vrai, moins bien prise en
compte. Certaines équipes infirmières expli-
quent les “trucs” pour gérer cette fatigue et ils suf-
fisent parfois à la soulager. Toutefois, la fatigue
est multifactorielle : il y a la maladie, les traite-
ments, mais aussi l’anémie. Et les traitements
contre la fatigue, comme ceux contre la douleur,
ont des contre-indications chez certains malades.
Il y a aujourd’hui une réelle prise de conscience,
toujours pour préserver la qualité de vie. Il y
aura bientôt des produits moins contraignants,
car il ne s’agit pas de remplacer une contrainte
par une autre.
Quelles sont les principales motivations
pour venir travailler
dans un service d’oncologie ?
L’ oncologie est un univers passionnant. En peu
de temps, on est passé d’une impuissance quasi
totale, d’une résignation, à des objectifs de sur-
vie, à des espoirs de guérison. Ce passage au
XXIesiècle est, d’une certaine façon, symbolique.
Au siècle dernier, hier, on identifiait les méca-
nismes et, grâce à la pharmacologie et la radio-
thérapie, on a vécu des progrès très significatifs.
Ce premier congrès ASCO, du nouveau siècle,
nous donne des perspectives de soins dont nous
ne saisissons encore que certains axes. Nous avons
l’espoir d’avoir des réponses adaptées individua-
lisées. Nous savions que l’on ne soignait pas “un”
mais “des” cancers. Demain, on soignera un can-
cer chez un individu qui a ses propres caractéris-
tiques biologiques, lesquelles participeront même
à l’élaboration des traitements. Nous sommes
seulement au début d’une réflexion réaliste et de
solutions pleines d’avenir. N’est-ce pas un élément
de motivation important pour un soignant ?
Propos recueillis par
Andrée-Lucie Pissondes
Les mécanismes du cancer
On sait identifier les mécanismes du cancer. Ils sont
trois, essentiels : l’immortalité, c’est-à-dire la capa-
cité indéfinie de prolifération, l’autonomisation de
la division cellulaire et l’infiltration-migration.
Une cellule normale peut, si on lui fournit les élé-
ments dont elle a besoin, se multiplier indéfiniment,
mais le nombre possible de divisions étant limité, elle
perd ses capacités de prolifération et meurt. Une
cellule cancéreuse ne reconnaît plus ces limites et
s’immortalise par une activité de télomérase.
Parfois, les molécules chargées de stimuler ou d’in-
hiber la prolifération cellulaire sont absentes ou peu
fonctionnelles et donnent naissance à des tumeurs.
Quand il n’y a plus de communications entre elles,
des cellules saines deviennent des cellules trans-
formées, responsables de l’oncogenèse.
*DOSSIER PSII 27-28 19/12/01 16:39 Page 21

Avec près de 148 000 décès par an, les can-
cers sont la deuxième cause de mortalité en
France, après les maladies cardio-vasculaires. Ils
représentent 28 % des décès.
Les hommes plus que les femmes
Depuis 1989, les cancers sont la première cause
de mortalité chez les hommes en France, une
mortalité qui est de 1,6 fois supérieure à celle des
femmes. Les tumeurs qui touchent davantage les
hommes atteignent en majorité la cavité buccale,
le pharynx, la trachée, les bronches et les pou-
mons, l’œsophage, l’estomac, l’intestin et autres
parties de l’appareil digestif, et le péritoine. En
fait, les hommes et les femmes ne sont égaux que
devant les leucémies.
Chez l’homme, les décès sont dus aux cancers du
poumon (23 %), des voies aérodigestives supé-
rieures (12 %), de la prostate (11 %), ainsi qu’aux
cancers colo-rectaux (10 %).
Chez la femme, les décès sont dus aux cancers
du sein (19 %), aux cancers colo-rectaux (13 %),
du poumon (6 %), de l’ovaire (6 %), du pancréas
(5 %), de l’estomac (4 %), aux leucémies (4 %),
aux cancers des voies aérodigestives supérieures
(2 %) et de la vessie (2 %).
Disparités régionales
Chez l’homme, les taux comparatifs vont d’une
mortalité inférieure de 16 % à la moyenne, en
Midi-Pyrénées, à une surmortalité de + 26 %
dans le Nord-Pas-de-Calais. Quatre autres régions
présentent une mortalité supérieure de 10 % à la
moyenne nationale. Ce sont la Lorraine (+ 16 %),
la Haute-Normandie (+ 14 %), la Picardie et la Bre-
tagne (+ 13 %). Chez la femme, ces taux compa-
ratifs, allant de – 12 % à + 14 %, varient de façon
plus modérée. Deux régions présentent une mor-
talité inférieure de plus de 10 % à la moyenne
Midi-Pyrénées et Limousin (– 12 %). Le Nord-Pas-
de-Calais, comme pour l’homme, demeure une ré-
gion particulièrement touchée. C’est la seule région
dont la surmortalité est supérieure de plus de 10 %
à la moyenne nationale (+ 14 %). Sa surmortalité
prématurée dépasse de + 19 % la moyenne.
Les facteurs de risque
Le tabagisme reste la cause principale de surve-
nue du cancer du poumon. L’interaction entre al-
cool et tabac multiplie les risques (voir article, “Je
tabac-stoppe”, page 28).
Les comportements alimentaires pourraient fa-
voriser la survenue d’un tiers des cancers, par
une consommation élevée en graisses ou insuffi-
sante en fibres.
Les rayons ultraviolets sont responsables de l’ap-
parition de tumeurs cutanées.
Les expositions professionnelles expliqueraient
4% des cancers. Elles impliquent le rôle de
l’amiante pour les mésothéliomes pleuraux, de
l’arsenic pour les cancers primitifs du foie ou les
cancers de la peau, des goudrons pour le cancer
de la vessie et de la peau, du bois et du nickel
pour les cancers de l’ethmoïde et de sinus de la
face, des amines aromatiques pour les cancers de
la vessie, du benzène et de l’oxyde d’éthylène
pour les leucémies et lymphomes, etc.
Marc Blin
Oncologie
Selon que l’on est une femme ou un homme, selon que l’on vit dans telle
ou telle région française, les taux de mortalité à la suite d’un cancer sont différents.
Épidémiologie
Des inégalités selon le sexe
et la géographie
Quelle est la place du mental chez un patient cancéreux ?
Pour le déclenchement de la maladie, les avis sont partagés, et on ne peut déterminer aujourd’hui si le mental
agit sur le déclenchement d’un cancer ou si c’est le cancer qui avait déjà atteint le mental. Quand on écoute cer-
tains patients, ceux-ci signalent un élément douloureux concomitant au début de la maladie. Ce qui est évident,
c’est qu’une personne qui conserve son dynamisme, qui fait front, a de meilleurs résultats quant à l’évolution de
son cancer, grâce aussi à une meilleure acceptation de son traitement, et présente donc une diminution des
effets secondaires.
*DOSSIER PSII 27-28 19/12/01 16:39 Page 22

Tant en phase adjuvante qu’en phase métasta-
tique, les caractéristiques biologiques et évolu-
tives de la femme âgée conduisent à considérer l’ap-
proche hormonale comme la plus logique. «Son
intérêt et ses limites, en phase néoadjuvante, sont ac-
tuellement bien documentés, précise le Dr Laurent
Mignot, cancérologue du service de médecine in-
terne, de l’hôpital Foch, à Suresnes (1). Il n’y a pas
de place, pour l’instant, pour des traitements préventifs
par le tamoxifène en dehors d’essais thérapeutiques qui,
d’ailleurs, n’incluent pas de femmes de plus de 70 ans. »
Traitements hormonaux en phase adjuvante
Après la ménopause, le traitement médical de ré-
férence en phase adjuvante, c’est-à-dire après le
traitement principal, est le tamoxifène. «Les nou-
veaux anti-estrogènes, les anti-aromatases ou les pro-
gestatifs pourraient être utilisés en cas d’intolérance ou
s’ils faisaient la preuve d’une meilleure efficacité »,
souligne le Dr Mignot. La présentation de la qua-
trième méta-analyse apporte la confirmation de
données déjà publiées. La pertinence de cette syn-
thèse sur l’emploi du tamoxifène en situation ad-
juvante repose sur l’étude de 36 689 femmes, in-
cluses dans 55 essais prospectifs. Cette quatrième
méta-analyse fait apparaître trois points-clés :
–les bénéfices du tamoxifène adjuvant ne dé-
pendent pas de l’âge «même si une tendance est
notée d’une amélioration de survie chez les patientes
les plus âgées » ;
–concernant les récepteurs hormonaux, les pa-
tientes RE+ tirent un bénéfice, aussi bien en
termes de survie sans récidive que de survie glo-
bale. Les bénéfices sont faibles, voire nuls, chez
les patientes RE– ;
–les bénéfices sont identiques chez les patientes
N+ et N–, c’est-à-dire ayant une atteinte gan-
glionnaire ou non.
Le tamoxifène améliore le taux de survie sans ré-
cidive pendant les cinq premières années, puis le
taux de survie global. Le taux de réduction du
risque de rechute est dépendant de la durée du
traitement, puisqu’il passe de 13 % pour un an
à 47 % pour 5 ans.
Le risque relatif de survenue d’un cancer de l’en-
domètre est multiplié par 2,5 chez les femmes trai-
tées, et il croît avec la durée du traitement. «Les
cancers du sein survenant chez des femmes ménopau-
sées recevant un traitement hormonal substitutif (THS)
sont généralement moins agressifs que ceux survenant
chez les femmes sans THS », précise le Dr Mignot.
Le tamoxifène permet dans deux tiers des cas de
réduire le volume tumoral, quand il est donné en
situation néoadjuvante. «Cette approche cytoréduc-
trice représente une alternative intéressante chez cer-
taines patientes inopérables présentant des pathologies
associées et rendant difficile toute autre approche,
poursuit-il. Il s’agit d’une attitude palliative qui peut
toujours être considérée. Dans tous les autres cas, il
faudra utiliser l’irradiation complémentaire, ou la chi-
rurgie suivie d’irradiation, pour obtenir le contrôle lo-
corégional de la maladie. » En effet, le risque de ré-
cidive locale est très élevé (supérieur à 70 %) si l’on
se contente du tamoxifène seul.
Les traitements hormonaux
en phase métastatique
Le cancer du sein métastatique reste incurable.
«La survie moyenne est d’environ deux ans après le
diagnostic, précise-t-il. Certaines patientes peuvent
avoir une survie beaucoup plus longue, étendue par-
fois sur 10 ans. »
L’ apport de la radiothérapie ne doit pas être né-
gligé en cas de récidive cutanée, de métastases
osseuses et cérébrales. «Cependant, même chez la
femme âgée, le traitement médical, notamment hor-
monal, est une opportunité en cas de métastases mul-
tiples et viscérales. »
Les essais thérapeutiques comme évidence cli-
nique ont montré que les réponses objectives au
traitement sont positivement corrélées :
–au taux de positivité des récepteurs hormonaux ;
–à la durée de l’intervalle libre entre la tumeur mi-
trale et l’apparition de récidive ou de métastase ;
–au grade histologique de la tumeur ;
–au site tumoral de la récidive.
Les essais et le travail cliniques ont aussi montré
que les réponses ont une durée limitée. Mais les
chances de bénéfice d’une hormonothérapie de
seconde ligne sont meilleures si :
–la première ligne d’hormonothérapie a eu une
durée de réponse longue ;
Des tumeurs comme celles observées dans le cancer du sein sont
hormonodépendantes. L’hormonothérapie se fonde sur l’influence
qu’exercent sur leur croissance les hormones stéroïdes et sexuelles.
Cancer du sein
Les traitements hormonaux
●●●
*DOSSIER PSII 27-28 19/12/01 16:39 Page 23
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%