Cours francophone supérieur sur le cancer du sein Saint-Paul-de-Vence, janvier 2007 C

La Lettre du Sénologue - n° 36 - avril-mai-juin 2007
Congrès
Congrès
31
ÉVALUATION ET PRISE EN CHARGE DU RISQUE
DE DÉVELOPPER UN CANCER DU SEIN
Étude de l’activité physique
sur le risque de cancer du sein
F. Clavel-Chapelon a rapporté les résultats de l’enquête E3N
(étude épidémiologique portant sur 100 000 femmes affiliées à
la MGEN) concernant le bénéfice de l’activité physique sur le
risque de cancer du sein. Les informations ont été recueillies
par autoquestionnaires envoyés tous les 24 mois entre 1990 et
2002 à des femmes nées entre 1925 et 1950.
Au cours de l’étude, 3 424 cas de cancer du sein ont été obser-
vés. Il est confirmé que le risque de cancer diminue d’autant
plus que le nombre d’heures d’activité est élevé, l’intensité de
cette activité a également un impact important.
Pour une activité de loisir à intensité modérée, le risque dimi-
nue de 13 % par rapport aux femmes sédentaires. Pour celles
déclarant 5 heures hebdomadaires d’activité soutenue, la di-
minution du risque est de 38 %.
Par ailleurs, cette étude révèle que cette baisse de risque est
présente même dans les sous-groupes considérés comme à
risque : femmes en surpoids, utilisation d’un THS et celles
ayant un antécédent familial de cancer du sein.
Risque et nutrition
Le cancer du sein est actuellement une des pathologies dont
les facteurs de risque nutritionnels commencent à être mieux
identifiés. Cela permet la mise en place d’actions de préven-
tion primaire, mais également secondaire pendant le suivi
post-thérapeutique.
La consommation d’alcool augmente l’incidence du cancer
du sein. Dans l’étude EPIC, une prise de poids de 15 à 20 kg
par rapport à l’âge de 20 ans entraîne un risque relatif de 1,5.
Concernant la consommation de lipides, une étude randomi-
sée récente montre qu’un régime consistant à limiter à 20 %
l’apport énergétique journalier sous forme de graisses, après
8 ans de suivi, réduit de près de 9 % l’incidence du cancer du
sein. La consommation de fruits et légumes n’a pas d’influence
sur ce risque.
Les recommandations de l’INCa sont : alimentation diversi-
fiée, limitation de la consommation d’alcool à moins de deux
verres de vin par jour, réduction des apports en graisse à moins
de 35 % des apports énergétiques journaliers.
Il est important de limiter au maximum la prise de poids après
la ménopause. Ces conseils peuvent être proposés en post-
thérapeutiques, car ils permettent de diminuer le risque de
récidive.
Risque histologique
Les lésions histologiques dites “à risque” répondent aux lé-
sions bénignes dont le risque de développer ultérieurement
Cours francophone supérieur sur le cancer du sein
Saint-Paul-de-Vence, janvier 2007
IP F. Izar*
* Institut Claudius-Regaud, Toulouse.

La Lettre du Sénologue - n° 36 - avril-mai-juin 2007
Congrès
Congrès
32
un cancer du sein est élevé par rapport au risque de la popula-
tion générale. Ce sont les travaux de Dupont et Page, publiés
dans les années 1980, qui ont permis de bien préciser ce risque
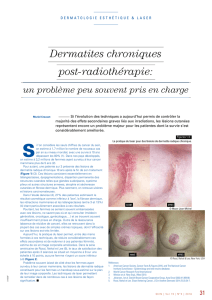
histologique. Une tumeur maligne ne naît pas ex nihilo, mais
se développe progressivement en passant par différents stades
jusqu’à celui de carcinome infiltrant (figure).
Ces lésions à risque s’intègrent dans le cadre de la mastopathie
fibrokystique.
Néoplasies lobulaires
On distingue l’hyperplasie atypique ou LIN1 et le carcinome
in situ ou LIN2. Plus récemment, a été identifié le carcinome
lobulaire pléomorphe ou avec nécrose, appelé LIN3. Cette
lésion plus rare est plus agressive et s’accompagne dans 20 à
40 % des cas de foyers infiltrants. Beaucoup d’équipes la traite
comme un carcinome intracanalaire.
L’hyperplasie canalaire atypique
Cette lésion comporte plus de 10 couches de cellules tapissant
la paroi, il s’y associe des atypies cytologiques et architectu-
rales.
Les lésions cylindriques
Elles sont d’individualisation récente et se caractérisent par
l’aspect cytologique constitué de cellules cylindriques hautes,
à noyau ovalaire situé au pôle basal. Une nouvelle catégorie a
été créée dans ce groupe correspondant à l’atypie plane. Ce
terme regroupe deux lésions, d’une part, la métaplasie cylin-
drique avec irrégularité nucléaire et, d’autre part, les images
autrefois classées comme clinging carcinoma.
À ce jour, il n’existe aucune donnée sur le niveau de risque
associé à cette lésion.
Il est évident que l’identification de ces différentes lésions re-
quiert une technique histologique parfaite et l’application la
plus stricte des critères diagnostiques, ceci afin de réduire au
mieux les problèmes de reproductibilité.
Par ailleurs, la détermination du niveau de risque demande
des études épidémiologiques avec un long suivi (10 à 20 ans).
Dans ces études, le diagnostic histologique était le plus sou-
vent fait sur des pièces opératoires.
Actuellement, les biopsies guidées par l’imagerie se sont
considérablement développées pour les lésions non palpables.
Cette technique soulève différents problèmes pour les lésions
à risque, car leur définition repose sur l’examen de l’ensemble
de l’anomalie ce qui n’est pas le cas pour des biopsies.
En ce qui concerne le niveau de risque de ces différentes lé-
sions, la référence actuelle est présentée dans le tableau.
Évaluation radiologique d’une personne
à risque de développer un cancer du sein
Femmes porteuses d’une mutation BRCA identiée
Dans ce groupe, le risque cumulé de cancer avant 70 ans est de
65 % pour les BRCA1 et 45 % pour les BRCA2. Dans 40 à 60 %
des cas, le diagnostic est fait sous la forme d’un cancer d’inter-
valle. Cela pourrait être dû à une densité mammaire élevée,
une apparence bénigne trompeuse des lésions, une croissance
rapide de ce type de tumeur.
Actuellement les recommandations pour le suivi sont :
– un examen clinique tous les 6 mois à partir de 20 ans ;
– une mammographie annuelle à partir de 30 ans. La mam-
mographie numérique permet une meilleure définition et une
moindre exposition au rayon X. Deux incidences doivent être
réalisées et une double lecture est souhaitable ;
– une échographie proposée systématiquement en cas de
seins denses, d’anomalie mammographique ou clinique. Nous
rappellerons son intérêt en “second look” après IRM ;
– une IRM recommandée en complément et non en rempla-
cement de la mammographie. Cet examen est d’une grande
sensibilité mais il faut en souligner les inconvénients : taux de
rappel moyen de 10 %, taux de faux positif significatif.
Femmes avec lésions histologiques
dont le risque est supérieur à deux
Le suivi doit comporter une mammographie et une échogra-
phie annuelle. L’IRM n’est pas une indication pour le dépis-
tage. Ces femmes sont exclues du dépistage organisé.
Absence de risque Risque faible (x
1,5 à x 2)
Risque modéré (x
4 à x 5)
Risque élevé
(x 8 à x 10)
– Adénose
– Ectasie canalaire
– Fibroadénome
simple
–Fibrose
– Mastite
– Hyperplasie
épithéliale faible
sans atypie
– Kystes simples
– Métaplasie
apocrine simple
– Métaplasie
épidermoïde
– Fibroadénome
complexe
– Hyperplasie épi-
théliale modérée
ou oride sans
atypie
– Fibro-adénose
– Cystadénome
papillaire simple
sans atypie as-
sociée
– Hyperplasie
épithéliale canalaire
avec atypie
– Hyperplasie
épithéliale lobulaire
avec atypie
– Carcinome
canalaire in
situ
– Carcinome
lobulaire in
situ
Sein normal
hyperplasie épithéliale oride
atypie plane
hyperplasie atypique
carcinome in situ
carcinome inltrant
Figure.
Diérents stades d’une tumeur maligne.
Tableau.
Niveau de risque des diérentes lésions.

La Lettre du Sénologue - n° 36 - avril-mai-juin 2007
Congrès
Congrès
33
Risque augmenté et THS
Anne Lesur a fait le point sur les données récentes concernant
les deux études qui ont remis en cause le bénéfice-risque du
THS.
Étude de la WHI
Dans l’étude estrogènes plus progestérone versus placebo, les
données récentes montrent que seules les femmes traitées
avant l’entrée dans l’essai, soit 26 %, ont un surrisque de cancer
du sein. Celles non traitées et totalisant 5 ans de traitement
ont un risque relatif de 1,06 non significatif.
Dans le bras estrogènes seuls (femmes hystérectomisées), la
réactualisation montre toujours l’absence de surrisque après
7 ans de prise.
En ce qui concerne l’impact sur le risque de coronaropathie,
l’analyse récente par sous-groupes de tranches d’âge permet
de mettre en évidence un effet protecteur chez les femmes de
50-60 ans.
La MWS
Cette étude a rapporté une augmentation du risque relatif de
cancer du sein quel que soit le traitement prescrit, mais aucun
ne contenait de progestérone naturelle. À la suite de ces pu-
blications, les prescriptions de THS ont chuté aussi bien aux
États-Unis qu’en Europe (chute de 30 % en France).
Publications récentes françaises
Dans l’étude des femmes affiliées à la MGEN, 54 % d’entre elles
utilisaient un THS avec une durée moyenne de 2,8 ans. Le ris-
que relatif est de 1,2 avec les estrogènes seuls ; l’augmentation
n’est pas significative.
Au vu des dernières données, il est important de respecter
les contre-indications et les limites d’emploi du THS, la ba-
lance bénéfice-risque est favorable chez les femmes de la
cinquantaine, indemnes de pathologies mammaires, ayant
un syndrome climatérique et/ou un risque d’ostéoporose.
L’augmentation du risque de cancer du sein est faible dans
ce contexte notamment pour des durées d’utilisation infé-
rieures à 10 ans.
ÉLÉMENTS NOUVEAUX CONCERNANT
LE DIAGNOSTIC
Quand se méer des micro- et macrobiopsies guidées
L’amélioration des techniques de prélèvements ne doit pas
faire oublier le risque de sous-estimation et celui de faux
négatifs. Ainsi, pour les systèmes par aspiration avec aiguille
de calibre 11 G, le taux de sous-estimation est de l’ordre
de 20 % pour les hyperplasies canalaires atypiques, 10 %
pour les canalaires in situ. Ces taux sont moindres lorsque
la taille lésionnelle est inférieure à 10 mm. Ils dépendent
également des signes radiologiques, majorés dans le cas de
foyer de microcalcifications. Le taux de faux négatif reste
faible, inférieur à 2 % pour les macrobiopsies. Ils sont es-
sentiellement liés à des problèmes de balistique.
En pratique, les recommandations actuelles sont d’opérer
toutes les hyperplasies canalaires atypiques. Concernant les
néoplasies lobulaires in situ, les recommandations ne sont pas
homogènes ; il faut rappeler que les LIN3 sont des lésions plus
agressives et souvent associées à un cancer invasif.
Place de l’IRM dans le diagnostic des cancers du sein
Le but de l’IRM est la détection de lésions surnuméraires qui
modifieraient la prise en charge chirurgicale. C’est l’examen
le plus sensible dans la détection de la multifocalité et multi-
centricité, détectant en moyenne 15 % de lésions surnumé-
raires, en particulier dans le cas de seins denses. Le problème
de l’IRM est celui d’un taux non négligeable de faux positif,
d’où la nécessité d’un diagnostic histologique avant de vali-
der l’indication de mastectomie.
Elle semble intéressante dans le cancer lobulaire pour lequel
la tumeur est souvent mal évaluée par l’imagerie standard,
dans le bilan d’une maladie de Paget du mamelon avec mam-
mographie normale.
Chez les patientes présentant des adénopathies axillaires
métastatiques avec un bilan mammo-échographie normal,
l’IRM permet de détecter un cancer du sein dans environ
70 % des cas.
En cas de chimiothérapie néoadjuvante, l’IRM est l’examen le
plus performant pour évaluer la maladie résiduelle et adap-
ter au mieux le geste chirurgical.
Dans le cas d’une suspicion de récidive locale après chirurgie
conservatrice, la sensibilité et spécificité de l’IRM sont éle-
vées (> à 90 % ) et ses résultats optimaux à un an minimum de
la fin du traitement. La meilleure indication de l’IRM est la
différenciation entre des séquelles fibreuses bénignes et une
récidive dans le site initial.
LE TRAITEMENT LOCORÉGIONAL
La technique du ganglion sentinelle
Elle s’adresse aux tumeurs N0, unifocales, classiquement de
taille ≤ à 2 cm (mesure échographique). Le taux de détection
varie entre 90 et 95 %, le taux de faux négatif se situe entre 5
et 10 %.
La technique a été étendue à d’autres situations dans le cadre
d’essais thérapeutiques :
– tumeur supérieure à 2 cm ;
– cancers intracanalaires étendus où il existe un risque de lé-
sions micro-infiltrantes ;
– cancers multifocaux ;
– avant ou après chimiothérapie néoadjuvante.
Ces extensions d’indication sont le fait soit d’équipes expéri-
mentées dans la technique du ganglion sentinelle (GS), soit
font l’objet d’essais thérapeutiques.
Les résultats de l’essai randomisé Almanac comparant GS ver-
sus curage axillaire viennent d’être publiés et montrent une

La Lettre du Sénologue - n° 36 - avril-mai-juin 2007
Congrès
Congrès
34
diminution de la morbidité (lymphœdème et dysesthésies) et
une amélioration de la qualité de vie.
L’analyse histologique du ou des GS n’est pas celle des gan-
glions axillaires dans un curage classique. L’étude en coupes
sériées et les techniques immuno-histochimiques ont majoré
le taux de positivité ganglionnaire. L’impact pronostique des
cellules isolées, c’est-à-dire mises en évidence uniquement
en immunohistochimie et de taille inférieure à 0,2 mm, reste
controversé.
Dans l’état actuel des connaissances, la recommandation en
cas de positivité du GS, quelle que soit sa nature, est de réaliser
un curage classique complémentaire.
Des essais thérapeutiques sont en cours dans le cadre d’enva-
hissement lymphatique minime comparant la reprise chirur-
gicale, l’abstention chirurgicale et l’irradiation axillaire.
Les limites du traitement conservateur
Initialement réservé aux petites tumeurs (< à 3 cm), à distance
de l’aréole, le traitement conservateur (TC) voit ses indica-
tions s’étendre avec, en France, un taux de conservation com-
pris entre 70 et 75 %.
Pour K. Clough, les indications peuvent être étendues aux tu-
meurs comprises entre 3 et 5 cm si une chirurgie en berges
saines est réalisable sans déformation majeure du sein. Cela
impose le recours à des techniques de chirurgie plastique qui
permettent de remodeler le sein même après de larges exérè-
ses. L’alternative est un traitement chimiothérapique préopé-
ratoire à visée de réduction du volume tumoral.
La multifocalité est fréquente, lorsqu’elle est connue en pré-
opératoire et pour des patientes particulièrement sélection-
nées (pas plus de deux lésions, proches l’une de l’autre, exérèse
en berges saines) ; le TC est possible sans majorer le risque de
récidive locale.
Pour les lésions rétroaréolaires superficielles ou profondes, le
TC donne des résultats équivalents à ceux obtenus pour les
autres localisations, à condition de réaliser l’exérèse de la pla-
que aréolomammelonnaire.
Toute chirurgie conservatrice est suivie d’une irradiation de
la glande mammaire, celle-ci permet de réduire le risque de
récidive locale de façon significative (réduction du risque de
2,5 à 4).
Il n’existe à ce jour aucun consensus pour définir après TC la
marge d’exérèse optimale. Lorsque les berges sont envahies,
une reprise chirurgicale est indispensable. Le problème est
plus complexe lorsque les berges sont saines et que les marges
sont comprises entre 0 et 5 mm. Il n’existe pas de consensus
concernant la marge minimale optimale. En termes de réci-
dive locale, une marge ≥ 2 mm semble suffisante ; entre 0 et 2
mm, le risque de récidive est plus élevé et une reprise chirur-
gicale est à discuter.
CLASSIFICATION MOLÉCULAIRE
DES CANCERS DU SEIN
La prise en charge actuelle des cancers du sein est fondée sur des
paramètres pronostiques et prédictifs établis comme le TNM, le
statut des récepteurs hormonaux et HER2. Les études récentes sur
l’expression des gènes ont confirmé l’hétérogénéité des tumeurs du
sein. Les données issues d’études de microarrays sur puces ADN et
confirmées par des études sur le profil protidique sur tissu micro-
arrays ont permis de classer les cancers du sein en cinq groupes.
Nous en retiendrons l’identification de deux entités :
– le sous-groupe basal-like ou tumeur triple négative n’exprimant
ni les récepteurs hormonaux (RE et RP) ni HER2. Ces tumeurs
sont souvent de grade 3. Pour être de phénotype basal, la tumeur
doit présenter une expression des cytokératines 5,6 et 17 ou
EGFR. Ces tumeurs sont souvent mutées pour la protéine P53,
leur pronostic est mauvais ;
– les tumeurs surexprimant HER, d’évolution défavorable. Elles
sont souvent de grade 3, elles expriment les récepteurs hormo-
naux dans environ 50 % des cas. L’accès à une thérapie ciblée
comme le trastuzumab (Herceptin
®
) a considérablement modifié
le pronostic de ces lésions.
TRAITEMENT ADJUVANT DES TUMEURS HER2 +
Il faut rappeler que la détermination du statut HER2 doit être
rigoureux. La positivité est définie soit par un test en immuno-
histochimie positif 3+ soit positif 2+ avec un test FISH +. Dans
le cas d’un test IHC 2+, la méthode de référence reste la FISH.
Toutefois, cet examen est coûteux et nécessite d’être équipé en
microscope à fluorescence de haute qualité. La CISH est égale-
ment proposée au même titre que la FISH. Cette technique, un
peu plus longue, peut se lire au microscope optique.
La surexpression de HER2 a été rapidement identifiée comme un
facteur pronostique indépendant. Elle concerne 15 à 25 % des pa-
tientes. En dix ans, l’anticorps monoclonal de souris humanisé et
dirigé contre HER2 est passé de la phase I à une indication incon-
tournable en phase adjuvante. En situation adjuvante, il permet de
diminuer le risque de récidive de 40 à 50 %, le risque de décès de
l’ordre de 30 %. La toxicité cardiaque du trastuzumab reste modé-
rée quand il n’est pas associé aux anthracyclines. Dans le cadre de
traitements séquentiels, cette cardiotoxicité est surtout influencée
par les doses préalables d’anthracyclines et l’intervalle entre l’utili-
sation de ces deux agents. Les complications à type d’insuffisance
cardiaque restent rares (0,5 à 3 % ) et sont le plus souvent réversi-
bles à l’arrêt du traitement. Une surveillance de la fonction ventri-
culaire est préconisée tous les 3 mois. Le schéma d’administration
peut être concomitant ou séquentiel par rapport à la chimiothéra-
pie, la durée optimale de traitement reste à définir. n
Les articles publiés dans “La Lettre du Sénologue” le sont sous la seule responsabilité de leurs auteurs. Tous droits de reproduction, d'adaptation et
de traduction par tous procédés réservés pour tous pays.
EDIMARK SAS © mai 1983 -
Imprimé en France - EDIPS - 21800 Quetigny -
Dépôt légal : à parution.
Un info-congrès de 8 pages intitulé : “Suivi après traitement du cancer du sein : enjeux et modalités. Expérience du réseau
Gynécomed Île-de-France” sera routé avec ce numéro.
1
/
4
100%