STRATÉGIE THÉRAPEUTIQUE
60
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
a question de la poursuite de la chimiothérapie après
obtention de la réponse maximale chez les patientes
atteintes de cancers du sein métastatiques est un pro-
blème quotidien de la pratique oncologique auquel, curieuse-
ment, peu d’équipes se sont intéressées puisqu’il n’y a, à ce
jour, que six études randomisées évaluant l’intérêt des chimio-
thérapies prolongées (ou d’entretien) dans ces cancers. Jusqu’à
présent, la démarche thérapeutique pour ces patientes est
demeurée très empirique et variable d’une école à l’autre ; la
plupart des équipes s’accordent toutefois sur un nombre opti-
mal de cycles de chimiothérapie de l’ordre de huit (1). Il existe
cependant, à l’heure actuelle, suffisamment de données
convergentes au sein de la littérature pour envisager de recon-
sidérer, au moins pour certaines patientes, l’attitude qui a
jusqu’alors prévalu.
La série de Harris et coll. (2) est la seule à ne montrer aucune
supériorité de la chimiothérapie longue : 132 patientes ont reçu
4 cures de mitoxantrone 14 mg/m2/21 jours à l’issue des-
quelles les répondeuses ont été randomisées entre interruption
du traitement (avec reprise en cas de progression) et poursuite
jusqu’à l’échappement thérapeutique (soit 21 et 22 patientes,
respectivement). Il n’y a pas de différence significative entre
les deux bras que ce soit en termes de survie sans progression
(26 vs 22 semaines) ou de survie globale (52 vs 49 semaines).
Il faut souligner que 79 % de ces patientes étaient en échec
d’une hormonothérapie de première ligne métastatique avec un
délai médian entre la première rechute et le début de la
chimiothérapie de 45 semaines, ce qui a probablement abouti à
un biais de sélection en faveur de malades hormonosensibles
d’évolution plus indolente. Le problème essentiel de cette
étude est son manque de puissance statistique : un essai rando-
misé de ce type nécessite un minimum de 170 patientes si l’on
désire mettre en évidence une augmentation de 50 % de la survie
à un an (3).
Il faut comparer ces résultats à ceux publiés par Coates et coll.
trois ans auparavant (4) : il s’agit d’une étude randomisée por-
tant sur 308 patientes (305 évaluables) traitées soit par une
association doxorubicine-cyclophosphamide (AC) soit par un
protocole CMF, chaque chimiothérapie étant administrée de
façon continue ou intermittente. Le fait que ces patientes aient
reçu ou non des anthracyclines ne semble avoir modifié ni les
taux de réponse ni les survies, ce qui est quelque peu surpre-
nant. Quoi qu’il en soit, les patientes recevant un traitement
continu ont une survie sans progression significativement
supérieure (6 vs 4 mois ; p < 0,001) avec une tendance à
l’amélioration de la survie globale (10,7 vs 9,4 mois ;
p = 0,07). Ce travail se distingue par son évaluation soigneuse
de la qualité de vie (scores de bien-être, de douleurs et d’ap-
pétit mesurés sur l’échelle visuelle analogique séparément par
le patient et l’investigateur) qui s’améliore significativement
en début de traitement dans les deux bras avant de se dégrader
secondairement chez les patientes recevant un traitement inter-
mittent ; ce type de démarche n’a jamais été reproduit ultérieu-
rement. La critique essentielle à l’égard de cette étude est
l’interruption du traitement après le troisième cycle, et ce,
même en cas de réponse : certains auteurs proposent de rando-
miser les patientes en réponse après le sixième cycle, ce qui
présente l’avantage d’éviter de stopper le traitement au
moment où certaines malades commencent à peine à répondre,
ce qui crée un biais en défaveur des traitements discontinus (5).
Les trois essais publiés par la suite correspondent, en revanche,
à ce type de méthodologie. Muss et coll. (6) ont traité
250 patientes par un protocole FAC (6 cures) à l’issue duquel
les malades non progressives ont été randomisées entre un trai-
tement d’entretien de type CMF et une surveillance simple. Le
taux de réponse objective après FEC n’est que de 30 %. Une
différence significative en termes de survie sans progression
est mise en évidence (9,4 vs 3,2 mois ; p < 0,01) avec une
survie globale toutefois non modifiée (21,1 vs 19,6 mois ;
p = 0,67).
Ejlertsen et coll. (7) sont les seuls à montrer un bénéfice signi-
ficatif sur la survie globale dans une étude FEC 6 mois vs FEC
18 mois portant sur 359 patientes (254 non progressives à
6 mois, l’épirubicine étant remplacée par le méthotrexate en
cas d’altération de la fonction cardiaque ou d’atteinte de la
dose cumulée limite) : 23 vs 18 mois (p = 0,03). Dans le bras
FEC 18 mois, les toxicités semblent plus importantes, condui-
sant à des adaptations posologiques chez 30 % des patientes
(17 % dans le bras FEC 6 mois) ; par ailleurs, dans 23 % des
cas avec traitement prolongé, celui-ci a été interrompu à la
demande de la patiente avant le 18emois.
* Département de médecine, IGR, rue Camille-Desmoulins,
94805 Villejuif Cedex.
La chimiothérapie des cancers du sein métastatiques :
stop ou encore ?
●
L. Zelek*
L
vol VII/n°2 avr. 23/04/04 10:04 Page 60

61
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
L’étude la plus récente a été publiée par Gregory et coll. en
1997 (8) et porte sur 107 patientes traitées par des chimiothéra-
pies de type VAC, VEC ou 3M avec randomisation au
6ecycle en l’absence de progression (surveillance vs 6 cures
supplémentaires). Dans le groupe recevant un traitement pro-
longé, on observe des durées de réponse significativement
supérieures (10 vs 7 mois ; p = 0,02), cependant sans bénéfice
évident sur la survie globale (13 vs 10,5 mois ; p = 0,3).
Pour mémoire, enfin, on peut mentionner la série de Falkson et
coll. (9) qui fait état de résultats similaires mais n’a cependant
été publiée que sous forme de résumé de congrès.
Comme le souligne l’équipe de Coates (10), l’interprétation
des résultats négatifs issus de petits essais randomisés avec un
bras témoin actif est délicate et l’absence de différence statisti-
quement significative ne suffit pas à démontrer l’équivalence
de deux modalités thérapeutiques. Ces auteurs ont donc
conduit une méta-analyse (10) à partir des données de la litté-
rature portant sur seulement 4 des esssais cités (2, 4, 7, 8),
réunissant un total de 766 patientes et mettant en évidence un
bénéfice sur la survie chiffré à 23 % (p = 0,01).
Au vu de ces résultats, il semble désormais légitime de consi-
dérer la prolongation du traitement ou le passage à une chimio-
thérapie d’entretien après le sixième cycle, au moins chez les
patientes présentant une réponse de bonne qualité, sous réserve
d’une tolérance acceptable. La durée totale de traitement que
l’on pourrait proposer à ces malades est de l’ordre de 10 à
12 mois, sachant qu’il devient difficile d’aller au-delà dans
nombre de cas pour de multiples raisons, notamment psycholo-
giques (7).
Toutes les études disponibles à ce jour portent toutefois sur des
chimiothérapies de référence de type FEC ou apparentées et il
n’est en revanche pas démontré que le traitement long demeure
une option intéressante avec des protocoles associant taxanes
et anthracyclines, qui sont de plus en plus pratiqués actuelle-
ment. L’expérience clinique montre d’ailleurs qu’il est souvent
difficile de poursuivre ce type de traitements au-delà de huit
cycles, et la chimiothérapie d’entretien que nous pourrions
envisager reste à définir (alkylants ? vinorelbine ?). Enfin, il
n’est guère certain, si un traitement d’entretien est indiqué,
qu’une chimiothérapie soit encore longtemps une solution de
choix à l’heure où d’autres traitements médicaux prometteurs
voient le jour : agents anti-angiogéniques, anticorps anti-
Her2-neu (11). ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Spielmann M. La chimiothérapie des cancers du sein métastatiques. In : Les
traitements médicaux des cancers du sein. Namer M., Tessier E., Ferrero J.M.,
Arnette Blackwell, Paris 1996, p. 165-90.
2. Harris A.L., Cantwell B., Carmichael J. et coll. Comparison of short-term
and continuous chemotherapy (mitozantrone) for advanced breast cancer.
Lancet 1990 ; 335 : 186-90.
3. Glaholm J., Mort C., Ashley S., Yarnold J.R. Duration of chemotherapy in
advanced breast carcinoma (letter). Lancet 1990 ; 335 : 1033.
4. Coates A., Gebski V., Bishop J.F. et coll. Improving the quality of life during
chemotherapy for advanced breast cancer. N Engl J Med 1987 ; 317 : 1490-5.
5. Plotkin D., Ray M. Intermittent versus continuous chemotherapy for breast
cancer (letter). N Engl J Med 1988 ; 318 : 1467-8.
6. Muss H.B., Douglas Case L., Richards F. et coll. Interrupted versus
continuous chemotherapy in patients with metastatic breast cancer. N Engl J
Med 1991 ; 325 : 1342-8.
7. Ejlertsen B., Pfeiffer P., Pedersen D. et coll. Decreased efficacy of
cyclophosphamide, epirubicin, and 5-fluorouracil in metastatic breast cancer
with reducing treatment duration from 18 to 6 months. Eur J Cancer 1993 ;
29A : 527-31.
8. Gregory R.K., Powles T.J., Chang J.C., Ashley S. A randomized trial of six
versus twelve courses of chemotherapy in metastatic carcinoma of the breast.
Eur J Cancer 1997 ; 33 : 2194-7.
9. Falkson G., Gelman R.C., Pandya K.J. et coll. Metastatic breast cancer in
complete remission : observation versus CMFPTH maintenance. An ECOG
randomized study. Proc Am Soc Clin Oncol 1996 ; 15 : abst. 63.
10. Stockler M., Wilcken N., Coates A. Chemotherapy for metastatic breast
cancer - When is enough enough ? (Editorial). Eur J Cancer 1997 ; 33 : 2147-8.
11. Norton L. Evolving concepts in the systemic drug therapy of breast cancer.
Semin Oncol 1997 ; 24 : S10.3-S10.10.
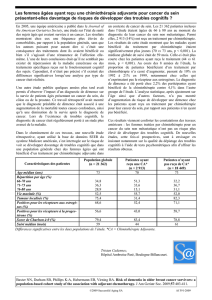
Essai Patientes randomisées Survie sans progression (p) Survie globale (p)
Coates 1987 AC ou CMFP 308 6 vs 4 mois (p < 0,001) 10,7 vs 9,4 mois (p = 0,07)
continu vs 3 cures*
Harris 1990 Mitoxantrone 43 26 vs 22 semaines (p > 0,1) 52 vs 49 semaines (p > 0,1)
continu vs 4 cures*
Muss 1991 FAC x 6, si RO/SD 145 9,4 vs 3,2 mois (p = 0,0001) 21,1 vs 19,6 mois (p = 0,67)
CMF vs observation*
Ejlertsen 1993 FEC x 18 vs 6 mois 359 14 vs 10 mois (p = 0,00003) 23 vs 18 mois (p = 0,03)
Falkson 1996 FAC ou équivalent, 195 18,7 vs 7,8 mois (p < 0,0001) 32,2 vs 28,7 mois (p = 0,74)
si RO/SD CMF vs observation
Gregory 1997 VAC, VEC ou 107 10 vs 7 mois (p = 0,02) 13 vs 10,5 mois (p = 0,3)
3 mois x 6,
si RO/SD idem x 6
vs observation
Tableau. Essais randomisés de chimiothérapie courte vs prolongée dans les cancers du sein métastatiques.
* reprise de la chimiothérapie en cas de progression dans le groupe témoin.
vol VII/n°2 avr. 23/04/04 10:04 Page 61
1
/
2
100%