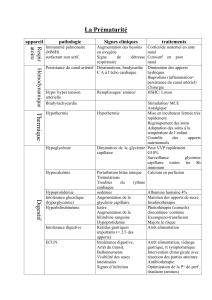
– UE VIII –

2016-2017 Électrophorèse capillaire (suite)
Sciences analytiques
– UE VIII –
Électrophorèse capillaire (suite)
Semaine : n°11 (du 14/11/2016 au
18/11/2016)
Date : 17/11/2016
Heure : de 8h00 à
9h00 Professeur : Pr. FOULON
Binôme : n°30 Correcteur : n°8
Remarques du professeur
•dernier cours
PLAN DU COURS
1/13
I) Principes et généralités
A) Principe général
B) Appareillage
C) Les différentes étapes d'une analyse
D) Les phénomènes à l'origine du transport et de la séparation
E) Les paramètres fondamentaux
1) Grandeur de rétention
2) Résolution
II) Application de l'électrophorèse à l'analyse qualitative et quantitative
A) Analyse qualitative
B) Analyse quantitative
III) Conclusion

2016-2017 Électrophorèse capillaire (suite)
I) Principes et généralités
A) Principe général
Électrophorèse capillaire : technique séparative basée sur la migration, dans un capillaire et sous l'effet
d'un champ électrique, d'espèces présentes dans un échantillon en solution, porteuses ou non d'une
charge électrique globale.
B) Appareillage
Le capillaire :
•silice vierge ou greffée, recouverte de polyimide
•longueur totale : 25 < L < 1 m
•diamètre interne : 25 µm < di < 100 µm
Ce capillaire on est amené à le remplir avec l'électrolyte de séparation, on veut aussi appliquer une ddp.
On va le faire à l'aide d'une cartouche qu'on place ds le système d'électrophorèse pour réaliser les
opérations de remplissage et de séparation.
La cartouche
:
•circulation d'air
•ou circulation d'un fluide cryogénique
La cartouche fait aussi circuler un fluide autour du capillaire en permanence pour réguler la température
par circulation d'air ou d'un fluide cryogénique (en laboratoire) qui permet de refroidir en permanence le
système car quand on impose une ddp dans le capillaire, il y a un courant qui va circuler dans le système
et donc il va y avoir une augmentation de la température par un effet Joule.
Couplée à un système de régulation de la température : 10 °C < T < 40 °C
•intérêt : obtenir des pics fins et éviter la formation de bulles (pics fantômes)
La cartouche est couplée a un système de régulation, la température est fixée entre 10 et 40 °C.
Si j'applique ma tension il y a un dégagement de chaleur donc si la température évolue au cours de la
séparation on va avoir une déformation des pics, donc une mauvaise séparation et la formation de bulles
ds le solvant qui vont se balader au hasard et qu'on ne pourra pas contrôler, on aura donc des pics
fantômes.
Récipients contenant les échantillons à analyser et les solutions d'électrolyte nécessaires à la
séparation :
2/13

2016-2017 Électrophorèse capillaire (suite)
•Vmax = 5 mL pour les solutions d'électrolytes
•Vmin = 200 µL pour les échantillons à analyser si volume disponible faible
Support mobile pour placer les échantillons à analyser et les solutions d'électrolyte nécessaires à la
séparation
L'électrolyte de séparation :
L'électrolyte de séparation c'est la solution qu'on introduit ds le capillaire pour mener la séparation.
•solution conductrice qui contient des ions
•on travaille en milieu aqueux
•on choisit comme électrolyte de séparation une solution tampon dont l’objectif va être de fixer le
pH pour :
◦contrôler l'état d'ionisation des molécules qui sont ionisables (acides faibles et bases faibles)
◦ainsi que contrôler les phénomènes de migration
▪car le pH joue sur le phénomène de déplacement des espèces
Rappel : solution tampon : acide faible + sa base conjuguée
fixe le pH dans le domaine pKa ± 1,5
Exemples :
Système d'injection :
1) Hydrodynamique : air comprimé (P (Pa ou psi), t (s ou min))
On va rincer le capillaire et injecter l’échantillon à analyser. On immerge le capillaire dans la
solution que l'on veut faire rentrer ds le capillaire. On va appliquer une pression d'air comprimé
sur la surface des liquides. Le liquide va monter ds le capillaire.
On peut aussi créer un vide à l'extrémité opposée pour aspirer le liquide ou utiliser une différence
de hauteur entre les flacons qui sont à chacune des extrémités des capillaires pour entraîner un
phénomène de siphonnage.
Ici on travaille sur des quantités qui sont très très petites.
2) Electrocinétique : application d'une tension (U (kV) et t (s ou min)
3/13

2016-2017 Électrophorèse capillaire (suite)
Ce sont les molécules chargées qui seront injectées. Technique beaucoup moins utilisée car
injection d'un type d'ion à chaque fois. On ne peut pas injecter des molécules neutres.
Rq : le mode hydrodynamique est le système le plus utilisé.
Dispositif d'application de la haute tension :
•électrode de platine
•générateur de tension : 5 kV < V < 30 kV tension continue
•champ électrique intense E (V.cm-1) : E = V / L
◦V = tension appliquée
◦L = longueur du capillaire
Le système de détection :
1) Détection « on line » (sur le capillaire)
◦spectrométrie de fluorescence : ce n'est pas la plus courante
◦détecteur électrochimique : mesure de la conductimétrie ou de l'ampérométrie
◦spectrométrie UV-visible +++ : en mesurant l'absorbance de ce qui passe dans le capillaire
On mesure l'intensité du rayonnement avant et après traversée du capillaire pour calculer une absorbance.
Le trajet optique correspond au diamètre du capillaire (50 µm).
2) Détection « off line » (en sortie de capillaire)
◦spectrométrie de masse : coûte 2 à 3 fois plus chère donc très peu utilisée. On peut doser de
plus petites quantités mais ici la détection se fait off line, on récupère ce qui sort du capillaire
Système de pilotage : PC + logiciel
•tout est géré via un logiciel installé sur ordinateur
C) Les différentes étapes d'une analyse
1) Rinçage du capillaire (avec NaOH et/ou H2O) puis avec l'électrolyte de séparation
•application d'une pression élevée (20 psi) pendant 1 à 2 min
•introduction d'un volume égal à 10 fois le volume interne du capillaire
4/13

2016-2017 Électrophorèse capillaire (suite)
2) Injection de l'échantillon
•application d'une pression faible (1 psi = 20 fois plus faible que pour le rinçage) pendant 0,5
à 2 s
•
J'impose ma différence de potentiel aux bornes du capillaire (anode/cathode) grâce à
l’application d'une haute tension qui est appliquée grâce à l'immersion dans les flacons
d'électrolyte de séparation. On a immergé une électrode de platine. C'est entre ces 2 électrodes
qu'on va appliquer une haute tension qui va générer un champ électrique intense. Après
avoir injecté mon échantillon, je vais replacer chaque extrémité du capillaire dans l'électrolyte
de séparation pour avoir un circuit électrique complet.
3) Application de la tension et mesure du signal en fonction du temps
•déplacement des analytes dans le capillaire à une vitesse dépendante de leur charge et de
leur taille
•séparation des analytes
•obtention de l'électrophérogramme : correspond à la réponse du détecteur en fonction du
temps
1er pic qui correspond à la substance qui s'est déplacée le plus vite en bleu et la plus lente en
rose
5/13
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%