Lire l'article complet

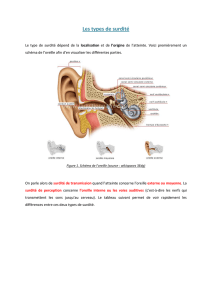
Surdité
de transmission
non évolutive
Isolée
Syndrome
Aplasie
mineure
• Scanner
• Radio du squelette
• Scanner
• Radio du squelette
• Bilan ophtalmologique
• Bilan rénal
• Bilan général
Goldenhar
Stickler
Franceschetti
22q11
18q
Figure 1. Arbre décisionnel du bilan étiologique d’une surdité de transmission non évolutive.
6 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009
CONGRÈS
RÉUNION
16e Journée de l’AFOP
Surdité de l’enfant
N. Noël-Petroff*
* Hôpital Robert-Debré, Paris.
Le bilan étiologique
(D’après la communication du Dr S. Marlin, Paris)
En France, si 20 % des surdités sont de causes envi-
ronnementales, 80 % sont d’origine génétique. Parmi
ces dernières, 90 % sont des surdités isolées et 10 %
appartiennent à un des 500 syndromes pouvant
comporter un déficit auditif.
La plupart (trois quarts) des surdités génétiques
isolées surviennent de façon sporadique, et non
dans le cadre d’une surdité familiale. La responsabi-
lité d’une mutation sur le gène de la connexine 26
(et/ou 30) est en cause dans un tiers de ces surdités
isolées. Mais 12 gènes au moins peuvent être impli-
qués dans un tableau de surdité isolée ou dans un
tableau de surdité syndromique.
La recherche génétique d’une surdité va être orientée
par :
– le type de surdité : surdité de transmission ou de
perception (figures 1, 2, 3) ;
– le caractère isolé ou syndromique de la surdité
(tableau I) ;
– la forme de la courbe d’audiométrie tonale, l’aspect
fluctuant ou évolutif de la surdité (tableau II) ;
– le scanner des rochers : présence d’une malfor-
mation éventuelle touchant l’oreille moyenne et/
ou interne (tableau III).
Dans les surdités unilatérales, il faudra éliminer
une infection prénatale à cytomégalovirus (CMV)
et évoquer un syndrome de Waardenburg. Dans les
dilatations de l’aqueduc vestibulaire (DAV) unilaté-
rales, contrairement aux formes bilatérales, le gène
SLC26A4 est rarement en cause.
La 16
e
Journée de l’Association française d’ORL pédiatrique (AFOP) s’est tenue le 13 mars
dernier à l’espace Reuilly, à Paris. Tous les thèmes abordés ont concerné la surdité
de l’enfant : dépistage et prise en charge après le dépistage, tests audiométriques
subjectifs et objectifs, avancées sur les étiologies, la recherche, etc.

Surdité
de transmission
évolutive
Isolée
Syndrome
Otospongiose Scanner
• Scanner
• Radio du squelette
• Bilan génétique
• Lobstein
(ostéogenèse
imparfaite)
• Maladies
osseuses
Figure 2. Arbre décisionnel
du bilan étiologique d’une
surdité de transmission
évolutive.
La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009 | 7
CONGRÈS
RÉUNION
Tableau I. Gènes clonés pour les surdités syndromiques les plus fréquentes.
Syndrome Gènes Symptômes cliniques Scanner des rochers
WAARDENBURG 5 gènes connus Troubles de la pigmentation
(peuvent être très discrets)
Normal, parfois anomalie
des canaux semi-circulaires
Syndrome branchio-oto-rénal 3 gènes connus Atteinte rénale
Fistules cervico-faciales
PENDRED 1 gène Atteinte thyroïdienne (goitre à 10 ans) DAV bilatérale
ou malformation de Mondini
USHER type 1 Nombreux gènes Atteinte visuelle précoce
Retard à la marche (aréflexie vestibulaire)
Surdité profonde
Normal
USHER type 2 Nombreux gènes Atteinte visuelle tardive
Pas de retard à la marche
Surdité moyenne à sévère
Normal
Tableau II. Orientation de la recherche génétique pour les surdités isolées en fonction des informations audiologiques lorsque le scanner des rochers
est normal.
Courbe audiométrique OEA Gène
Surdité prélinguale
Courbe plate ou descendante Absentes Connexine 26
+/- connexine 30
Surdité prélinguale profonde Présentes Otoferline
Surdité postlinguale légère
Courbe en U ou ascendante
Origine espagnole
– WFS1
Surdité secondaire à un traitement par aminosides
Origine espagnole ou asiatique (Chine) – Atteinte mitochondriale
OEA: otoémissions provoquées.
Tableau III. Orientation de la recherche génétique en fonction des atteintes de l’oreille interne sur le scanner, pour les surdités isolées.
Malformation de l’oreille interne Caractéristique principale du syndrome Gène
Dilatation de l’aqueduc du vestibule bilatérale Surdité fluctuante ou évolutive SLC26A4 (même gène que celui du syndrome de Pendred)
Conduit auditif interne très dilaté (oreille geyser) Autosomique récessif ou cas sporadique POU3F4
Malformation des conduits semi-circulaires
± vestibule Syndrome exprimé a minima Waardenburg
CHARGE

t
L
H
10 dB 50 dB 100 dB
Composantes L et H en place
Décalage global des 2 composantes
Disparition de L ; H préservée, en place
Pente raide pour L ; H réintègre la zone
Composantes L et H totalement excentrées
I
t
10 dB 50 dB 100 dB
I
t
10 dB 50 dB 100 dB
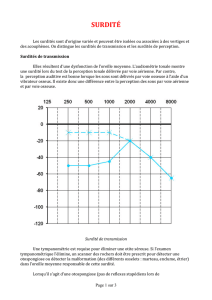
I
0
20
40
60
80
100
120
250 500 1 000 2 000 4 000
0
20
40
60
80
100
120
250 500 1 000 2 000 4 000
Audition normale
0
20
40
60
80
100
120
250 500 1 000 2 000 4 000
Surdité de perception
avec recrutement
t
10 dB 50 dB 100 dB
I
0
20
40
60
80
100
120
250 500 1 000 2 000 4 000
Surdité de perception
à courbe descendante
t
10 dB 50 dB 100 dB
I
0
20
40
60
80
100
120
250 500 1 000 2 000 4 000
Surdité
sans perception des HF
Surdité de transmission
8 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009
CONGRÈS
RÉUNION
Informations apportées
par la courbe latence/intensité
des potentiels évoqués auditifs
(D’après la communication du Pr P. Deltenre,
Bruxelles)
Aucun test ne suffit à lui seul à poser un diagnostic
de surdité. C’est le recoupement et la cohérence des
résultats des tests (tests subjectifs et objectifs, clinique
et interrogatoire des parents) qui rend le diagnostic plus
sûr. Lorsque les résultats sont incohérents, non concor-
dants, il faut évoquer une neuropathie et ne pas hésiter
à refaire des examens.
La courbe latence/intensité (L=f(I)) des potentiels
évoqués auditifs précoces (PEA) a 2 composantes :
– la composante L à pente assez verticale, pour les
faibles intensités de stimulation, correspondant au
recrutement progressif des cellules ciliées externes et
des fibres nerveuses au fur et à mesure de l’augmenta-
tion de l’intensité ;
– la composante H à pente horizontale, pour les inten-
sités supérieures à 60 dB, où la plupart des cellules sont
recrutées et où les latences ne se modifient plus.
À noter que l’onde I des PEA possède un double pic pour
des intensités de 50 à 60 dB, qui correspond à la zone de
transition entre ces deux composantes L et H.
Dans les surdités de transmission, la fonction L=f(I) a
une courbe globalement décalée vers la droite, avec
conservation des 2 composantes, sans modification
des pentes (tableau IV).
Dans les surdités de perception endocochléaires, la forme
de la courbe des latences pourra donner une idée de la
courbe audiométrique (tableau IV) :
– en cas d’atteinte des cellules ciliées externes (CCE),
la composante L va disparaître, par perte du système
d’amplification cochléaire, alors que la composante H est
préservée : cliniquement, ces surdités s’accompagnent
d’un recrutement ;
– dans les surdités à pente descendante marquée, la
composante L va se verticaliser : pour les faibles inten-
sités, des neurones plus apicaux vont pouvoir être
“accrochés” et donner des ondes V d’apparition très
retardée. Mais, aux très fortes intensités, la compo-
sante H réintègre la zone de latence normale, car les
neurones accrochés deviennent plus proches ;
– dans les surdités à courbe en pente de ski sans percep-
tion des fréquences aiguës, les 2 composantes, L (verti-
calisée) et H, se retrouvent toutes les deux très en dehors
des zones de latence classiques, sans réintégration,
même à forte intensité. Les ondes à latences très tardives
ne sont donc plus ici représentatives des fréquences clas-
siquement explorées par les PEA (2 000-4 000 Hz).
Tableau IV. Relation entre la fonction latence/intensité des PEA et les audiogrammes.

Surdité
de perception
isolée
85 à 90 %
Autosomique récessif
10 à 15 %
Autosomique dominant
< 1 %
Mitochondriale
Scanner
Scanner
Génétique
Forme de
la courbe audio
2 %
Lié à X
Figure 3. Arbre décisionnel du bilan étiologique pour les surdités de perception
isolées.
La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009 | 9
CONGRÈS
RÉUNION
Auditory Steady State
Responses (ASSR)
(D’après la communication du Pr P. Deltenre,
Bruxelles)
Une évaluation des ASSR a été menée pour apprécier
leur validité, en les confrontant aux PEA. Leur temps
de recueil est très inférieur à celui des “PEA spéci-
fiques en fréquence”. D’un point de vue pratique, ils
sont plus faciles à obtenir chez les bébés de moins
de 2 mois, en sommeil naturel. Au-delà de 6 mois,
le changement du tonus musculaire lors du sommeil
des nourrissons oblige à recourir à l’anesthésie géné-
rale. Un bilan complet nécessite 2 heures environ.
Les ASSR, qui permettent de réaliser une courbe
audiométrique objective sur plusieurs fréquences,
ont une meilleure validité avec la fréquence de
modulation 80 Hz. Toutefois, leur mauvaise sensi-
bilité pour explorer les basses fréquences (250
et 500 Hz) semble améliorée si l’on prend 40 Hz
comme fréquence de modulation. Les ASSR permet-
tent d’obtenir davantage d’informations dans le cas
de surdités avec perte auditive supérieure à 100 dB.
Dans les neuropathies, les PEA, tout comme les ASSR,
restent très mal corrélés avec les seuils obtenus aux
tests subjectifs. Il est préconisé de rechercher le
potentiel microphonique visible dans les premières
microsecondes des PEA, et de comparer les courbes
de raréfaction et de condensation des PEA, mais
aucun test objectif n’est actuellement fiable.
Régénération des cellules ciliées
(D’après la communication du Pr R. Marianowski,
Brest)
Le Pr Marianowski a fait le point sur les 10 dernières
années de recherche concernant la repousse d’un
épithélium sensoriel efficient au niveau de la cochlée.
Jusqu’à présent, on estimait que des cellules ne
pouvaient pas se redifférencier en cellules senso-
rielles dans la cochlée humaine, alors que cette
régénération existe chez l’oiseau ou le batracien.
Le facteur de transcription basique “Math1”, appelé
aussi “ Atoh1”, est essentiel à la transcription de
certains gènes intervenant dans la différentiation
des cellules sensorielles. Chez l’embryon, Atoh1 et
Ngn1 vont permettre l’apparition de cellules ciliées
et de fibres nerveuses entre les 11e et 18e jours de vie
intra-utérine. Puis, Atoh1 va non seulement induire
l’apparition de cellules ciliées, mais celles-ci vont
elles-mêmes empêcher la transformation des cellules
adjacentes par le “système Notch”, les faisant donc se
différencier en cellules de soutien (Hensen, Deiters).
Les cellules ciliées (CCE et CCI), de même que les
cellules de soutien, dérivent toutes des mêmes
cellules souches otocytiques. L’injection d’Atoh1
chez le rat, par différents vecteurs (adénovirus ou
vecteur synthétique KLN4-7), dans une cochlée
sourde (traitée par aminosides), ne permet pas de
récupérer un épithélium fonctionnel si l’injection se
fait dans une cochlée mature. En revanche, lorsque
la même injection est pratiquée dans la vésicule
otique d’un rat sourd, très tôt, à l’âge de 11 jours de
vie embryonnaire, un épithélium sensoriel à architec-
ture globalement respectée, innervé, se développe.
Tests audiométriques subjectifs
chez le jeune nourrisson
(D’après la communication de M. Delaroche,
Bordeaux)
Monique Delaroche à montré, à l’aide de vidéos,
les adaptations possibles des tests audiométriques
subjectifs permettant de rechercher les seuils audi-
tifs dès 2 ou 3 mois de vie chez des enfants repérés
par les examens de dépistage néonatal.
Le but des tests reste de mesurer les seuils auditifs
par voie osseuse (vibrateur) et par voie aérienne
au casque, pour obtenir des courbes d’audiométrie
d’abord bilatérales, puis à oreilles séparées. Une
courbe bilatérale suffira à faire démarrer l’appa-
reillage, car elle reflète la meilleure oreille et il n’y a
donc pas de risque de surcorrection d’une oreille.
L’adaptation de nos pratiques audiométriques doit
intégrer la connaissance du développement normal du
bébé, ce qui amène à adapter l’installation du bébé et
des parents en cabine, la position du testeur, le type
de stimuli (bitonal) et les modalités de renforcement

10 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 318 - juillet-août-septembre 2009
CONGRÈS
RÉUNION
qui incitent le bébé à renouveler ses réponses. Chez
les prématurés, il faut tenir compte de l’âge corrigé.
Le testeur doit contrôler l’état de vigilance du bébé
et doit savoir préserver son capital attentionnel. Les
meilleures réponses sont obtenues au seuil de l’en-
dormissement, les réactions aux stimuli devant être
recherchées en dehors des moments d’activité spon-
tanée du bébé. Avant 4 mois, les réponses pourront
être des crispations de paupières, une modification du
rythme respiratoire ou de la succion si l’enfant a une
tétine, un éveil, une ouverture des yeux, des réactions
de surprise. Le testeur devra rester en relation visuelle
d’échange par des mimiques, des gestes, de la parole,
pour renforcer symboliquement la stimulation auditive
et les réponses. Ce jeu relationnel va donner du sens
à la perception. À partir de 6 mois, les réactions de
recherche, d’investigation et d’orientation apparaissent.
Annonce du diagnostic de surdité
(D’après la communication du Dr G. Lina-
Granade, Lyon)
Les médecins ORL audiophonologistes auxquels
revient la lourde tâche d’annoncer une surdité n’ont
pas été formés à ce genre d’épreuve lors de leurs
études médicales. Ils se sentent donc souvent un
peu livrés à eux-mêmes pour annoncer à de jeunes
parents une pathologie qui s’avère être incurable.
Pour ces parents, il y aura un AVANT et un APRÈS.
“La forme, c’est le fond qui revient à la surface”
(V. Hugo) : la manière d’annoncer le diagnostic va
compter sur la façon dont les parents vont réaliser et
accepter ce qui se passe pour leur enfant. L’annonce
ne doit pas être faite sans y mettre la forme. Mieux
vaut prévoir un rendez-vous plus long, pour avoir
le temps d’expliquer, de choisir les mots, d’amener
petit à petit le diagnostic et pouvoir répondre aux
questions. Il faut rester clair sur le diagnostic sans
pour autant être péremptoire, mais apporter aussi
un peu d’espoir en parlant des différents moyens qui
existent pour aider cet enfant sourd. Le mot “surdité”
lui-même renvoie dans l’inconscient collectif à des
équivalences du type “sourd total”, “muet”, “langue
des signes”, voire “sourdingue”, avec sa connotation
de débilité associée à l’atteinte sensorielle.
Le diagnostic est plus facile à amener si les parents
ont déjà eux-mêmes des doutes sur l’audition de leur
enfant et s’ils ont assisté aux tests audiométriques en
champ libre et se sont rendu compte des sons qui ne
provoquent aucune réaction de la part de leur enfant.
L’annonce est plus délicate pour les bébés diagnos-
tiqués sourds à la suite du dépistage systématique :
les parents sont moins préparés. Devant des PEA
anormaux (PEAA), mieux vaut parler “d’anomalies
nécessitant de compléter les explorations auditives”
plutôt que parler déjà de “surdité”.
En pratique, l’ORL devra annoncer le diagnostic en
reprenant les doutes antérieurs des parents, en leur
rappelant les réactions qu’ils ont eux-mêmes consta-
tées en cabine, en rappelant les facteurs de risque, s’il
y en avait. Il pourra expliquer l’audiogramme sur un
schéma, les sons pouvant être perçus ou non par leur
enfant. Il pourra aussi expliquer l’anatomie de l’oreille,
la différence entre les atteintes de l’oreille moyenne
et celles de l’oreille interne. L’ORL doit avoir envers
les parents une “empathie”, une écoute bienveillante,
il doit justifier leur peine, accepter leurs larmes, qui
sont souvent un témoin positif de la bonne prise de
conscience des enjeux. Expliquer ce qui peut être entre-
pris pour aider cet enfant sourd débute la guidance et
l’accompagnement des parents. Parler de chirurgie
et d’implant dès ce premier rendez-vous est risqué,
car l’illusion d’une réparation possible est probable et
elle pourra empêcher les parents de prendre toute la
mesure du handicap réel de leur enfant. En revanche,
il faut déjà expliquer ce que sont les prothèses audi-
tives (il est bon d’avoir des modèles pour les faire mani-
puler) et donner des pistes de communication globale
pour que les parents se sentent moins démunis face
à leur très jeune enfant. Il faut bien expliquer l’impor-
tance de continuer à parler au bébé et de renforcer
les échanges globaux en s’aidant de câlins, mimiques,
chansons, comptines, voire en associant des signes issus
de la langue des signes française (LSF) ou de quelques
mots auxquels on associera le code du langage parlé
complété (LPC), le plus urgent étant de restaurer une
communication compréhensible pour l’enfant. Il faudra
expliquer le rôle des audioprothésistes, des orthopho-
nistes, des centres pour enfants sourds, des modes de
communication. Des adresses d’associations de parents
d’enfants sourds pourront être communiquées.
La réaction des parents pourra être de divers ordres :
– une sidération : pour certains parents, un long temps
sera nécessaire pour accepter ce diagnostic ;
– un déni, les parents refusant le diagnostic : la
reprise des explications lors des différentes visites
sera donc importante ; on peut aussi proposer d’aller
voir un autre audiologiste pour deuxième avis ;
– de la colère, soit vis-à-vis des professionnels n’ayant
pas fait le diagnostic avant, soit vis-à-vis du médecin
annonceur, soit vis-à-vis de cet enfant qui ne répond
plus aux critères de l’enfant idéal, etc. ;
– un hypercontrôle : les parents vont essayer de
rationnaliser au maximum pour se mettre à distance
de ce qui leur arrive ;
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%