Lire l'article complet

14 | La Lettre de l’Hépato-Gastroentérologue • Vol. XVII - n° 1 - janvier-février 2014
EVIDENCE-BASED MEDICINE Hépatologie
En cas d’indication de traitement antiviral B chez une femme jeune, la
possibilité d’une grossesse doit être prise en compte pour la décision et
le choix du traitement.
La grossesse est contre-indiquée en cas de traitement par interféron ou
entécavir. Elle est possible sous ténofovir.
Le dépistage de l’AgHBs (antigène de surface de l’hépatite B) est obliga-
toire au cours de la grossesse.
La sérovaccination commencée à la naissance et la sérologie de contrôle
sont recommandées chez l’enfant né de mère AgHBs+.
En cas d’ADN du virus B élevé chez la mère, la sérovaccination bien
conduite n’est pas effi cace à 100 %.
Dans ce cas, l’indication se discute d’un traitement antiviral au dernier
trimestre de la grossesse, associé à la sérovaccination pour diminuer le
risque de transmission mère-enfant.
Ce qu’il faut retenir
L
a transmission mère-enfant du virus de l’hépa-
tite B (VHB) reste une cause majeure du main-
tien de l’épidémie de VHB dans le monde. En
effet, le risque de transmission mère-enfant du VHB
est élevé lorsque la mère est AgHBs+, et le risque de
passage à la chronicité est également élevé en cas de
contamination néonatale. Le traitement antiviral B
peut s’envisager dans 2 cas distincts : soit avant la
grossesse soit pendant la grossesse.
Traitement antiviral B
avant la grossesse
Le choix du traitement antiviral B chez une femme
jeune ayant une indication validée de traitement
(ADN du VHB > 2 000 UI/ml ou ALAT > normale
et présence d’une maladie significative du foie)
doit se faire en prenant en compte la possibilité
d’une grossesse ultérieure (1). Les 2 traitements de
première ligne recommandés sont le traitement par
interféron et un analogue de deuxième génération
en monothérapie (1). L’interféron a l’avantage d’être
habituellement limité à 48 semaines et donc de
pouvoir être réalisé avant la grossesse (la grossesse
est contre-indiquée sous interféron). Dans la majo-
rité des cas, un traitement par analogue de deuxième
génération est préféré au traitement par interféron.
Avant chaque grossesse, voire en début de grossesse,
l’arrêt de l’analogue – et le risque de réactivation qu’il
entraîne – ou sa poursuite devront être discutés. Le
choix de poursuivre est le plus habituel et s’impose
en cas de maladie du foie initialement fi brosante ou
d’antécédent de transmission mère-enfant du VHB
lors d’une grossesse antérieure. Si la poursuite de
l’analogue est décidée et s’il s’agit d’un traitement
par entécavir, celui-ci doit être remplacé par du téno-
fovir, idéalement avant le début de la grossesse. Si
le traitement initial était du ténofovir, il pourra être
poursuivi durant la grossesse.
Traitement antiviral B
pendant la grossesse
La prévention de la transmission mère-enfant du VHB
repose en France sur 3 recommandations :
➤
dépistage obligatoire de l’AgHBs chez toute
femme enceinte au sixième mois de grossesse ;
➤
sérovaccination de tout enfant né de mère
AgHBs+ commencée dans les premières 12 heures
de vie : immunoglobulines anti-HBs (100 UI) + vaccin
de l’enfant à 10 μg (vaccin répété à M1 et M6) ;
➤
vérifi cation de la sérologie VHB de l’enfant à
partir du septième mois.
Malgré ces mesures, il persiste un risque résiduel
de transmission mère-enfant du VHB. Ces échecs
peuvent être dus :
➤
à la transmission d’un VHB mutant HBs et donc à
la sensibilité diminuée aux immunoglobulines anti-
HBs ou au vaccin. Il s’agit d’un risque essentiellement
théorique ;
➤à l’absence de suivi des recommandations ;
➤à la transmission du VHB in utero.
Le défaut de suivi des recommandations est un
élément qui reste inquiétant dans les pays déve-
loppés. En France, par exemple, une enquête exhaus-
Quel traitement antiviral B préconiser
au cours de la grossesse ?
Philippe Sogni, Paris.
niveau
de preuve
1b

La Lettre de l’Hépato-Gastroentérologue • Vol. XVII - n° 1 - janvier-février 2014 | 15
EVIDENCE-BASED MEDICINE
Hépatologie
Questions non résolues
» Comment optimiser les recommandations de prise en charge du VHB
au cours de la grossesse en France ?
» Quel est le seuil d’ADN du VHB à partir duquel une sérovaccination bien
conduite perd de son effi cacité ?
» Poursuite des études évaluant l’innocuité du ténofovir pendant la grossesse,
notamment sur le développement de l’enfant.
tive réalisée en 2006 dans les maternités de Picardie
a montré que le dépistage de l’AgHBs n’était pas
réalisé dans 7 % des cas (2). Les données concernant
la sérovaccination et l’évaluation de son effi cacité
sont, quant à elles, parcellaires, mais probablement
également non optimales.
Le risque de transmission in utero du VHB est associé
à une charge virale (ADN du VHB) élevée chez la
mère et apparaît donc comme le facteur de risque
majeur d’échec d’une sérovaccination bien conduite.
Le seuil à partir duquel ce risque devient signifi -
catif n’est pas clairement établi. Une étude asia-
tique récente a trouvé un risque signifi catif à partir
d’un ADN du VHB de 7 à 8 log UI/ml (3). Même si
les données de la littérature sont essentiellement
asiatiques, des données similaires viennent d’être
rapportées en France, avec un taux d’échec de la
sérovaccination de 11 % en cas d’ADN du VHB supé-
rieur à 5 log UI/ml chez la mère (4).
En pratique, 2 axes doivent être envisagés pour dimi-
nuer le risque de transmission mère-enfant du VHB
en 2013 en France (5) :
➤
optimiser le suivi des recommandations en infor-
mant et en facilitant la transmission des informations
entre les différents acteurs de santé (sage-femme,
obstétricien, hépatologue, virologue, médecin géné-
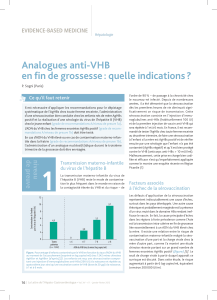
raliste, pédiatre, etc.) [fi gure] ;
➤
chez une femme enceinte AgHBs +, évaluer l’ADN
du VHB au sixième mois ; chez les femmes ayant
un ADN du VHB élevé (seuil à défi nir : 7 log UI/ml
peut-être), discuter la mise en route d’un traitement
par analogue au troisième trimestre de la grossesse.
Les 3 analogues ayant des données de sécurité suffi -
santes chez la femme enceinte sont la lamivudine, la
telbivudine et le ténofovir. L’arrêt de l’analogue après
l’accouchement dépendra de la gravité de l’atteinte
hépatique chez la mère (fi gure).
AgHBs au 6e mois
chez toute femme enceinte
(obligation)
AgHBs +
ADN-VHB – ADN-VHB +
< 107 UI/ml
ADN-VHB +
> 107 UI/ml
ADN-VHB à tester
(avant 3e trimestre)
Sérovaccination :
t*HBOUJ)#T6*ËMBOBJTTBODF
t7BDDJOBOUJ7)#ǃHËFUNPJT
Analogue anti-VHB
durant le 3e trimestre ?
(ténofovir-telbivudine-lamivudine)
Vaccination anti-VHB
recommandée chez les enfants
(calendrier vaccinal)
AgHBs –
Discussion collégiale
Figure. Arbre décisionnel du VHB au cours de la grossesse.
Références bibliographiques
1. European Association for the Study of the Liver. EASL Clinical
Guidelines: Management of chronic hepatitis B infection. J Hepatol
2012;57(1):167-85.
2. Braillon A, Nguyen-Khac E, Merlin J, Dubois G, Gondry J, Capron D.
HBsAg screening during pregnancy in the French province Picardy.
Gynecol Obstet Fertil 2010;38(1):13-7.
3. Wen WH, Chang MH, Zhao LL et al. Mother-to-infant transmission
of hepatitis B virus infection: signifi cance of maternal viral load and
strategies for intervention. J Hepatol 2013;59(1):24-30.
4. Sellier P, Maylin S, Moreno M et al. Vertical hepatitis B virus trans-
mission despite serovaccination of the newborn in highly viraemic
mono-infected mothers from various ethnic origins: a retrospective
study in Paris, France. J Hepatol 2013;58(Suppl.1):S175.
5. Bacq Y, Gaudy-Graffi n C. Prévention de la transmission mère-
enfant du virus de l’hépatite B : nouveaux concepts. Virologie
2013;17(4):243-52.
1
/
2
100%