Télécharger le PDF (français)

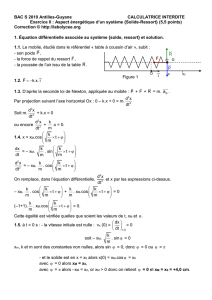
Clementia Pharmaceuticals ouvre un site d'essai clinique en Europe pour son
étude de phase 2 visant à évaluer l'effet du palovarotène chez des patients
souffrant de fibrodysplasie ossifiante progressive (FOP)
MONTRÉAL, 12 janvier 2015 – Clementia Pharmaceuticals, Inc. a annoncé aujourd'hui
l'ouverture d'un nouveau site à Paris (France) dans le cadre de l'étude clinique de phase 2
évaluant le palovarotène, principal produit candidat de la société pour le traitement de la
fibrodysplasie ossifiante progressive (FOP). La FOP est une maladie génétique rare, sévèrement
invalidante, caractérisée par des épisodes récurrents de tuméfactions douloureuses des tissus
mous (poussées) et l'apparition de nouvelles formations osseuses à des endroits anormaux. Ce
processus, connu sous le nom d'ossification hétérotopique (OH), survient dans les muscles, les
tendons et les ligaments, et est associé à une morbidité importante et une invalidité
progressive.
L'Hôpital Necker-Enfants Malades de Paris est le troisième site clinique ouvert pour l'étude de
phase 2 après l'Université de Californie à San Francisco (UCSF) et l'Université de Pennsylvanie à
Philadelphie. Le Dr Geneviève Baujat du Centre de référence de la dysplasie squelettique à
l'Institut Imagine, et de l'Hôpital Necker est l'investigatrice principale de l'étude pour le site de
Paris.
« Nous sommes ravis de mener cette importante étude visant à évaluer le palovarotène en tant
que traitement potentiel de la FOP », a déclaré le Dr Baujat. « Il n'existe actuellement aucun
traitement approuvé à l'intention des personnes atteintes de cette maladie sévèrement
invalidante qui entraîne souvent des complications mortelles. »
Lors d'études précliniques, le palovarotène est parvenu à prévenir la formation d'os
hétérotopiques chez des souris modèles de FOP. L'étude clinique de phase 2 en cours a été
conçue pour déterminer s'il est possible d'obtenir les mêmes effets chez des personnes
souffrant de FOP.
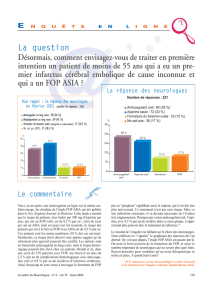
« Six patients ont été recrutés sur les deux sites aux États-Unis », a indiqué Jeff Packman,
directeur du développement de Clementia. « Le site d'essai clinique de Paris élargit la portée de
notre étude clinique de phase 2 visant à évaluer le palovarotène, ce qui facilite la participation
des patients européens éligibles atteints de cette maladie extrêmement rare et réduit les
déplacements qui pèsent sur les malades ».
Cette étude clinique de phase 2 en double aveugle, contrôlée contre placebo, évalue l'effet de
différentes doses de palovarotène sur les nouvelles formations osseuses observées pendant et
après une poussée chez 24 patients âgés d'au moins 15 ans. Le traitement sera initié dans les
sept (7) jours suivant la survenue des poussées et poursuivi pendant six (6) semaines. Les
patients continueront d'être suivis pendant six (6) semaines supplémentaires. L'efficacité et la
tolérance du traitement seront jugées sur la base d'examens d'imagerie visant à étudier les
nouvelles formations osseuses, d'évaluations cliniques de la fonction physique et des résultats

rapportés par les patients. Les patients allant jusqu'au bout de cette étude pourront participer
à une étude de prolongation ouverte au cours de laquelle du palovarotène leur sera administré
en cas de poussées ultérieures. La société prévoit d'achever l'étude de phase 2 en 2015.
« L'ouverture d'un nouveau site pour cette étude clinique est une bonne nouvelle pour les
malades européens désireux de participer à la recherche d'une option thérapeutique
potentielle pour cette terrible maladie », a précisé Antoine Lagoutte, membre de l'IPC de
l'association IFOPA IPC et de FOP France, association nationale œuvrant pour les personnes
souffrant de FOP.
Pour plus d'informations et pour obtenir des réponses aux questions fréquemment posées,
rendez-vous sur le site www.clementiapharma.com.
À propos de la fibrodysplasie ossifiante progressive (FOP)
La FOP est une myopathie congénitale rare, sévèrement invalidante, caractérisée par des
épisodes récurrents de tuméfactions douloureuses des tissus mous. Ces poussées transforment
les muscles, tendons et ligaments en os hétérotopique. Les poussées apparaissent tôt au cours
de la vie et peuvent survenir spontanément ou à la suite d'une blessure des tissus mous, d'une
vaccination ou d'une infection grippale. Les poussées récurrentes réduisent progressivement la
mobilité du patient en bloquant les articulations, menant ainsi à une perte de fonction
cumulative et une invalidité. La FOP est due à une mutation ponctuelle du gène ALK 2 qui code
le récepteur de la BMP de type I, laquelle entraîne une suractivité du récepteur. Pratiquement
tous les patients connus présentent la même mutation ponctuelle et une malformation
congénitale des gros orteils à la naissance. Selon les estimations, la FOP affecterait moins d'une
personne sur un million.
À propos du palovarotène
Le palovarotène est un agoniste du récepteur gamma de l'acide rétinoïque, exploité sous
licence de Roche Pharmaceuticals, où il a été précédemment évalué chez plus de 800 individus,
parmi lesquels des volontaires sains et des patients atteints de maladie respiratoire obstructive
chronique. Il a été démontré que le palovarotène bloque l'ossification dans plusieurs modèles
murins (souris) de la FOP et il est actuellement étudié comme traitement potentiel de cette
maladie.
À propos de Clementia Pharmaceuticals Inc.
Clementia est une société biopharmaceutique privée spécialisée dans les essais cliniques qui a
vocation à mettre au point et commercialiser des traitements innovants pour les personnes
atteintes de maladies rares. La société se concentre actuellement sur un nouvel agoniste du
récepteur gamma de l'acide rétinoïque afin de traiter des maladies liées à l'ossification
hétérotopique, notamment la fibrodysplasie ossifiante progressive. Pour plus de
renseignements veuillez consulter le site www.clementiapharma.com.
Investor/Media Contact:
Smitha Dwarakanath
SmithSolve LLC

+1-973-442-1555 poste 122
1
/
3
100%