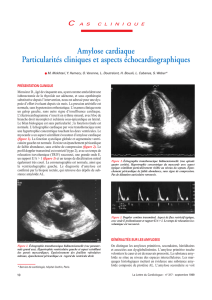
Les myocardiopathies restrictives D

La Lettre du Cardiologue - n° 312 - mai 1999
21
es myocardiopathies restrictives (MCR) sont des mala-
dies du myocarde caractérisées avant tout par une dys-
fonction diastolique : le remplissage ventriculaire est
anormal, en relation avec des parois ventriculaires particulière-
ment rigides, aboutissant à des volumes ventriculaires diasto-
liques souvent diminués (1, 2). La fonction ventriculaire systo-
lique est par contre normale, tout au moins au début de la maladie,
et l’épaisseur des parois ventriculaires est normale ou augmen-
tée selon la cause sous-jacente.
Il s’agit de la moins fréquente des trois principales catégories de
myocardiopathies (avec les myocardiopathies dilatées et hyper-
trophiques). C’est sans doute aussi la moins connue, en raison
non seulement de sa rareté mais également des difficultés parfois
rencontrées à établir le diagnostic et en raison de la multiplicité
des étiologies possibles, responsable de la grande hétérogénéité
clinique.
La présente revue s’efforcera de faire le point sur les données les
plus récentes, qui portent sur le diagnostic positif et différentiel
de la maladie et sur la meilleure connaissance des différentes
causes.
DOSSIER
Les myocardiopathies restrictives
●Ph. Charron*
*Service de cardiologie, CHU Pitié-Salpêtrière, Paris.
■Il s’agit de la moins fréquente des trois principales caté-
gories de myocardiopathies, et sans doute aussi de la moins
connue.
■
Le diagnostic positif et différentiel de la maladie est le
plus souvent rendu possible par l’examen échocardiogra-
phique couplé au doppler (analyse du flux mitral de rem-
plissage, du flux veineux pulmonaire ou sous-hépatique).
■Les étiologies sont variées et sont dominées, dans les
pays occidentaux, par l’amylose cardiaque (primitive le plus
souvent) et les formes idiopathiques.
■Le traitement est symptomatique et peu efficace, sauf
pour certaines étiologies qui bénéficient d’un traitement
spécifique (amylose familiale, hémochromatose).
POINTS FORTS
POINTS FORTS
L
Courbe de péricardite.

La Lettre du Cardiologue - n° 312 - mai 1999
22
DIAGNOSTIC POSITIF ET DIAGNOSTIC DIFFÉRENTIEL
En pratique, le diagnostic de MCR est habituellement évoqué
chez un patient présentant une poussée d’insuffisance car-
diaque, une fonction systolique normale ou proche de la normale,
des pressions de remplissage ventriculaire élevées, une absence
de dilatation ventriculaire. Le diagnostic positif est conforté par
divers examens paracliniques, invasifs ou non invasifs. En l’ab-
sence d’étiologie spécifique identifiée, le diagnostic différentiel
peut être délicat : d’une part avec certaines formes de myocar-
diopathie hypertrophique, lorsque l’hypertrophie est modérée ou
minime ; d’autre part avec la péricardite chronique constrictive
(tableau I), dont l’identification est pourtant d’une grande impor-
tance du fait des possibilités de traitement chirurgical dans ce
dernier cas (décortication péricardique).
Le symptôme majeur est la dyspnée
Le symptôme majeur est la dyspnée, qu’elle se manifeste à
l’effort, qu’elle soit paroxystique nocturne ou à type d’orthopnée.
Les douleurs angineuses sont rares en dehors du contexte d’amy-
lose. Les signes droits sont habituellement présents, avec œdème
des membres inférieurs, hépatomégalie, ascite, voire anasarque.
Dans les formes avancées, tous les signes de l’insuffisance car-
diaque globale peuvent se rencontrer. L’examen physique retrouve
la turgescence des veines jugulaires, avec un signe de Kussmaul
souvent présent (augmentation de la pression veineuse jugulaire
à l’inspiration). La radiographie thoracique montre une silhouette
cardiaque avec un rapport cardio-thoracique normal, parfois une
déformation liée à une dilatation des oreillettes. L’ECG peut mon-
trer un microvoltage, un axe gauche du QRS, une fibrillation auri-
culaire et des troubles de la conduction, dont des blocs auriculo-
venriculaires.
L’examen hémodynamique
La confirmation du diagnostic de MCR reposait classiquement
sur les résultats de l’examen hémodynamique. Il montre sur la
courbe de pression ventriculaire un syndrome caractéristique
d’adiastolie avec, en début de diastole, une chute rapide et pro-
fonde de la pression, suivie d’une remontée rapide, elle-même
suivie d’un plateau en diastole précoce (aspect en dip-plateau ou
en racine carrée).
Trois éléments orientent classiquement vers une MCR et non
une péricardite constrictive : une pression de remplissage ventri-
culaire gauche supérieure d’au moins 5 mmHg à celle du ventri-
cule droit ; une pression systolique du ventricule droit élevée
(50 mmHg) ; une pression ventriculaire diastolique (plateau)
inférieure au tiers de la pression systolique. Ces différents cri-
tères diagnostiques ont été évalués par Vaitkus et coll., qui retrou-
vent une bonne valeur prédictive globale de chacun de ces cri-
tères (70 à 86 %), avec cependant une performance meilleure
vis-à-vis de la péricardite chronique constrictive (PCC) (3).
Lorsque ces trois critères sont concordants, 90% des patients qui
peuvent être classés le sont correctement (un quart des patients
ne sont pas classés) (3). Parmi les autres paramètres hémodyna-
miques, citons l’existence de pressions artérielles pulmonaires
élevées, qui est en faveur d’une MCR. La biopsie endomyocar-
dique est parfois associée à l’examen hémodynamique et peut
s’avérer particulièrement utile en identifiant certaines causes de
MCR (amylose, hémochromatose, sarcoïdose, maladie de
Fabry...).
L’échographie-doppler
L’échographie-doppler a été largement étudiée ces dernières
années et de nombreux paramètres, en particulier doppler, per-
mettent désormais de suspecter très fortement le diagnostic de
MCR. L’échographie retrouve des cavités ventriculaires de
dimensions normales et de fonction contractile normale, des
parois d’épaisseur normale ou augmentée (amylose, infiltration),
et surtout une dilatation souvent franche des deux oreillettes.
L’analyse par doppler du flux de remplissage mitral objective un
profil “restrictif” (figure 1), avec typiquement une augmentation
de la vitesse du remplissage rapide (E 1 m/s), une diminution
de la vitesse du remplissage tardif (A 0,5 m/s), une augmenta-
tion du rapport E/A ( 2), une diminution du temps de décéléra-
tion de l’onde E ( 150 ms) et une diminution du temps de relaxa-
tion isovolumétrique ( 70 ms) (4). Les autres éléments qui
confortent le syndrome d’adiastolie reposent sur l’analyse du flux
veineux pulmonaire (avec amplitude de l’onde S < onde D) et du
flux pulmonaire (aspect de dip-plateau du flux d’insuffisance pul-
monaire).
DOSSIER
Examen Myocardiopathie restrictive Péricardite chronique
constrictive
Examen physique
signe de Kussmaul** parfois signe de Kussmaul souvent
choc de pointe palpable choc de pointe non palpable
B3, parfois B4
Radiographie thoracique
absence de cardiomégalie absence de cardiomégalie
dilatation auriculaire calcification péricardique
ECG
microvoltage, axe gauche, microvoltage
ac/fa, troubles de conduction
Échographie-doppler
dilatation bi-auriculaire marquée
faibles variations respiratoires fortes variations respiratoires
–TRIV et pic E < 15 % – TRIV et pic E > 25 %
–veine pulmonaire : – veine pulmonaire :
S/D < 0,65 et pic D < 40 % S/D 0,65 et pic D 40 %
DTI : ➴pic précoce diastolique DTI : pic précoce diastolique
normal
Hémodynamique
PtdVG / PtdVD > 5 mmHg PtdVG = PtdVD
P syst. VD 50 mmHg P syst. VD < 50 mmHg
P ventri. diastole < 1/3 syst. P ventri. diastole > 1/3 syst.
HTAP PAP normale
Scintigraphie
temps survenue du pic de temps de survenue 125 ms
vitesse du remplissage > 125 ms
fraction de remplissage à 70 % fraction 65 %
de la diastole : < 65 %
contribution auriculaire au contribution auriculaire < 30 %
remplissage : > 30 %
Scanner/IRM
épaisseur normale du péricarde épaisseur augmentée
Tableau I. Diagnostic différentiel entre la MCR et la PCC*.
*Adapté de (2).
** Signe de Kussmaul : augmentation de la pression veineuse jugulaire à l’inspiration.

La Lettre du Cardiologue - n° 312 - mai 1999
23
Le diagnostic différentiel entre la MCR et la PCC repose essen-
tiellement sur l’analyse des variations respiratoires des flux san-
guins. L’inspiration entraîne une diminution des pressions intra-
thoraciques, d’où une augmentation du retour veineux, avec par
conséquent une augmentation plus rapide des pressions de rem-
plissage du cœur droit. Dans la PCC, du fait des contraintes péri-
cardiques importantes (qui limitent l’expansion du ventricule
droit) et de l’augmentation de l’interdépendance VG-VD, l’ins-
piration va majorer le mouvement anormal du septum et limiter
plus précocement le remplissage du VG, aboutissant à une dimi-
nution des flux du cœur gauche. Dans la MCR, l’absence de
contrainte péricardique et la faible interdépendance VD-VG (du
fait d’un septum peu compliant) expliquent le peu de consé-
quences qu’a le cycle respiratoire sur le remplissage du ventri-
cule gauche. Les paramètres les plus utiles pour distinguer la
MCR de la PCC sont : le pic de l’onde E du flux mitral de rem-
plissage, la mesure du TRIV (temps de relaxation isovolumique)
et l’analyse du flux veineux pulmonaire en échographie transœ-
sophagienne. Dans la MCR, les variations respiratoires du pic de
l’onde E et du TRIV restent < 15 % (> 25 % dans la PCC : dimi-
nution du pic de E et augmentation du TRIV en inspiration) (5).
L’étude du flux veineux pulmonaire retrouve, de la même façon,
une variation modeste du flux diastolique dans la MCR
(moyenne 16 %) et notable dans la PCC ( moyenne 29 %) (6).
De plus, le rapport flux systolique/flux diastolique, mesuré en
inspiration ou bien en expiration, est plus élevé dans la PCC
(moyenne 0,9) que dans la MCR (moyenne 0,4). Parmi les autres
données, citons l’analyse du flux veineux sus-hépatique, qui per-
met également de suspecter une MCR devant une onde S très
diminuée, voire inversée (se majorant en inspiration). Enfin, la
plus intéressante des études échographiques récentes est sans
doute celle de Garcia et coll., qui a étudié par doppler tissulaire
(DTI) deux groupes de patients (MCR, PCC) ainsi que des sujets
contrôles (7). L’hypothèse sous-jacente, qui s’est vérifiée, était
que la dysfonction diastolique de la MCR résultait d’une atteinte
intrinsèque du myocarde, alors que celle de la PCC résultait d’une
cause extrinsèque. Le paramètre étudié était la mesure du pic pré-
coce de vélocité diastolique de l’axe longitudinal du cœur (volume
d’échantillonnage sur la partie latérale de l’anneau mitral). Il s’est
avéré très abaissé dans le groupe MCR (5,1 ± 1,4 m/s), alors que
dans le groupe PCC, il était comparable à celui du groupe contrôle
(14,8 ± 4,8 versus 14,5 ± 4,7).
Enfin, d’autres examens peuvent aider au diagnostic différentiel,
comme la scintigraphie myocardique (temps au “peak filling
rate”, pourcentage du remplissage qui se fait dans la première
partie de la diastole, contribution auriculaire au remplissage) (8),
le scanner ou l’imagerie par résonance magnétique (IRM), en
analysant l’épaisseur du péricarde (normale dans les MCR), ou
bien encore l’analyse de la réserve coronaire (décélération du flux
diastolique) (9).
DOSSIER
onde E
onde A
onde E
onde A
onde A onde A
onde S
TRIV
TDE
TRIV
TDE
onde D onde S
onde D
Flux mitral
Flux veineux pulmonaire
Profil normal Syndrome restrictif
Figure 1. Analyse par doppler du flux de remplissage mitral.
.../...


L’évolution est variable, en particulier selon l’étiologie sous-
jacente. Le pronostic est cependant globalement mauvais à par-
tir du moment où les symptômes apparaissent, avec une évolu-
tion progressive vers l’insuffisance cardiaque réfractaire. Le
traitement est le plus souvent uniquement symptomatique, et par-
fois de maniement difficile (amylose).
FORMES ÉTIOLOGIQUES
Les causes de MCR sont très variées (tableau II), mais les étio-
logies sont dominées dans les pays occidentaux par l’amylose, et
dans les pays tropicaux, par la fibrose endomyocardique.
Amylose cardiaque
Des progrès ont été récemment réalisés dans la connaissance des
différentes étiologies d’amylose et aussi dans la prise en charge
thérapeutique, qui diffère selon la cause sous-jacente. Parmi les
très nombreuses formes d’amylose humaine, celles qui impliquent
le cœur sont nettement dominées par l’amylose primitive (AL)
liée à un dépôt de chaînes légères d’immunoglobuline, habituelle-
ment en rapport avec un myélome multiple. Les deux autres types
d’amylose cardiaque sont l’amylose familiale et l’amylose sénile.
L’amylose familiale se transmet selon un mode autosomique
dominant. Elle associe une localisation cardiaque (inconstante et
souvent tardive après l’âge de 35 ans) et surtout des signes de
neuropathie périphérique (avec une atteinte fréquente du système
nerveux autonome). Le gène responsable code pour la transthy-
rétine (TTR) (10), anciennement appelée préalbumine, protéine
synthétisée par le foie et transportant la thyroxine et le rétinol
dans la circulation sanguine. Plus de 50 mutations ont été iden-
tifiées. Il s’agit de mutations faux-sens, dont la plus fréquente est
la TTR Met30. La fréquence de ce type d’amylose était large-
ment sous-estimée jusqu’alors, et toute amylose cardiaque non
associée à des dépôts de chaînes légères doit faire rechercher une
amylose génétique, car les signes de neuropathie sont parfois
frustes et le contexte familial pas toujours identifié. La confir-
mation du diagnostic se fait par immunohistochimie du tissu biop-
sié (anticorps anti-TTR) ou par identification de la mutation dans
le gène TTR. Bien établir le diagnostic est important puisque l’on
dispose d’un traitement efficace (même s’il est lourd) : la trans-
plantation hépatique (± associée à une greffe cardiaque).
L’amylose sénile, quant à elle, est rarement identifiée du vivant
du patient. Elle ne comporte pas de manifestations extracar-
diaques. Elle est due à des dépôts de facteur atrial natriurétique
et de transthyrétine (non mutée) ; il n’existe pas de traitement
efficace.
Le diagnostic d’amylose cardiaque primitive (AL) est évoqué
devant les manifestations systémiques de la maladie et l’aspect
échographique du cœur (hypertrophie importante, texture myo-
cardique brillante et granitée, épaississement du septum interau-
riculaire...). La confirmation est donnée par la biopsie (graisse
abdominale, rectum, gencive, endomyocarde...), qui retrouve la
substance amyloïde (avec typage par immunohistochimie), et par
l’identification d’une gammapathie monoclonale. Cette amylose
est caractérisée par un pronostic excessivement péjoratif, avec
une médiane de survie d’environ un an (11), et même inférieure
à 6 mois une fois les symptômes cardiaques survenus (12).
Outre le stade NYHA, divers paramètres échographiques se sont
révélés comme de bons marqueurs pronostiques : le pronostic est
d’autant plus péjoratif que l’épaisseur des parois VG est impor-
tante (médiane de survie : 0,4 an si 15 mm versus 2,4 ans si
12 mm) (11), que la fraction de raccourcissement est abaissée,
que le flux de remplissage mitral est de type restrictif, avec un
temps de décélération de l’onde E court (49 % de survie à un an
si TDE 150 ms versus 92 % si > 150 ms) ou un rapport E/A
élevé (> 2,1) (13).
Les modalités thérapeutiques sont difficiles avec un traitement
symptomatique de maniement délicat, en raison des hypotensions
artérielles fréquente sous diurétiques ou vasodilatateurs, et de fré-
quents troubles de la conduction ou du rythme sous digitaliques.
Le traitement spécifique fait appel à la chimiothérapie par mel-
phalan et prednisone, en plus de la colchicine. Son efficacité est
maintenant démontrée dans l’amylose systémique (12, 14). L’ef-
ficacité est plus discutée en présence d’une localisation cardiaque,
démontrée (12) ou non démontrée (14), et la survie reste de toute
façon très réduite chez ces patients. La transplantation cardiaque
apparaît contre-indiquée en raison de récidives sur le greffon et
surtout de la progression de la maladie dans les autres localisa-
tions, expliquant une survie réduite (39 % à 48 mois) (15). Les
espoirs actuels reposent sur l’autogreffe de moelle, après condi-
tionnement par melphalan, qui nécessite une évaluation plus
approfondie.
La Lettre du Cardiologue - n° 312 - mai 1999
25
DOSSIER
1. Maladies myocardiques
❏Non infiltratives
Myocardiopathies idiopathiques* (familiales ou non)
Connectivites (sclérodermie*)
Myocardiopathie diabétique
Pseudo-xanthome élastique
❏Infiltratives (acquises)
Amylose*
Sarcoïdose*
❏Par surcharge (congénitales)
Hémochromatose*
Maladie de Fabry (sphingolipidose)
Maladie de Gaucher (glucocérébrosidose)
Maladie de Hurler (mucopolysaccharidose)
Glycogénoses
2. Maladies endomyocardiques
Fibrose endomyocardique* et syndrome hyperéosinophilique
Syndrome carcinoïde
Radiothérapie médiastinale
Toxicité médicamenteuse
(anthracyclines*, dérivés ergot de seigle, sérotonine, busulfan).
Tableau II. Classification des causes de myocardiopathie restrictive.
Adapté de (2).
*Désigne les pathologies les plus fréquentes.
.../...
 6
6
 7
7
 8
8
 9
9
1
/
9
100%