Lire l'article complet

La Lettre du Cardiologue - n° 358 - octobre 2002
es Journées nationales de la SFC ont eu lieu à Mont-
pellier les 7 et 8 juin 2002, dans un cadre toujours
aussi convivial, grâce au travail de J.M. Davy,
F. Leclercq et P. Messner Pellenc. Cette réunion regroupait des
conférences, des sessions thématiques, des symposiums et des
ateliers pratiques.
Sessions thématiques
FIBRILLATION AURICULAIRE
La fibrillation auriculaire (FA) expose aux accidents thrombo-
emboliques artériels, surtout si le sujet est âgé, hypertendu ou
diabétique. Le bénéfice du traitement anticoagulant, et à moindre
degré de l’aspirine, n’est plus à démontrer. Est-il possible de pré-
venir la FA par d’autres moyens que les médicaments, et notam-
ment par la stimulation auriculaire ? C’est ce que F. Anselme
(Rouen) a analysé pour nous.
L’étude de la prévention de la FA pose des problèmes métho-
dologiques concernant :
–la sélection des patients (bradyarythmie ou tachyarythmie, FA
isolée ou non, FA symptomatique ou non) ;
–les caractéristiques des études (randomisée, en cross-over, trai-
tement médical associé) ;
–les critères d’évaluation primaires :
●récidives de FA paroxystique : nombre d’épisodes, durée
totale en FA,
●évolution vers la FA permanente,
●les outils d’évaluation : symptômes (palpitations), ECG, hol-
ter ECG, transmission téléphonique de l’ECG, interrogation
des mémoires de stimulateur.
Si l’on sélectionne les études contrôlées, faut-il préférer une sti-
mulation atriale ou une stimulation DDD conventionnelle ?
L’étude danoise (Andersen, Lancet 1997) a exploré la stimula-
tion VVI versus la stimulation AAI. Dans cette population, il y
avait 42 % de maladies rythmiques auriculaires et, dans ce cas,
la stimulation auriculaire est préférable.
La stimulation auriculaire diminue l’incidence de FA avec des
courbes qui commencent à diverger à deux ans dans l’étude de
Connolly et al. (N Engl J Med 2000 ; 342 : 1385). L’effet est plus
marqué si la fréquence cardiaque est inférieure à 60 batte-
ments/mn. Au contraire, dans l’étude de Gillis et al. (Circulation
1999), il n’y a pas de bénéfice à stimuler l’oreillette (pas de dif-
férence significative).
Plusieurs travaux se sont intéressés aux algorithmes de préven-
tion. L’étude ADOPT a évalué la charge en FA, ou plus exacte-
ment le pourcentage de jours où la FA était symptomatique. Les
patients soumis à un algorithme d’over driving sont significati-
vement plus stimulés. La charge en FA diminue au fil du temps
et elle est moindre lorsque l’over driving est en route.
Dans l’étude AF THERAPY phase III, l’objectif primaire était le
nombre de jours en FA documentée obtenus par mémoire du sti-
mulateur. Il y a eu une diminution significative de la charge en
FA et une augmentation de la durée moyenne en rythme sinusal.
Au contraire, l’étude PIPAF n’a pas trouvé d’effet significatif
(Mabo, 2002).
Différents sites de stimulation dans l’oreillette ont été étudiés,
notamment la stimulation du septum interauriculaire et celle de
sites multiples. Avec la stimulation du faisceau de Bachman, le
délai avant l’apparition de la FA est plus long, de même qu’avec
la stimulation interauriculaire. Avec la stimulation multisite
(Synbiapace), le délai sans arythmie est plus long lorsqu’on sti-
mule les deux oreillettes. L’étude DAPPAF (Saksena, 2001)
montre également un bénéfice avec une diminution des épisodes
de FA symptomatique.
Conclusion
✔S’il existe une dysfonction sinusale ou une maladie rythmique
auriculaire, il est conseillé de stimuler l’oreillette gauche (selon
l’étude danoise).
✔Si la probabilité de stimuler est élevée, il faut préférer le mode
qui préserve la synchronie auriculo-ventriculaire (selon l’étude
CTOPP).
✔S’il y a une indication de stimulation et des antécédents de FA,
il est préférable d’implanter une sonde atriale bipolaire au niveau
du septum. Faut-il envisager d’implanter une prothèse douée
d’algorithmes spécifiques de prévention (et éventuellement de
réduction) ? La question reste ouverte.
INFORMATIONS
Journées nationales
de la Société française
de cardiologie
17
L
* Service de cardiologie, hôpital Bichat, 75018 Paris.
** Service de cardiologie, hôpital Lariboisière, 75010 Paris.
●M.C. Aumont*, P. Henry**

La Lettre du Cardiologue - n° 358 - octobre 2002
18
STIMULATION MULTISITE DANS L’INSUFFISANCE CAR-
DIAQUE
C. Leclercq (Rennes) a passé en revue les essais de stimulation
multisite dans l’insuffisance cardiaque sévère. Les indications
validées à l’heure actuelle sont l’insuffisance
cardiaque réfractaire en classe III ou IV de
la NYHA malgré un traitement médical opti-
mal, avec une fraction d’éjection ventricu-
laire gauche inférieure à 35 %, et une durée
de QRS supérieure à 130 ms, tout en sachant
que l’ECG de surface n’est pas le meilleur
outil pour apprécier la dysynchronie ventri-
culaire. Les critères obtenus avec l’IRM, les
isotopes et surtout l’échographie doppler
(DTI notamment) sont en cours de valida-
tion. Pour que cette technique apporte un
bénéfice, il faut qu’il y ait un réel asynchro-
nisme ventriculaire gauche, que l’implanta-
tion soit faite au site optimal, que les délais
auriculo-ventriculaires et intraventriculaires
soient optimisés. Les patients insuffisants
cardiaques, notamment ischémiques, sont
exposés au risque de mort subite et, chez eux,
l’association resynchronisation et défibrilla-
tion se discute de plus en plus. Les perspec-
tives sont d’arriver à une définition consen-
suelle des patients répondeurs à cette
thérapeutique.
CARDIOPATHIES ET GROSSESSE
Les groupes “échocardiographie” et “valvu-
lopathies” de la SFC ont organisé une séance
très intéressante sur ce thème.
Cardiopathies valvulaires
B. Iung (Paris) a traité le problème des car-
diopathies valvulaires. Il a rappelé les princi-
pales modifications physiologiques consta-
tées au cours de la grossesse : le volume
sanguin augmente d’environ 50 %, les pres-
sions artérielles systolique et diastolique
diminuent par abaissement des résistances
artérielles (rôle des hormones ovariennes et
de la circulation fœto-placentaire) et le débit
cardiaque augmente de 30 à 50 %. Il est au
maximum entre le 5eet le 8emois. Durant le
travail, la consommation d’oxygène (VO2)
augmente, de même que le débit cardiaque de
base. Le débit cardiaque et la pression arté-
rielle augmentent lors des contractions uté-
rines. En post-partum, il y a augmentation du retour veineux, des
pressions de remplissage et du débit cardiaque.
Valvulopathies régurgitantes. Elles entraînent une surcharge
volumétrique, mais aussi une baisse des résistances vasculaires ;
en outre, la tachycardie diminue la régurgitation aortique. En cas
d’insuffisance mitrale, il y a un risque de majoration des troubles
du rythme, s’il existe un prolapsus valvulaire mitral par exemple.
En cas d’insuffisance aortique, il faut analyser avec soin l’aorte,
à la recherche d’un syndrome de Marfan. Le traitement fait appel
aux diurétiques, éventuellement aux digitaliques. Quant aux vaso-
dilatateurs, les inhibiteurs de l’enzyme de conversion et les anta-
gonistes des récepteurs de l’angiotensine sont contre-indiqués.
De manière générale, il ne faut pas opérer ces valvulopathies
fuyantes pendant la grossesse.
Rétrécissement mitral. Il y a augmentation de la volémie, du
débit cardiaque et de la fréquence cardiaque, entraînant une mau-
vaise tolérance et un risque d’OAP mettant en jeu le pronostic
maternal et fœtal. Le risque est maximal lors du 3etrimestre et
durant le post-partum. Parfois, l’intervention devient nécessaire.
Le traitement médical fait appel aux bêtabloquants surtout, et aux
diurétiques. La chirurgie peut être une commissurotomie à cœur
fermé éventuellement (la létalité fœtale est de 2 à 10 %). En cas
de commissurotomie à cœur ouvert ou de remplacement valvu-
laire mitral, le risque fœtal est lié à la circulation extracorporelle
(la létalité est de 20 à 30 % et il y a une souffrance aiguë du fœtus).
La commissurotomie mitrale percutanée est la dernière éventua-
lité et pose le problème de la tolérance maternelle et fœtale. Grâce
à des mesures particulières, notamment diminution de la durée
de la procédure (intérêt du ballon d’Inoue), suppression de la gra-
phie, du cathétérisme droit et de l’injection iodée, utilisation d’un
tablier de plomb abdominal, irradiation la plus faible possible, ce
geste peut être proposé en cours de grossesse. Sur un groupe d’une
trentaine de patientes, l’irradiation a été inférieure à 0,2 millisi-
vert alors que la dose maximale tolérée chez la femme enceinte
est de 5 millisiverts aux États-Unis. Cette valvuloplastie com-
porte toutefois un risque d’accident ischémique transitoire ou
d’accident vasculaire cérébral. Si elle entraîne une fuite mitrale,
celle-ci est mal tolérée et nécessite un remplacement valvulaire
mitral avec ses risques. Cela justifie de réserver les indications
de valvuloplastie percutanée aux femmes qui demeurent symp-
tomatiques sous traitement médical durant la grossesse.
Rétrécissement aortique. La cause est en général une bicuspi-
die ou un RA congénital. La grossesse est bien tolérée si la sur-
face est supérieure à 1 cm2. Une surface inférieure à 1 cm2ou un
gradient moyen supérieur à 50 mmHg font courir un risque sur-
tout à l’accouchement, la décompensation en fin de grossesse
étant rare. Certains discutent une dilatation percutanée. Mais le
traitement est avant tout préventif.
Les recommandations en cas de maladie de Marfan sont d’éva-
luer le diamètre aortique avant la grossesse. S’il est inférieur à
40 mm au niveau du sinus de Valsalva et qu’il n’y a pas d’insuf-
fisance aortique, le risque est faible. S’il est supérieur à 40 mm
ou s’il existe une insuffisance aortique, la grossesse est décon-
seillée. Il faut répéter les échocardiogrammes à 3, 6, 7, 8 et 9 mois
et un mois après l’accouchement. Les bêtabloquants sont systé-
matiques. L’accouchement se fera par voie basse, seulement si le
diamètre est inférieur à 40 mm. Dans les autres cas, la césarienne
se fera à 38 semaines.
Cardiopathies opérées. Elles ont un bon pronostic hémodyna-
mique. Le principal problème est la prothèse mécanique sous anti-
INFORMATIONS

La Lettre du Cardiologue - n° 358 - octobre 2002
19
vitamines K car il y a un risque d’embryopathie (d’environ 5 %)
et d’avortement au premier trimestre (surtout de 6 à 12 semaines).
L’héparine augmente le risque thromboembolique par rapport aux
antivitamines K. Actuellement, il n’y a pas de consensus pour le
traitement anticoagulant du premier trimestre, car il n’y a pas de
solution idéale. Chez la femme jeune, les meilleurs substituts sont
donc la bioprothèse et l’homogreffe.
Dans tous les cas, il faut programmer l’accouchement, si possible
par voie basse, en limitant la durée du travail et en faisant une
antibioprophylaxie en cas de prothèse.
En conclusion, il faut évaluer toute valvulopathie chez la femme
jeune, discuter un traitement préventif s’il existe un rétrécisse-
ment mitral inférieur à 1,5 cm2,un rétrécissement aortique infé-
rieur à 1 cm2,et éviter une prothèse mécanique. Lorsque la val-
vulopathie n’a pas été corrigée, il faut surveiller avec soin à partir
du 2etrimestre une valvulopathie sténosante et rester conserva-
teur sur les valvulopathies fuyantes. Enfin, une collaboration mul-
tidisciplinaire s’impose à tous les stades.
Cardiopathies congénitales
Y. Bernard (Besançon) a évoqué le problème des cardiopathies
congénitales opérées et non opérées. Il est des situations faciles
où la grossesse est autorisée. Ce sont les cardiopathies bénignes
ou opérées sans séquelle, telles que communication interventri-
culaire, communication interauriculaire opérée ou non. Pour le
canal atrio-ventriculaire complet ou partiel, il faut exclure une
hypertension artérielle pulmonaire et d’éventuelles malforma-
tions associées. En cas de sténose pulmonaire serrée, une dilata-
tion percutanée ou une chirurgie infundibulaire peuvent s’envi-
sager. En cas de tétralogie de Fallot opérée, il y a un risque de
troubles du rythme tardifs. Après chirurgie “moderne” des car-
diopathies complexes, telle que la correction anatomique de la
transposition des gros vaisseaux (switch) ou l’intervention de
Ross, la grossesse est autorisée. Il y a d’autres situations faciles
où elle ne l’est pas. Ce sont le syndrome d’Eisenmenger avec
hypertension artérielle pulmonaire fixée sur shunt non opéré, ou
l’hypertension artérielle pulmonaire primitive ou secondaire. Le
risque est maximal dans le mois suivant l’accouchement.
Il est des situations plus difficiles, comme le syndrome de
Marfan, où le risque de dissection aortique existe surtout dans le
post-partum. Dans les autres cardiopathies, complexes ou non,
on manque d’expérience.
En conclusion, la décision doit être personnalisée et fondée sur
l’état fonctionnel, la fonction du ventricule systémique, l’exis-
tence de fuite et/ou d’obstacle valvulaire, de troubles du rythme,
des traitements indispensables, de la patiente et du contexte.
Myocardiopathies hypertrophiques et dilatées
P. Messner Pellenc (Montpellier) a abordé la question des myo-
cardiopathies hypertrophiques et dilatées.
En cas de cardiomyopathie hypertrophique, les facteurs prédic-
tifs échographiques de complications cardiaques sont un gradient
intraventriculaire gauche supérieur à 30 mmHg et un aspect res-
trictif du flux mitral. Pour les cardiomyopathies dilatées, les fac-
teurs prédictifs échographiques sont une fraction d’éjection ven-
triculaire gauche inférieure à 40 %. Un score a été proposé (Siu,
Circulation 1997) : s’il y a 0 point, le risque de complication
maternel est de 5 % ; s’il y a 2 points, il passe à 75 %.
Les cardiomyopathies du péri-partum surviennent durant le der-
nier mois de la grossesse ou les cinq premiers mois après l’ac-
couchement et se définissent par une fraction d’éjection ventri-
culaire gauche inférieure à 40 %. Le pronostic est grave, et il
s’agit d’une forme sévère si le diamètre télédiastolique ventricu-
laire gauche est supérieur ou égal à 60 mm et la fraction de rac-
courcissement inférieure à 21 %. Mais il peut y avoir une amé-
lioration échographique dans les six mois, et 10 à 20 % des
patientes récupèrent complètement. Il est difficile de prédire si
une nouvelle grossesse entraînera les mêmes troubles. Peut-être
est-ce là l’indication d’une échographie de stress.
Pour terminer, nous mentionnerons que C. Almange (Rennes) a
fait une conférence tout à fait intéressante sur le thème de “La
découverte fœtale des malformations cardiaques. Incidences
éthiques et pratiques”. M.C. Aumont
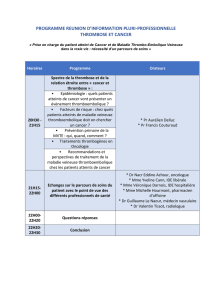
Symposiums
SYMPOSIUM SANOFI-SYNTHELABO
Nouveautés dans la prise en charge de la maladie
thromboembolique veineuse (MTEV)
J.F. Schved (Montpellier) a insisté sur les nouveaux facteurs de
risque et sur leur prévalence respective (tableau I). La thrombo-
philie est un état prédisposant aux thromboses. Les causes peu-
vent être congénitales (déficits ou anomalies des systèmes inhi-
biteurs de la coagulation) ou acquises (anticorps antiphospholipides
ou anticardiolipides). Le dosage de l’homocystéine est encore
assez délicat. L’augmentation d’homocystéine peut être liée à une
carence en acide folique ou en vitamine B6, et plus rarement,
à une mutation sur le gène de l’homocystéine (MTH FR).
Il faut s’interroger sur le coût/bénéfice du bilan étiologique en cas
de thrombose veineuse. Bien qu’il n’y ait pas de consensus, on peut
proposer un bilan plus ou moins approfondi (tableau II) et une
exploration plus systématique de certains patients (tableau III),
tout en ne perdant pas de vue l’exploitation du résultat.
INFORMATIONS
RR Prévalence (%) TVP (%)
PC, PS, AT 6-10 < 1 5
R 506 Q 3-8 5 20
G 20210 A 2,8 6-7 ?
Tableau I. Prévalence de la thrombose veineuse profonde (TVP) et des
nouveaux facteurs de risque (déficits en facteurs de coagulation, muta-
tion sur un gène).
PC : protéine C, PS : protéine S, AT : antithrombine III.
R 506 Q : mutation sur le gène du facteur V (facteur Leyden).
G 20210 A : mutation sur le gène du facteur II (prothrombine).

S. Kownator (Thionville) a montré la place de plus en plus grande
de l’écho-doppler veineux, examen éminemment opérateur-
dépendant. Globalement, cet examen a une sensibilité de 95 % et
une spécificité de 98 %. Deux stratégies se discutent en termes
de rapport coût/efficacité, celle portant sur une compression éta-
gée : veine fémorale commune, veine poplitée haute, veine popli-
tée basse (américaine), et celle explorant tout l’axe veineux (euro-
péenne). Le signe cardinal est l’incompressibilité veineuse sous
la sonde. Dans certains cas particuliers, l’examen peut montrer
un caillot flottant, l’extension d’une thrombose superficielle, une
thrombose cave. En cas de diagnostic positif, il est recommandé
de ne faire un écho de contrôle que 4 à 6 semaines après l’épi-
sode aigu.
En conclusion, l’écho-doppler veineux est une méthode de choix.
Il doit être rapide, la suspicion d’une thrombose veineuse devant
faire doser les D-dimères, et mettre en route un traitement par
HBPM, maintenu ou non selon la confirmation du diagnostic.
F. Parent (Clamart) a évoqué la stratégie actuelle du diagnos-
tic de l’embolie pulmonaire (EP), en insistant d’emblée sur la
faible rentabilité diagnostique de la scintigraphie pulmonaire (de
30 à 50 % selon les séries) et sur les limites de l’angiographie
pulmonaire (examen invasif, moindre disponibilité). L’examen
clinique reste essentiel pour définir la probabilité clinique, même
si aucun signe clinique n’est spécifique. En cas de forte probabi-
lité (un facteur de risque, tableau évocateur, absence d’autre dia-
gnostic), 65 à 70 % des patients auront une EP confirmée. En cas
de faible probabilité (signes cliniques et examen compatible, mais
pas de facteur de risque), seuls 10 à 15 % des patients auront une
EP, chiffre bien sûr trop élevé, mais dont le rendement peut être
amélioré grâce aux tests diagnostiques actuels.
✔Un taux de D-dimères inférieur à 500 µg/l a une valeur pré-
dictive négative de 99 %, mais un taux supérieur n’a aucune valeur
(taux élevé au-delà de 80 ans et en cas de comorbidité).
✔L’échographie veineuse des membres inférieurs, examen
simple et d’accès facile, a une place importante dans le diagnos-
tic d’EP. Il a une bonne spécificité, mais est peu sensible (en cas
d’EP avérée, l’échographie ne trouve une thrombose veineuse
[TV] que dans 30 à 50 % des cas). L’angioscanner hélicoïdal se
développe depuis une dizaine d’années. Il a une bonne spécifi-
cité jusqu’au niveau segmentaire, mais une sensibilité très variable
selon les séries (environ 85 %). Il ne permet pas à lui seul d’ex-
clure le diagnostic d’EP.
✔Une scintigraphie pulmonaire de ventilation/perfusion nor-
male permet d’éliminer une EP (risque d’événement thrombo-
embolique inférieur à 1 % dans les trois mois). Une scintigraphie
de haute probabilité (au moins deux défects segmentaires de per-
fusion avec une ventilation normale) a une valeur prédictive posi-
tive de 90 %. La scintigraphie reste non diagnostique dans 50 à
70 % des cas selon les séries. Ainsi, aucun des tests diagnostiques
ne doit être utilisé seul. Il semble logique de choisir les examens
en fonction de la probabilité clinique (tableau IV).
L’étude française multicentrique ESSEP, faite chez 1 041 patients
suspects d’EP, montre que l’association échographie veineuse
normale-angioscanner normal chez des patients non hospitalisés
ayant une probabilité clinique moyenne d’EP permet d’éliminer
ce diagnostic.
En cas de suspicion d’EP grave, le diagnostic est souvent plus
simple. L’écho-doppler cardiaque et l’angioscanner sont les
meilleurs examens.
I. Quéré (Montpellier) a rappelé les certitudes actuelles et les
interrogations sur le niveau et la durée du traitement anticoa-
gulant. Le niveau d’anticoagulation optimale est validé : TCA
entre 1,5 et 2,5 fois le témoin, INR entre 2 et 3, sauf en cas de
cancer évolutif ou de syndrome des antiphospholipides (où un
niveau plus élevé est justifié). La durée optimale d’anticoagula-
La Lettre du Cardiologue - n° 358 - octobre 2002
20
INFORMATIONS
Première intention
✔AT, PC, PS, F VIII, TP, TCA
✔biologie moléculaire : mutation R 506 Q
mutation G 20210 A
✔syndrome des antiphospholipides : lupus anticoagulant
AC anticardiolipides
Deuxième intention
✔homocystéine - mutation C 677 T (MTH FR)
✔contrôle F VIII à 3 mois si > 150 %
✔contrôle lupus anticoagulant
AC anticardiolipides
✔autres facteurs : F IX, F X, fibrinogène
Tableau II. Quel bilan en cas de maladie thromboembolique veineuse ?
AT, PC, PS : mêmes légendes que tableau I ; AC : anticorps.
Indication reconnue
✔thromboses veineuses : ≥2
✔1 TVP + antécédent familial
✔sujet < 45 ans et TV spontanée ou siège atypique
Indication discutée
✔TVP et sujet < 45 ans
✔TV spontanée ou siège atypique, quel que soit l’âge
✔sujet asymptomatique, mais antécédent familial et situation
à risque
Tableau III. Quels patients explorer ?
TVP : thrombose veineuse profonde. Faible probabilité clinique
✔D-dimères
✔scintigraphie pulmonaire
Forte probabilité clinique
✔échographie veineuse
✔angioscanner hélicoïdal
Tableau IV. Choix des examens pour le diagnostic de maladie throm-
boembolique veineuse.
MTEV : maladie thromboembolique veineuse.

La Lettre du Cardiologue - n° 358 - octobre 2002
21
tion varie de 6 semaines à 6 mois. Elle dépend de l’existence d’un
facteur de risque réversible ou non, de la localisation de la mala-
die thromboembolique (thrombose veineuse proximale ou embo-
lie pulmonaire versus thrombose veineuse distale) et du risque
hémorragique (3 à 4 % d’hémorragies majeures par an, 0,5 à 1 %
de décès par hémorragie, avec des taux plus élevés chez les per-
sonnes âgées). Elle pose la question de savoir si le traitement anti-
coagulant est “suspensif” et non curatif. Les principaux facteurs
de risque hémorragique restent l’antécédent d’hémorragie diges-
tive et l’âge. Un patient pourra bénéficier d’un traitement anti-
coagulant prolongé au-delà de 6 mois, si le risque thrombotique
est supérieur à 10 % par an ou le risque hémorragique inférieur
à 3 %. Le tableau V résume les recommandations actuelles.
Les HBPM ont pris une place majeure, en permettant le traite-
ment ambulatoire de la maladie thromboembolique veineuse. De
nouveaux antithrombotiques à mécanisme d’action ciblée arri-
vent, intéressant aussi bien la pathologie thrombotique veineuse
que la thrombose coronaire. Peut-être une nouvelle révolution
thérapeutique nous attend-elle demain. En cas de contre-indica-
tion aux antivitamines K, l’emploi prolongé d’HBPM (versus
l’interruption temporaire ou définitive de la veine cave inférieure)
peut se discuter.
P. Mismetti (Saint-Étienne) a mis en exergue l’importance des
études de relation dose/effet (phase II b) afin de choisir la dose
“optimale”. Si la plage de dose retenue est trop étroite, cela peut
rendre difficile le choix de la dose pour la phase III. La seconde
difficulté concerne le choix du critère d’évaluation. Si la mise
en évidence de TVP par phlébographie a été un bon critère de
substitution, les critères utilisés actuellement (ceux apportés par
l’écho-doppler veineux ou la scintigraphie pulmonaire) sont
moins bien validés.
Le pentasaccharide (fondaparinux, Arixtra®) a été étudié versus
l’énoxaparine en prévention de la thrombose veineuse postopé-
ratoire et donne des résultats intéressants. Il a une demi-vie longue
et autorise une injection sous-cutanée tous les deux jours. Ce pro-
duit est en cours de développement aussi bien dans la pathologie
veineuse que coronaire (étude PENTUA). Ainsi la classe des anti-
thrombotiques est-elle en plein renouvellement, et il faut se mettre
dans les meilleures conditions pour accroître les chances de suc-
cès en phase III.
SYMPOSIUM ASTRAZENECA
✔Le traitement bêtabloquant dans l’insuffisance cardiaque :
de l’évidence à la pratique en 2002
✔Faut-il traiter par statines tous les patients à risque vasculaire ?
A. Hjalmarson (Göteborg) a rappelé les trois grandes études
montrant le bienfait des bêtabloquants dans l’insuffisance
cardiaque : CIBIS II avec le bisoprolol, MERIT HF avec le méto-
prolol CR/XL, COPERNICUS avec le carvédilol, et notamment
l’effet sur la mortalité totale et la mortalité subite. Dans l’étude
MERIT HF par exemple, ayant recruté 3 991 patients avec insuf-
fisance cardiaque en classe fonctionnelle II à IV de la NYHA et
une fraction d’éjection inférieure ou égale à 40 %, il y a eu au
total 362 décès (145 sous métoprolol, 217 sous placebo dont 211
décès subits avec une réduction de la mortalité subite de 41 %).
Les patients âgés sont plus sensibles au traitement bêtabloquant.
Dans ce travail où les patients inclus étaient âgés de 40 à 80 ans,
il a suffi d’une dose moyenne de métoprolol de 76 mg par jour
chez les patients les plus âgés pour diminuer la fréquence car-
diaque à 67/mn, alors que cette même fréquence était obtenue
chez les plus jeunes pour une dose moyenne de 192 mg par jour.
Ainsi, des doses plus faibles de bêtabloquant chez les personnes
âgées sont aussi efficaces, et la fréquence cardiaque est un excel-
lent paramètre de suivi.
Les deux points essentiels à observer sont de commencer le bêta-
bloquant à faible dose et de l’augmenter très progressivement.
Par exemple, avec le bisoprolol, il faut commencer à 1,25 mg par
jour pendant une semaine, passer à 2,5 puis 3,75 mg par jour à la
deuxième et troisième semaine et rester aux paliers supérieurs
(5 mg et 7,5 mg pendant trois semaines chacun avant d’atteindre
le palier final de 10 mg par jour). L’essai COPERNICUS concer-
nait l’insuffisance cardiaque sévère mais stable et montrait aussi
l’effet très favorable du carvédilol.
Le point commun de ces trois produits est l’effet bêta1-bloquant,
avec la baisse de la fréquence cardiaque responsable de l’effet
extrêmement bénéfique.
La seconde partie de la réunion était consacrée aux statines.
Un cardiologue et un lipidologue ont exposé leur point de vue
face à la question : “Faut-il traiter par statine tous les patients à
risque vasculaire ?”.
J. Puel (Toulouse) a rappelé que la dysfonction endothéliale
était responsable de la réponse paradoxale de l’acétylcholine sur
l’artère (vasoconstriction au lieu de la vasodilatation habituelle)
et qu’elle témoignait de l’infiltration athéroscléreuse. Elle est bien
entendu favorisée par le diabète, l’hypercholestérolémie, le taba-
gisme, l’hypertension artérielle, et elle précède l’apparition de
sténoses coronaires. La vasoconstriction paradoxale est caracté-
ristique de l’angor instable, car elle n’est pas observée dans l’an-
gor stable. Dysfonction endothéliale et inflammation (se tradui-
sant par une élévation de la protéine C réactive) vont de pair. Il a
été montré en 1995 que la lovastatine améliorait la fonction endo-
théliale. De façon générale, les statines stabilisent la plaque, dimi-
nuent la lésion endothéliale et l’inflammation.
M. Farnier (Dijon) a rappelé que l’étude CARE (pravastatine)
n’avait montré un effet bénéfique que pour un cholestérol LDL
supérieur à 1,25 g/l, alors que l’étude HPS (simvastatine) a mon-
INFORMATIONS
✔Facteur déclenchant réversible : – 6 semaines si TVD
–3mois si TVP ou EP
✔Pas de facteur déclenchant : 6 mois à 1 an
✔Facteur V Leyden seul : pas de modification du traitement
✔Histoire familiale et/ou personnelle de MTEV :
durée à discuter au cas par cas
Tableau V. Recommandations pour la durée du traitement anticoagu-
lant dans la maladie thromboembolique veineuse.
MTEV : maladie thromboembolique veineuse ; TVD : thrombose veineuse distale ;
TVP : thrombose veineuse proximale ; EO : embolie pulmonaire.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%