OBJECTIFS D’ENSEIGNEMENT PROFESSIONNEL CONTINU

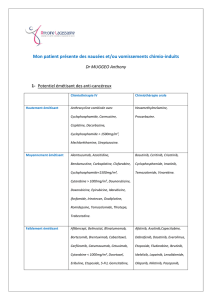
Diagramme. Recommandations de l’EORTC.
Traitements avec cible autour de 12 g/dl
Traitement individualisé pour maintenir la cible
d'Hb avec le minimum de traitement
Instauration EPO
Niveau normal d’Hb
Pas de traitement prophylactique
Symptomatique Hb 9-11 g/dl Hb < 9 g/dl
Évaluation, transfusion puis EPO
en fonction des facteurs individuels
Correction des causes de l’anémie
Asymptomatique Hb ≤ 11,9 g/dl
Évolution EPO en fonction
des facteurs individuels
La Lettre du Cancérologue • Vol. XX - n° 4 - avril 2011 | 297
OBJECTIFS D’ENSEIGNEMENT
PROFESSIONNEL CONTINU
Traitements antiémétiques
M. Di Palma
État des lieux
Les nausées et vomissements (N/V) sont un effet indésirable
fréquent au cours des traitements par chimiothérapie, effet parti-
culièrement redouté des patients, qui le classent régulièrement en
tête de leurs préoccupations. La mise à disposition des sétrons dans
les années 1990 a constitué un progrès décisif dans ce domaine.
Incidence et facteurs de risques
Le risque émétique d’une chimiothérapie varie en fonction des
molécules utilisées : nature (classifi cation d’Hesketh), dose et
durée de perfusion ; il est quasiment de 100 % avec le cisplatine ou
le cyclophosphamide à fortes doses. On défi nit donc des chimio-
thérapies hautement (risque > 90 %), moyennement (risque de
30 à 90 %) ou faiblement (risque < 30 %) émétisantes. Le risque
émétogène varie aussi selon le patient concerné : il est plus
élevé chez les femmes, les patients jeunes, en cas d’antécédents
émétiques comme le mal des transports ou les vomissements
gravidiques, mais, surtout, le facteur de risque principal est le
Treatment of Cancer [EORTC]), qui a le plus récemment publié des
données corrigées au regard des différents résultats d’études (10).
Ces recommandations sont regroupées sur le diagramme.
Références bibliographiques
1. Henke M, Laszig R, Rübe C et al. Erythropoietin to treat head and neck cancer patients
with anaemia undergoing radiotherapy: randomised, double-blind, placebo-controlled
trial. Lancet. 2003;362(9392):1255-60.
2. Leyland-Jones B, BEST Investigators and Study Group. Breast cancer trial with erythro-
poietin terminated unexpectedly. Lancet Oncol 2003;4:459-60.
3. Wright JR, Ung YC, Julian JA et al. Randomized, double-blind, placebo-controlled
trial of erythropoietin in non-small-cell lung cancer with disease-related anemia. J Clin
Oncol 2007;25(9):1027-32.
4. Overgaard J, Hoff C, Sand Hansen H et al. Randomized study of the importance of novel
erythropoiesis stimulating protein (Aranesp®) for the effect of radiotherapy in patients
with primary squamous cell carcinoma of the head and neck (HNSCC) – the Danish Head
and Neck Cancer Group DAHANCA 10 randomized trial. Eur J Cancer 2007:5(Suppl.6):7.
5. Thomas G, Ali S, Hoebers FJ et al. Phase III trial to evaluate the effi cacy of maintaining
hemoglobin levels above 12.0 g/dL with erythropoietin vs above 10.0 g/dL without
erythropoietin in anemic patients receiving concurrent radiation and cisplatin for cervical
cancer. Gynecol Oncol 2008;108(2):317-25.
6. Bohlius J, Langensiepen S, Schwarzer G et al. Recombinant human erythropoietin
and overall survival in cancer patients: results of a comprehensive meta-analysis. J Natl
Cancer Inst 2005;97(7):489-98.
7. Bohlius J, Wilson J, Seidenfeld J et al. Recombinant human erythropoietins and cancer
patients: updated meta-analysis of 57 studies including 9353 patients. J Natl Cancer
Inst 2006;98(10):708-14.
8. Bennett CL, Silver SM, Djulbegovic B et al. Venous thromboembolism and mortality
associated with recombinant erythropoietin and darbepoetin administration for the
treatment of cancer-associated anemia. JAMA 2008;299(8):914-24.
9. Aapro MS, Leonard RC, Barnadas A et al. Effect of once-weeldy epoetin beta on survival
in patients with metastatic breast cancer receiving anthracycline and/or taxane-based
chemotherapy: results of the breast cancer-anemia and the value of erythropoietin
(BRAVE) Study. J Clin Oncol 2008:26(4):1-7.
10. Aapro MS, Birgegård G, Bokemeyer C et al. Erythropoietins should be used according
to guidelines. Lancet Oncol 2008;9(5):412-3.

298 | La Lettre du Cancérologue • Vol. XX - n° 4 - avril 2011
Soins de support
OBJECTIFS D’ENSEIGNEMENT
PROFESSIONNEL CONTINU
fait d’avoir eu des problèmes de N/V lors d’une chimiothérapie
antérieure, auquel cas le traitement antiémétique doit être préventif
et d’emblée optimisé. À l’inverse, classiquement, les patients alcoo-
liques ont moins de N/V.
Nausées et vomissements anticipés,
aigus ou retardés
Il est utile d’avoir en mémoire le fait qu’il existe plusieurs types de
N/V au cours d’une chimiothérapie, de temporalité différente, mais,
surtout, sous-tendus par une physiopathologie spécifi que qui doit
être connue pour adapter le traitement proposé. Les N/V anticipés
surviennent avant toute administration de chimiothérapie ; ils
sont favorisés par l’anxiété et les antécédents émétiques. Leur
traitement peut reposer sur les anxiolytiques mais surtout en
évitant tout épisode émétisant lors des chimiothérapies antérieures.
Les N/V aigus surviennent par défi nition dans les 24 heures suivant
la chimiothérapie et, en l’occurrence, les sétrons se sont révélés
particulièrement utiles. Les N/V retardés surviennent au-delà
de 24 heures et jusqu’à 1 semaine, voire plus, après la chimio-
thérapie. Ce problème touche globalement 1 patient sur 2 si seuls
des sétrons sont administrés et il est souvent sous-estimé car il
survient au domicile et peut être méconnu s’il n’est pas systé-
matiquement recherché par l’interrogatoire du patient. Il s’agit
souvent de nausées persistantes, vécues par le patient comme plus
pénibles que les vomissements. Les inhibiteurs des récepteurs à la
neurokine 1 (anti-NK1) comme l’aprépitant constituent un progrès
récent signifi catif dans ce domaine.
Traitements disponibles
Les sétrons sont des inhibiteurs des récepteurs de la sérotonine
5HT3-R. Ils ont constitué une véritable révolution dans la prise en
charge des patients sous chimiothérapie, permettant d’éviter les
N/V à la phase aiguë dans plus de 80 % des cas. De nombreuses
molécules existent (ondansétron, granisétron, dolasétron, tropi-
sétron), équivalentes dans leur effi cacité. Les sétrons peuvent
être administrés par voie intraveineuse ou orale, avec une même
effi cacité, mais il faut tenir compte du délai d’action supérieur
(1 heure environ) des formes orales. Les effets indésirables sont
rares et bénins (céphalées, constipation parfois gênante en cas de
traitement opioïde associé).
Les traitements antiémétiques “classiques” (métoclopramide,
alizapride, halopéridol, métopimazine, etc.) sont des antagonistes
dopaminergiques. Leur intérêt a fortement diminué depuis les
sétrons, mais ils restent utiles en cas d’insuffi sance des sétrons
et en particulier pour les N/V retardés (N/V réfractaires). Leurs
effets indésirables dépendent de la molécule considérée, avec des
effets centraux (somnolence, syndrome extrapyramidal) selon le
passage de la barrière hémato-encéphalique, effets donc moindres
avec la métopimazine.
L’intérêt des corticoïdes a été récemment démontré par des équipes
italiennes en particulier, aussi bien en phase aiguë que retardée.
Faits nouveaux
Traitements
Les inhibiteurs des récepteurs à la neurokinine 1
(anti-NK1)
Les récepteurs NK1 et leur substrat (la substance P) sont
impliqués dans la physiopathologie des N/V, surtout retardés.
Ils améliorent le contrôle des N/V aigus, mais aussi retardés
(75 versus 50 %). L’aprépitant fait partie de l’arsenal thérapeu-
tique antiémétique standard. Il est administré par voie orale
juste avant la chimiothérapie puis pendant 2 jours. Notons que,
du fait d’interactions pharmacologiques, la dose de corticoïdes
doit être diminuée de 30 % en cas d’association avec l’aprépitant
(encadré).
Encadré. Recommandations.
Plusieurs sociétés savantes proposent des mises à jour régulières
de leurs recommandations : l’ASCO, l’ESMO, la MASCC (Mutina-
tional Association for Supportive Care in Cancer), consultables
sur leur site Internet.
Risque émétique élevé
Prévention des N/V aigus : sétron + aprépitant + dexaméthasone
Prévention des N/V retardés : aprépitant + dexaméthasone
Risque émétique modéré
Prévention des N/V aigus : sétron + dexaméthasone
Prévention des N/V retardés : dexaméthasone ou sétron ou
antidopaminergiques
J1, avant chimiothérapie J2-J3 J4
Sétron Dose standard – –
Dexaméthasone 12 mg 8 mg 8 mg
Aprépitant 125 mg 80 mg –
Schéma pratique, protocole antiémétique en cas de risque élevé.
Évaluation des nausées et vomissements
L’objectif des traitements est d’obtenir un contrôle le plus
complet possible des N/V : la tendance est donc à regrouper
dans les recommandations les chimiothérapies hautement
et moyennement émétisantes, de considérer dans les études
l’absence complète de vomissements et le non-recours à un
traitement antiémétique supplémentaire contre les nausées
comme un succès. Plusieurs études récentes tendent à proposer
l’utilisation des anti-NK1 dans les N/V hautement mais également

La Lettre du Cancérologue • Vol. XX - n° 4 - avril 2011 | 299
OBJECTIFS D’ENSEIGNEMENT
PROFESSIONNEL CONTINU
modérément émétisantes (protocoles anthracyclines/cyclophos-
phamide, mais également autres molécules comme carboplatine,
oxaliplatine, irinotécan).
Règles de prise en charge des nausées
et vomissements chimio-induits
Il importe de :
➤prescrire d’emblée le traitement le plus effi cace possible ;
➤suivre les recommandations internationales ;
➤
tenir compte à la fois du protocole de chimiothérapie mais aussi,
et surtout, du patient (terrain, antécédents, etc.) : par exemple,
une patiente recevant une chimiothérapie par anthracycline et
cyclophosphamide adjuvante pour un cancer du sein doit être
considérée (selon les recommandations de la MASCC) à haut
risque émétique, bien que cette chimiothérapie soit en principe
moyennement émétisante ;
➤
évaluer régulièrement et systématiquement l’effi cacité des
traitements antiémétiques ;
➤
prendre en compte non seulement les N/V aigus, mais aussi
les N/V retardés ou anticipés.
Pour en savoir plus
• Durand JP, Madelaine I, Scotté F. Recommandations pour la prévention et le traitement
des nausées et vomissements induits par la chimiothérapie. Bull Cancer 2009;96(10):
951-60.
Réunion de concertation
pluridisciplinaire
D. Mayeur, D. Billard, S. Ghez, F. Merabet, S. Rigaudeau,
J.F. Geay, C. Abraham, S. Castaigne
État des lieux
Les patients atteints de cancer et la société en général aimeraient
penser que toute la communauté médicale, paramédicale et
scientifique travaille en coopération pour résoudre tous les
problèmes de chaque malade cancéreux. Ils acceptent mal les
batailles de terrain, les difficultés liées aux egos professionnels
et aux animosités personnelles. Heureusement, l’énergie investie
dans ces pratiques contre-productives est faible comparée à
celle dépensée par les professionnels qui exercent leur métier
avec dévouement, fierté, cherchant constamment la meilleure
solution à chaque cas individuel et restant humbles face à
leurs patients. Ceux-ci pratiquent la pluridisciplinarité naturel-
lement (1). Cette attitude, déjà ancienne en cancérologie, a
largement été soutenue et pratiquée, en particulier dans les
centres de lutte contre le cancer mais aussi dans d’autres
établissements. Cependant, cette pratique était encore souvent
inexistante en 2002. Ainsi, une enquête portant sur la pratique
des chimiothérapies en Île-de-France n’a retrouvé trace d’une
réunion de concertation pluridisciplinaire (RCP) que dans 57 %
des cas, la proportion étant plus élevée dans les établissements
assurant une mission d’enseignement et de formation (2). Il est
donc apparu nécessaire de formaliser et rendre obligatoire cette
approche multidisciplinaire.
Bases réglementaires
En 2003, le Plan cancer prévoit, par sa mesure 31, de “faire
bénéfi cier 100 % des nouveaux patients atteints de cancer d’une
concertation pluridisciplinaire autour de leur dossier” et de “synthé-
tiser le parcours thérapeutique prévisionnel issu de cette concer-
tation sous la forme d’un ‘programme personnalisé de soins’ remis
au patient”.
La circulaire DHOS/SDO n
o
2005-101 du 22 février 2005 (3) précise
cette organisation, en particulier dans son annexe II : “une stratégie
de traitement défi nie sur la base d’un avis pluridisciplinaire et des
référentiels validés et régulièrement actualisés”.
La mise en œuvre de la pluridisciplinarité est essentielle en cancéro-
logie. Le Plan cancer a fait, pour cette raison, de ce mode d’organi-
sation médicale l’un de ses objectifs prioritaires. L’avis issu de la RCP
doit permettre au patient de participer à la décision thérapeutique.
La concertation pluridisciplinaire et l’organisation qu’elle implique
sont défi nies à l’annexe II.
Cette stratégie thérapeutique doit se fonder sur des recommanda-
tions de pratique clinique, dont l’élaboration et la mise à jour sont
assurées au niveau national par l’Institut national du cancer (INCa),
en coordination avec les programmes européens ou internationaux
et les sociétés savantes concernées. À partir de ces recommanda-
tions nationales, les réseaux régionaux de cancérologie élaborent
des référentiels régionaux. Au niveau local, les établissements de
santé et les réseaux de santé en cancérologie, implantés au niveau
du territoire, assurent leur mise en œuvre.
Le décret n
o
2007-388 du 21 mars 2007 (4) précise que, pour
obtenir l’autorisation d’exercer en cancérologie, il faudra, entre
autres, “l’annonce du diagnostic et d’une proposition thérapeu-
tique fondée sur une concertation pluridisciplinaire”. En pratique,
il convient de veiller scrupuleusement au respect de cette organi-
sation pour ne pas être critiquable : de simples équipes de service
ne sont pas forcément éligibles en tant que RCP ; un quorum
compétent doit toujours être présent. La fréquence des réunions
doit être suffi sante pour ne pas être à l’origine d’un retard de prise
en charge préjudiciable aux malades.
Faits nouveaux
Il convient dans un premier temps de consolider les RCP existantes,
mais peut-être aussi d’envisager ensuite une certaine harmonisation
entre les différents établissements d’un territoire de santé afi n,
1
/
3
100%