catalysée par la thiamine

Stéphane Cosandey assistant : Samuel Constant
TP chimie organique janvier 2004
catalysée par la thiamine
Introduction
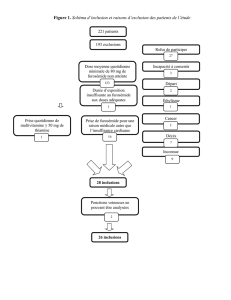
Dans cette expérience on va synthétiser de la benzoine à partir du benzaldéhyde en utilisant
de la thiamine comme catalyseur :
CHO
O
OH
Thiamine
La benzoine est utilisé en pharmacologie ou elle rentre notamment dans la composition des
soins contre le refroidissement. Récemment on trouve aussi son utilité en cosmétique. La
forme naturelle de la benzoine est extraite des arbres où l’on a préalablement opéré une
entaille afin de les blesser.

2
Résultats et discussions
Étapes de synthèse
La thiamine (vitamine B1) sous forme d’hydrochlorure de thiamine est d’abord déprotonnée
avec de la soude afin d’en faire un nucléphile. L’hydrogène se situant entre l’azote et le
souffre est relativement acide, ce qui lui permet d’être arracher facilement (cf mécanisme).
L’anion ainsi formé va attaquer le benzaldéhyde et former un alcool. Comme nous nous
trouvons en milieu basique il y a à nouveau protonnation du carbone rattaché à la thiamine
cette fois (lui aussi possède à son tour un pKa d’environ 17). La molécule à nouveau
nucléophile va attaque une autre molécule de benzaldéhyde selon le même procédé. Suite à un
réarrangement, la molécule formée va se débarrasser de la thiamine, et on aura alors la
benzoine.
Mécanisme
Tout d’abord on déprotonne la thiamine avec la soude
N
S
CH3
...
H
HO-N
S
CH3
...
N
S
CH3
...
+N
S
CH3
...
l’hydrogène attaqué possède un pKa de 17-19
ensuite l’aldéhyde subit une attaque nucléophile
CHO NN
S
NH2
H3C
CH3N
S
...
++
N
S
...
-O
H
N
S
...
HO
H
O
H2O
+
HO-

3
formation alors de l’anion chargé
N
S
...
HO
HO-
N
S
...
HO
H
N
S
...
HO
+H2O
qui va attaquer une autre molécule de benzaldéhyde pour enfin libérer la thiamine
N
S
...
HO
+
N
S
...
H
-OHO
O
OH
+
N
S
...
H
O
H2O
N
S
...
H
HO HO
+
HO-
N
S
...
H
HO
-O
+H2O
au lieu de s’arrêter à la formation des deux alcool, la réaction continue jusqu’à reformer un
aldéhyde. C’est pour cela que l’on appelle cette réaction une condensation.

4
Analyse des spectres
Spectre IR
Le spectre IR est cohérent avec la théorie puisque nous observons les mêmes pics :
3400, 1260, 1200, 1080, 760, 700, 620 et 520 pour la théorie, et
3464, 1258, 1212, 1067, 780, 699, 594 et 514 pour notre échantillon. A cela s’ajoute trois pics
importants à 3032, 1681 et 974. Ces pics sont tout à fait normaux puisqu’ils correspondent à
la liaison C-H, la liaison C=C et à la vibration de déformation O-H. Quant aux pics en rapport
avec la théorie ils correspondent parfaitement aux liaisons qui se trouve dans notre molécule.
Spectre RMN
Les résultats de RMN sont excellents puisque les pics sont exactement ceux de la théorie ;
RMN 1H (CDCL3) ∂ 4.55 (d, 1H) ; 5.95 (d, 1H) ; 7.29-7.53 (m, 8H) ; 7.9-70.94 (m, 2H). On
remarque qu’il y a juste un signal en plus mais il peut être attribué à un résidu d’eau. Le CH
sort un peu plus loin que le prédit la table puisqu’on le retrouve à 5.95 alors que par calcul il
devrait être à 5.7. Mais cette différence est minime et la théorie en tient compte. Les protons
des aromatiques du second cycle sortent entre 7.25 et 7.41.
Rendement et pureté
Le rendement est bon puisque le protocole annonçait 10 g de produit (48 % de rendement)
et on en a obtenu 11,1 g (53 %). Il faut d’abord vérifier la pureté avant de se réjouir. De ce
côté le spectre RMN nous montre quelques traces de ce qui pourrait être de l’eau. En revanche
le point de fusion de notre échantillon se situe vers 136°C, alors que le protocole annonce un
point de fusion à 134-136°C. Ce qui pourrait vouloir dire que notre produit est pur.
Questions
1) La thiamine a pour formule brute C11H14N3S. Une fois déprotonnée elle sert de catalyseur
dans cette synthèse, le mécanisme est détaillé dans les étapes de synthèse plus haut.
2) le cyanure possède lui aussi un azote et de plus c’est un ion (donc déprotonné). Le
carbone attaché agit donc exactement selon le même mécanisme que la thiamine. Cependant
son emploi est plus dangereux car le cyanure est un poison tandis que la thiamine n’est pas
nocive.

5
Conclusion
L’expérience a eu un bon rendement. Même si l’on prend en compte une partie d’impureté
on arrive à un rendement proche de celui du protocole. La filtration à froid a empêché de
perdre du produit peu soluble. Toutefois il ne fallait pas rincer de manière excessive non plus.
Partie expérimentale
Dans un ballon bicol de 100 ml on dissout de l’hydrochlorure de thiamine (3,5 g ; 10,4
mmol) dans de l’eau (8 ml). De l’éthanol est ajouté (35 ml) et on refroidi la solution obtenue à
5°C avec un bain eau glace. On additionne ensuite une solution de NaOH 3M froid (7 ml)
pendant 5 minutes tout en agitant la solution. La solution passe progressivement d’incolore à
jaune (déprotonnation de la thiamine). Du benzaldéhyde est alors ajouté (20 ml ; 0,196
mmol), puis la réaction est chauffé à 65°C pendant 90 minutes. La réaction est ensuite
refroidie à température ambiante pendant la nuit. On filtre sur Büchner afin de récupérer les
cristaux formés (de couleur jaune-orange) que l’on lave à l’eau froide. Les cristaux sont
ensuite dissout dans de l’éthanol (55 ml). la solution est refroidie à température ambiante
pendant la nuit afin d’opérer une lente recristallisation (afin d’améliorer la pureté du solide).
Les cristaux obtenus (petites aiguilles de couleur blanc-jaune) sont sécher pendant une nuit.
On obtient ainsi 11,1 g de produit, soit un rendement de 53,4 %, contre 48 % prévu dans le
protocole.
Référence :
Bibliographique
Traité de chimie organique, 3ème edition, Vollhard & Schore, Ed De Boeck, pp 1053-1056
The Sigma Library of FT-IR spectra, Ed I, Roger J. Keller, vol 2, Ed Sigma chemical
company Inc., 1986, p. 370
Lien Internet
http://physchem.ox.ac.uk/MSDS/
http://chemdat.merck.de/fr/home/index.html
http://www.aist.go.jp/RIODB/SDBS/menu-e.html
Annexes : feuille de toxicité
spectre IR
spectre IR théorique
spectre RMN
agrandissement spectre RMN
questions spectre RMN
1
/
5
100%