2012

Faculté des Sciences
Section de chimie et biochimie
Département de chimie physique
Travaux Pratiques de chimie organique
Par
M. Laverrière Romain
Assistante
Tortoreto Cecilia
Genève
2012
38. Condensation benzoine
catalysée par la thiamine

1
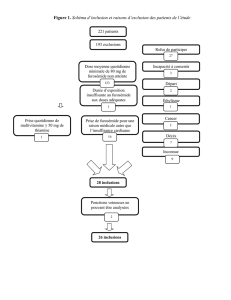
1. But de lʼexpérience[1]
Le but de cette expérience est la synthèse de la benzoine catalysée par de la
thiamine avec comme réactif du benzaldéhyde.
2. Manipulations[1]
Tout dʼabords, 3.5 g dʼhydrochlorure de thiamine ont été dissous dans 8 mL
dʼeau. Puis, 32 mL dʼéthanol ont été ajoutés avant que la solution soit refroidie
à 0 °C. Ensuite, 7 mL dʼune solution froide de NaOH 3M ont été additionnés
lentement à faible agitation. Par la suite, 20 mL de benzaldéhyde ont été
ajoutés avant que le milieu réactionnel soit porté à 60 °C durant 90 min. Alors,
la solution a été laissée reposée jusquʼà ce quʼelle atteigne la température
ambiante puis refroidie dans un bain de glace afin de compléter la
cristallisation de la benzoine. Finalement, une filtration sur Buchner a permis
de récupérer les cristaux qui ont été enfin recristallisés à lʼéthanol.
3. Mécanisme de réaction[2]
Dans un premier temps, la thiamine est déprotonée en milieu basique afin dʼen
faire un nucléophile. Puis, ce nucléophile va attaquer le groupe carbonylé du
benzaldéhyde ce qui est suivi par une reprotonation formant un alcool.
Ensuite, le milieu basique va déprotoner le carbon sp3 ce qui va engendrer la
formation dʼun carbocation qui va par la suite attaquer un deuxième
benzaldéhyde. Enfin, le départ dʼun hydrogène provoque la formation dʼune
double liaison C=O et régénère la thiamine.
Déprotonation de la thiamine :
O
H
O
OH
Thiamine
N
NNH2
N
S
OH
H
OH
N
S
R'
R
N
S
R'
R
N
S
R'
R
H2O

2
Synthèse de la benzoine :
4. Résultats & Discussion
4.1. Rendement
Masse obtenue (g)
9.7854
(Masse littérature (g))
(10)
Masse théorique (g)
20.83
Rendement
47.0 %
Le rendement est tout à fait bon. En effet, même sʼil est en dessous de 50 %,
le protocole prévoyait un rendement maximum de 48 %, soit 10 g de produit.
Étant juste un tout petit peu au-dessous, on peut en conclure que lʼexpérience
a bien fonctionnée.
N
S
R'
R
O
N
S
R'
R
Ph
O
H
H2O
N
S
R'
R
Ph
HO
H
OH
N
S
R'
R
Ph
HO
N
S
R'
R
Ph
HO
O
(+ H2O)
N
S
R'
R
Ph
HO
Ph
O
H2O
N
S
R'
R
Ph
HO
Ph
HO
HO
O
OH
N
S
R'
R
H2O

3
4.2. Spectre RMN 1H (Annexe 2 & 3)[4]
Proton
δlitt (ppm)
δexp (ppm)
Intégral
type
# protons
HA
8.024
7.938-7.917
1.00
Doublet de doublet
2
HB
7.46
7.550-7.259
4.15
Multiplet
2
HC
7.560
1
HD
7.242
1
HE
7.319
2
HF
7.45
2
HG
6.090
5.977-5.962
0.50
Doublet de doublet
1
HH
4.55
4.590-4.574
0.49
Doublet de doublet
1
Le spectre H-RMN montre un produit tout à fait pure. Les déplacements
expérimentaux correspondent totalement à ceux attendus et les intégrales
reflètent bien la stœchiométrie des protons.
4.3. Spectre IR (Annexe 4)[4]
Le spectre IR présente deux pics mageurs :
Le premier a 3401.27-3376.95, correspond à lʼélongation O-H.
Le deuxième a 1678.47 est caractéristique de lʼélongation C=O.
Les autres pics présents sont bien trop rappchés et dʼintensité égale pour
pouvoir les distinguer. Néanmoins, on peut dire quʼentre 1900 et 3200 sont
présents les élongations C-H aromatiques et C-H alcanes.
5. Conclusion
Pour conclure, on voit par la H-RMN que nous obtenons bien notre produit
final avec une très bonne pureté, ce qui est plus ou moins confirmé par le
spectre IR, bien quʼil contienne beaucoup de bruit. De plus, le rendement est
parfait en compte tenu des prévisions du protocole. Finalement, le point de
fusion a été observé a 134.4-136.3 °C ce qui correspond parfaitement à la
valeur littéraire (134-136 °C).
Bref, lʼexpérience est une totale réussite.
O
O
HA
HB
HC
HB
HAHH
HF
HE
HD
HE
HF
HG

4
6. Questions
6.1. Quel est la formule de la thiamine et quel est son mécanisme dʼaction
dans la réaction de condensation benzoine ?
La formule chimique de la thiamine est : C12H17N4OS+.
La thiamine est le catalyseur de la réaction et sert de nucléophile dans
lʼattaque de la benzaldéhyde. Grace à sa nature éléctroattractrice, elle favorise
le départ dʼun hydrogène permettant la condensation avec une deuxième
molécule de benzaldéhyde. Elle fait enfin office de groupe partant ce qui la
régénère.
6.2. Montrer comment le cyanure peut remplacer la thiamine dans la réaction
de condensation benzoine.
Le cyanure est, comme la thiamine, un bon nucléophile car il possède une
charge négative. De plus, il possède aussi un groupe électroattracteur ce qui
le rend très semblable a la thiamine. Ainsi, le mécanisme est le même.
6.3. La pyruvate décarboxylase est une enzyme dépendant de la thiamine
qui catalyse la décarboxylation de lʼacide pyruvique en acétaldéhyde.
Ecrire un mécanisme pour cette transformation et noter la référence
bibliographique.
De nouveau, la thiamine sert de catalyseur à cette réaction[5] .
7. Sources
[1] Protocole de TP de chimie organique, synthèse 36
[2] Vollhart-Schore, Traité de chimie organique, 4ème édition française, (2004)
[3] Acros (http://www.acros.com/)
[4] SDBS (http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/cre_index.cgi)
[5] Oranginc chemistry, Benzoin condensation, http ://www.organic-
chemistry.org/namedreactions/benzoin-condensation.shtm 23.11.2007
 6
6
 7
7
 8
8
1
/
8
100%