Division cellulaire et aneuploïdie Télomères et sénescence La

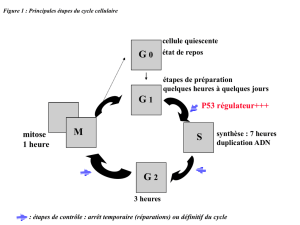
Division cellulaire et aneuploïdie
Quand une cellule se divise, elle dédouble son
matériel génétique représenté par les chromo-
somes, afin qu’une quantité rigoureusement
identique de ce matériel soit distribuée dans
chacune des deux cellules filles. Toute perturba-
tion de cette distribution s’appelle l’aneuploïdie
et constitue l’un des principaux mécanismes à
l’origine des cancers. En effet, cette répartition
anarchique correspond à une instabilité géné-
tique favorisant le développement puis
l’extension de la tumeur de même que sa résis-
tance aux traitements.
Télomères et sénescence
La plupart des cellules normales ne parviennent
pas à dédoubler les extrémités des chromo-
somes, appelés télomères. Ainsi, chaque divi-
sion cellulaire s’accompagne d’un raccourcisse-
ment des télomères. Après un certain nombre de
divisions, ils subissent un raccourcissement cri-
tique que la cellule reconnaît comme un dom-
mage génétique et arrête toute division. Ce
phénomène se nomme sénescence réplicative,
concerne toutes les cellules de l’organisme et
possède un rôle physiologique important dans la
prévention des cancers.
La sénescence
protège du
cancer
Plusieurs situations
sont connues où la
cellule ne parvient
pas à déclencher la
sénescence réplica-
tive, autorisant un
raccourcissement
anormalement
portant des télo-
mères.
Ces télomères trop
courts acquièrent
des propriétés
ticulières en deve-
nant par exemple «
collants » et,
comme le montre la
fFigure, en
sant ainsi la fusion
d’extrémités
mosomiques. Ces
fusions télomé-
riques, ainsi que
d’autres anomalies,
gênent la répartition
égale du matériel gé-
nétique entre les deux
cellules filles en
créant ainsi une
aneuploïdie à
l’origine du cancer.
La télomérase «
rallonge » les
télomères de
certaines
lules normales,
mais pas ceux
de la cellule
tumorale.
La télomérase est une
enzyme cellulaire qui
rallonge les
mères, permettant
ainsi à la cellule de se
diviser indéfiniment.
Elle est exprimée
dans les cellules souches et participe à leur
mortalisation. Elle n’est pas exprimée dans les
cellules différenciées de l’organisme. On
trouve presque toujours une activité télomérase
importante dans la plupart des cancers. Cette
activité participe à l’immortalisation tumorale et
de nouveaux médicaments sont à l’essai pour
tenter d’inhiber la télomérase. Paradoxalement
dans les cancers, l’activité télomérase importante
ne parvient pas à allonger les télomères de telle
sorte que ces derniers restent trop courts, perpé-
tuant l’aneuploïdie.
Effets du virus de l’hépatite B
sur la télomérase et sur les télo-
mères
Le virus de l’hépatite B (VHB) infecte environ 1
milliard d’individus et constitue une cause ma-
jeure de cancer du foie (HCC ou CHC). La tu-
meur se développe après plusieurs années
d’infection pendant lesquelles le foie subit des
modifications sensibles dont la plus remar-
quables est la cirrhose, prérequis indispensable
au développement de la tumeur.
Le virus exprime deux protéines connues pour
modifier l’expression du gène de la télomérase :
HBx et PreS2. Concernant HBx nous avons trou-
vé, dans notre laboratoire, que dès le stade de
cirrhose puis au stade tumoral c’est une forme «
tronquée », incomplète de la protéine qui était
exprimée. Nous l’avons appelée HBxT. A la diffé-
rence de la forme complète dite « sauvage »,
HBxT inhibe la télomérase et raccourcit les télo-
mères. Nous avons par ailleurs confirmé d’autres
études en montrant que preS2 stimulait la télo-
mérase et allongeait les télomères. Enfin, nos
résultats ont montré que les deux protéines sti-
mulent la prolifération cellulaire et entrainent
des dommages génétiques sur l’ensemble des
chromosomes, télomères inclus.
Les effets d’HBxT et de preS2 ex-
pliqueraient l’association para-
doxale d’une activité télomérase
augmentée avec des télomères
courts
Nos résultats et des études antérieures ont per-
mis de dessiner un modèle d’expression d’HBx
et de preS2 au cours du développement et de
l’évolution du cancer du foie. Dès le stade cirrho-
tique HBxT est exprimé alors qu’on observe une
accumulation progressive de preS2 au cours du
temps, la quantité maximale de cette protéine
culminant au stade tumoral. Nous avons reconsti-
tué cette situation dans des cellules de cancer du
foie et avons trouvé qu’en présence d’HBxT,
l’expression de quantités croissantes de preS2
annulait l’effet négatif d’HBxT sur l’expression du
gène de la télomérase sans parvenir cependant à
allonger les télomères de façon significative.
Nous effectuons des expériences complémen-
taires afin de confirmer ce résultat. Nous pensons
et souhaitons démontrer que ce sont les effets
cumulés des deux protéines sur l’intégrité géné-
tique qui empêchent la télomérase d’allonger les
télomères de façon optimale.
1
/
1
100%