Cliquez-ici pour télécharger le fichier PDF de la publication.

DYSNATREMIES ET NEUROCHIRURGIE
Graftieaux JP, Lepousé C, Gomis Ph, Léon A. (DAR Reims)
ANARLF Journée des clubs Septembre 2005
Une hyper ou hyponatrémie n’est pas la conséquence d’une rétention ou d’une fuite de
sodium, même si elle peut leur être associée : elle est obligatoirement liée à un déséquilibre du
bilan de l’eau dont le contrôle fait appel à la régulation des entrées par la soif, [avec comme
pour l’hormone anti-diurétique (HAD ou arginine-vasopressine), une double régulation
osmotique et volémique,] et des sorties par le rein. Au cours des anomalies du métabolisme
hydrosodé, la perturbation entre l’eau et le sodium est toujours extracellulaire : principal
déterminant de l’osmolalité extracellulaire, la natrémie régule par conséquent l’hydratation et
le volume de la cellule.
LES HYPONATREMIES
L’hyponatrémie est définie officiellement par une natrémie inférieure à
135mmol/l. Si l’incidence de l’hyponatrémie est de 1% dans la population hospitalisée, elle
est plus élevée dans la population neurochirurgicale car associée à une multitude de
pathologies : traumatismes crâniens, infections intracraniennes, tumeurs, hémorragies. On
rapporte une incidence de 30% avec l’hémorragie méningée.
Si les variations modestes de la natrémie sont sans conséquence clinique appréciable sur le
cerveau sain, il n’en est pas de même sur le cerveau lésé où l’hyponatrémie constitue une
ACSOS. L’apport intempestif de solutés hypo-osmolaires en neuroanesthésie modifie le
volume cérébral des zones où la BHE est conservée en créant un œdème osmotique majorant
la gravité du tableau clinique initial.
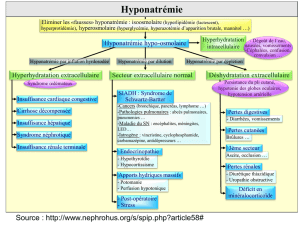
Approche diagnostique du patient hyponatrémique (Figure 1)
La première démarche devant un patient hyponatrémique est de l’examiner,
d’apprécier la symptomatologie clinique et de s’interroger : est-il urgent d’agir ? La seconde
étape est de mesurer l’osmolalité sérique, dont la normalité permettra d’éliminer une
hyponatrémie isotonique ou pseudo-hyponatrémie par hypertriglycéridémie ou
hyperprotidémie. La troisième étape, après confirmation de l’hyponatrémie hypotonique, est
de mesurer l’osmolalité urinaire qui permet d’être renseigné sur les capacités rénales de
dilution de l’urine : dans des conditions physiologiques d’hydratation, le rein répond à une
hyponatrémie par une dilution, avec une urine dont l’osmolalité est inférieure à 100 mosm.l
-1
Les capacités rénales d’excrétion de l’eau pouvant s’élever jusqu’à 20 voire 30 litres d’eau
par jour, il est en effet difficile de devenir hyponatrémique en présence d’une conservation
des capacités de dilution rénale. L’association hyponatrémie-hypoosmolalité urinaire
inférieure à 100 mosm.l
-1
rend alors compte d’une absorbtion d’eau supérieure aux capacités
de dilution rénale, telle qu’on les observe en cas de polydipsie psychogène. (Une autre cause,
exceptionnelle pouvant aussi, dans ce cadre, être reliée à la potomanie des buveurs de bière).
La découverte dans le cadre de l’hyponatrémie d’une osmolalité urinaire élevée (supérieure à
100mosm.l
-1
), donc inappropriée, impose dans une quatrième étape d’examiner la volémie.
Plusieurs examens peuvent nous renseigner sur cette volémie 1) La mesure des variations de

la pression artérielle, et de la fréquence cardiaque lors des changements posturaux (recherche
d’une hypotension orthostatique), évaluation de la pression veineuse centrale, examen de
l’état de réplétion veineuse. 2) Mesure de la natriurèse : l’hypovolémie s’accompagne
normalement d’une natriurèse basse et d’une secrétion d’HAD (par stimulation des
barorécepteurs). 3) Mesure de l’urée sanguine et de l’uricémie, lesquelles chez le patient à
fonction rénale saine, sont élevées en cas d’hypovolémie et abaissées en cas d’hypervolémie.
4) Détermination des valeurs de l’hématocrite et de la protidémie. Ainsi, l’association d’une
euvolémie avec hyponatrémie et hypoosmolalité sérique associée à une natriurèse élévée et
sans insuffisance rénale, surrénale ou cardiaque, signe une Secrétion Inappropriée d’Hormone
Antidiurétique (SIHAD), alors qu’une même association en présence d’une hypovolémie
oriente vers une perte de sel d’origine cérébrale (médiée par des Facteurs Natruirétiques) ou
Cérebral Salt Wasting Syndrome (CSWS). Il convient de bien différencier ces deux entités,
qui relèvent de thérapeutiques radicalement différentes. Des dosages hormonaux, HAD, FN,
pourront confirmer le diagnostic différentiel. Une dernière étape sera de s’enquérir de la
vitesse de constitution du trouble et de la confronter à la symptomatologie clinique.
[Dans le cadre de notre exposé, nous n’aborderons pas les hyponatrémie
hypovolémiques avec diurèse basse (par perte digestive ou rénale) ni les hyponatrémies avec
état oedémateux (insuffisance cardiaque et syndromes néphrotiques.]
Symptomatologie initiale : encéphalopathie
Elle dépend de l’âge, du sexe, de l’étiologie, de l’importance de l’hyponatrémie
et aussi de la vitesse d’installation, sans être strictement corrélée avec la profondeur de
l’hyponatrémie. La clinique distingue habituellement entre les hyponatrémies aiguës
(installées en moins de 48 heures) et chroniques.
La symptomatologie est en rapport direct avec ses effets sur le système nerveux
central. Les premiers signes neurologiques d’une intoxication par l’eau peuvent être observés
pour une natrémie aux environ de 130 mosm.l:
-1
: nausées, céphalées, vomissements. Puis
survient un tableau d’encéphalopathie par œdème cérébral, avec augmentation de la PIC et
hypoxie cérébrale, caractérisé par des crises comitiales, un arrêt respiratoire, un coma. La
lésion primaire est attribuée à une démyélinisation, (diffuse ou siégeant dans diverses zones :
matière blanche sous corticale, hypothalamus, bulbe, protubérance ou moelle épinière)
d’origine hypoxique consécutive ou non à un arrêt cardiocirculatoire. L’hypoxie, en
diminuant le rendement de la pompe ATPase est finalement responsable de la mort cellulaire
de la cellule cérébrale et est à l’origine des crises, de l’arrêt respiratoire et du décès. Elle
augmente la production d’ADH, laquelle majore l’hyponatrémie et agit sur les canaux AQP4
des cellules neurales et gliales qui amplifient l’afflux d’eau et majorent l’œdème cellulaire.
L’ADH peut aussi accroître l’hypoperfusion en augmentant la vasoconstriction et par là,
l’hypoxie tissulaire. Le rôle des hormones progestérone et œstrogène dans le développement
du dommage cérébral peut être aussi rapporté à l’effet inhibiteur de ces deux hormones sur le
fonctionnement inhibiteur de la pompe ATPase, hormones réputées par ailleurs pour accroître
le taux d’ADH. Les hyponatrémies symptomatiques et inférieures à 120 mosm.l
-1
entraînent
une mortalité supérieure à 50%, et peuvent être responsable dans les autres cas de graves
séquelles neurologiques.
Lorsque l’installation de l’hyponatrémie est plus progressive, sur quelques jours, ou
lorsque celle-ci résulte d’une déplétion sodée et d’une ingestion hydrique exagérée, la
symptomatologie peut être inexistante. La mortalité et la morbidité des hyponatrémies sont
élevées chez la femme jeune et exceptionnelles chez l’homme et la femme âgée, lorsque la
natrémie reste supérieure à 128 mosm.l
-1
. La symptomatologie est le plus souvent absente en
cas d’hyponatrémies chroniques, hyponatrémies s’inscrivant dans un contexte d’insuffisance
cardiaque, rénale, hépatocellulaire, au cours d’un syndrome néphrotique. Elles illustrent aussi

souvent un SIHAD intégré dans un contexte de pathologies neurologiques, pulmonaire,
tumorale ou infectieuse, ou induit par de nombreuses thérapeutiques.
.
Conduite à tenir
*Principes généraux
La conduite dépend du type de l’hyponatrémie en cause, de la valeur de la natrémie et
de ses circonstances de survenue. Les causes d’hyponatrémie en neurochirurgie sont
essentiellement : pertes de cation monovalent (rénale et non rénale), gain d’eau libre,
polydipsie neurogénique, SIHAD.
Le patient asymptomatique n’a pas besoin de traitement agressif ; un regard doit être
porté sur les mécanismes sous jacents (drogues reçues, médicaments, hormones) pour
envisager leur correction. Si le patient est eu ou hypervolémique, une restriction hydrique doit
être engagée, avec un apport n’excédant pas 1,5 mmol.l
-1
par 24 heures. Si le patient est
déplété en sel (avec ou sans déplétion volémique) il est licite d’apporter de l’eau et du sel (per
os ou IV) selon le statut volémique et la natrémie du patient.
Un traitement plus agressif est recommandé pour le patient symptomatique. Utilisation
de sérum salé hypertonique (3% ou 514 mmol.l
-1
).et diurétique de l’anse en cas de surcharge
volémique. L’apport de sérum isotonique doit être considéré si le patient est hypovolémique.
Le but du traitement est d’augmenter la natrémie d’1 mmol.h
-1
Quand le patient devient
asymptomatique ou que la natrémie atteint 130mmol.l
-1
, le point thérapeutique est atteint. Il
ne faut pas augmenter la natrémie de plus de 20 mmol.l
-1
dans les 48 premières heures : la
natrémie doit être mesurée toutes les 2 heures.
*Exemples pratiques
Le calcul des perfusions pour augmenter la natrémie doit tenir compte de l’eau totale
(évaluée chez l’adulte à 50% de son poids), en tenant compte de l’age, du sexe. Le choix
d’une solution sodée hypertonique et/ou de diurétiques est déterminé par le niveau du volume
extracellulaire.
En cas d’hyponatrémie hypovolémique (CSWS), c'est-à-dire avec volume
extracellulaire bas, le sérum salé à 3% est utilisé jusqu’à correction partielle de la natrémie,
c'est-à-dire autour de 125 à 130 mmol.l
-1
. La quantité à perfuser dépend du déficit sodé,
calculé selon la formule suivante : déficit en sodium = eau totale x (125 – natrémie).
Par exemple, quelle quantité administrer chez un adulte de 70 kg, pour remonter en 48 heures sa natrémie de
110 à 130 mosm.l
-1
? Si l’eau totale est estimée à 35 litres, le déficit sodé est de : 35 (130-110) = 700mmol. La
perfusion de sérum salé hypertonique à 3% est : 700 : 514 : 48, soit 28ml.h
-1
.
L’hémorragie sous arachnoïdienne, est un exemple d’hyponatrémie hypovolémique
par perte de sel d’origine cérébrale (CSWS) et sa prise en charge engage le plus souvent à
restaurer la volémie par des colloïdes et à compenser les pertes sodées par du sérum salé
physiologique. La vitesse de correction varie selon la profondeur de l’hyponatrémie. Une
correction initiale rapide est justifiée en cas d’hyponatrémie symptomatique (agitation, coma,
crise convulsive), diagnostic parfois difficile à distinguer des conséquences de l’HSA initiale.
Elle a pour objectif d’atteindre une natrémie de 125 mmol.l
-1
La vitesse de correction
proposée varie de 1à 2 mmol.l
-1
par heure, le soluté administré pouvant être hypertonique.
Dans un second temps, la normalisation de la natrémie sera obtenue avec une correction
n’excédant pas 8 à 10 mmol.l
-1
par jour
Par exemple, si l’on veut augmenter, en 3 heures, de 2 mmol.l
-1
.h
-1
, la natrémie d’un patient de 72 kg porteur
d’une hémorragie méningée avec une natrémie initiale à 115 mmol.l
-1
à l’aide de sérum salé à 3%, on perfusera,
sachant qu’un litre de sérum à 3% apporte 513 mmol de sel, (et augmenterait sur 24 heures, la natrémie de 10.7
mmol.l
-1
) un volume égal à 82 ml.h
-1
pendant 3 heures et l’on perfusera ensuite pour atteindre en 24 heures une
natrémie à de 127 mmol.h
-1
un volume de 38,9 ml.h
-1
. Mais le patient étant hypovolémique, une autre solution
serait de restaurer la volémie en apportant du sel sous forme de sérum physiologique avec un volume de 634

ml.h
-1.
pendant 3 heures ; puis si l’on veut, en 24 heures, élever la natrémie à 127 mmol.l
-1
avec du sérum
physiologique, il faudrait perfuser par heure un volume de 416 ml. [Une autre formule, en permettant le calcul
direct du gain en mosm de Na+ après perfusion d’un litre du soluté sodé choisi, autorise à connaître le volume du
soluté choisi à administrer pour une correction précise, dans un temps voulu. Cette formule est la suivante :
modification de natrémie après perfusion d’un litre de soluté sodé (à choisir parmi les sérums salés
hypertoniques ou physiologiques = apport de Na+(contenu dans le soluté choisi) – natrémie du patient / eau
totale( poids du corps x 0,5) + 1). A remarquer que cette formule vaut également pour la correction de
l’hypernatrémie, le soluté choisi, hypotonique se caractérisant alors par un contenu nul en sodium]
En cas d’hyponatrémie isovolémique, c'est-à-dire avec volume extracellulaire
normal, une diurèse sodée est induite avec du furosémide, suivie d’une perfusion d’une
solution salée hypertonique à 3% s’il existe des signes neurologiques, d’une perfusion de
sérum salé isotonique en l’absence de symptomatologie. Ce protocole s’applique dans le cas
particulier d’une hyponatrémie symptomatique avec SIHAD. Dans le cas particulier d’une
sérum salé hypertonique, avec ou sans diurétique est nécessaire.
Par exemple, si un patient de 60 kg atteint de SSIADH est porteur d’une hyponatrémie symptomatique à 107
mmol.l
-1
, il faudra après une injection intraveineuse de 20mg de furosémide, et une prescription de restriction
hydrique, lui administrer, si l’on veut élever sa natrémie de 5 mmol.l
-1
en 12 heures, un débit de sérum salé à
3%.de 30,6 ml.h
-1
A la douzième heure, selon l’état clinique, la restriction hydrique sera maintenue et la
natrémie augmentée de 2 mmol.l
-1
sur les 12 heures suivantes.(utilisation de la même formule)
En cas de SIHAD prolongée, la déméclocycline (Ledermycine), antibiotique de la famille des
tétracyclines est efficace dans tous les types de SIHAD (600 à 1200 mg/ j), en induisant après
4 à 7 jours de traitement un diabète insipide néphrogénique réversible, mais avec des effets
secondaires : insuffisance rénale, nausées, photosensibilisation, sélection de bactéries
mutantes. La fludrocortisone (0,1 à 0,3 mg deux fois par jour) permet d’élever la natrémie de
6 à 8 mmol.l
-1
dans tous les cas de SIHAD chronique, ce qui permet de maintenir une
natrémie supérieure à 120 mmol : son utilité semble surtout prouvée pour les cas de SIHAD
avec secrétion constante et non suppressible d’HAD.
La lésion secondaire d’origine thérapeutique : la démyélinisation osmotique
La correction thérapeutique trop rapide de l’hyponatrémie chronique peut être à
l’origine d’effets délétères par création d’une nouvelle agression osmotique responsable de
déshydratation cérébrale (et parfois de démyélinisation de la substance blanche). Dans ce cas,
une seconde procédure d’osmorégulation est initiée, mais la pénétration cellulaire des
électrolytes demande plusieurs heures alors que celle des osmolites organiques plusieurs
jours. La capacité de libérer des osmolites organiques apparaît supérieure à celle de les capter.
La Myélinolyse Centropontine (MCP) appelée ainsi parce que seule la myéline est détruite
alors que les structures nerveuses et vasculaires sont conservées, est plus fréquente si
l’hyponatrémie est associée à une hypoxie, à un état de dénutrition, à une intoxication
alcoolique chronique ou à une hypokaliémie. Les lésions siègent à la base du tronc cérébral, et
s’étendent à la partie centrale et inférieure de cette région, touchant les nerfs craniens. Dans la
description clinique originale, les patients sont le plus souvent quadriplégiques avec une
paralysie faciale, mutiques et dysarthriques, et ne présentent pas de réponses aux stimuli
nociceptifs. Cette entité clinique peut apparaître secondairement, quelques jours voire
quelques semaines après la disparition de la symptomatologie de l’encéphalopathie
hyponatrémique. L’imagerie par résonance magnétique montre, de façon souvent très retardée
par rapport à la clinique, des images de démyélinisation (hypersignal en T2). Il n’existe pas de
traitement curatif à ce syndrome : seules les mesures préventives peuvent être appliquées. Des
localisations extrapontiques de démyélinisation ont été rapportées, et la MCP a été décrite
chez des patients non hyponatrémiques.
LES HYPERNATREMIES

L’hypernatrémie est toujours associée à un état hyperosmolaire et à une hypertonicité
plasmatique. Elle traduit un déséquilibre entre le capital sodé et le capital hydrique de
l’organisme. Les hypernatrémies par inflation sodée sont moins fréquentes que celles causées
par un déficit du capital hydrique. Les manifestations cliniques de l’hypernatrémie peuvent
être neurologiques, rénales et musculaires.
Approche diagnostique du patient hypernatrémique
L’hypernatrémie entraîne toujours une hyperosmolarité extracellulaire et une
déshydratation intracellulaire. Il convient ici aussi, d’apprécier la volémie efficace pour
distinguer 1) Les hypernatrémies avec hypervolémie, (Rétention d’H
2
O + Na
+
), qui
s’accompagnent d’une natriurèse supérieure à 20 mOsm.l
-1
avec une Osm.urin supérieure à
400 mOsm.kg
-1,
et qui sont iatrogènes ou correspondent à un hyperaldostéronisme primaire,
une maladie de Cushing. 2) Celles avec hypovolémie, (Perte d’H
2
O + Na
+
), liées à des pertes
digestives avec natriurèse inférieure à 15mmol.l
-1
et Osm.urin supérieure à 400 mOsm.kg
-1,
ou
causées par des diurétiques, une diurèse osmotique, un diabète insipide partiel, avec natriurèse
supérieure à 20 mmol.l
-1
et Osm.urin supérieure à 400 mOsm.kg
-1
; 3) Celles avec
normovolémie. (Perte d’H
2
O), liées à des pertes du tractus respiratoire avec natriurie variable
et Osm. urin supérieure à 400 mOsm.l
-1
ou en rapport avec un diabète insipide, avec une
natriurie variable et une Osm.urin inférieure à 290 mOsm.kg
-1.
Toute cette énonciation peut
paraître complexe mais on la retrouve pleinement en établissant le diagnostic différentiel des
hypernatrémies sur l’osmolarité urinaire, comme le propose Vincent. (Figure 2).
Symptomatologie initiale
Les signes neurologiques (soif, agitation, irritabilité, altération de la conscience, crises
d’épilepsie, ataxie, hémorragie intracranienne, hyperréflexie, faiblesse) résultent de la
déshydratation cellulaire et sont plus corrélés avec la rapidité d’installation du désordre
électrolytique qu’avec la valeur absolue de la natrémie. Une hypernatrémie aiguë sévère
(supérieure à 160 mmol.l
-1
installée en moins de 48 h) entraîne une déshydratation cellulaire
et une rétraction cérébrale pouvant être responsable d’hémorragie intracranienne. En
revanche, l’hypernatrémie chronique est habituellement bien tolérée en raison de
l’osmorégulation cérébrale : capacité du cerveau à réguler son volume intracellulaire.
Conduite à tenir
*Principes généraux
Le traitement de l’hypernatrémie requiert une double approche thérapeutique : celle de la
pathologie sous jacente et celle de la correction de l’hypertonicité Les quantités à administrer
sont fondées sur l’évaluation (approximative) des pertes hydriques à partir de la formule
mathématique conventionnelle suivante :
[déficit hydrique = eau corporelle totale x [(Na+ sérique/140) -1] (mais l’autre
formule indiquée plus haut peut aussi être utilisée)
La vitesse d’administration doit être lente, de 48 à 72 heures, pour éviter les
phénomènes d’œdème cérébral. La moitié seulement de la correction doit s’effectuer dans les
24 premières heures. L’hypernatrémie chronique est bien tolérée. Une correction trop rapide
peut favoriser l’apparition de crises comitiales, d’un œdème cérébral, et de lésions
neurologiques irréversibles. Mais une hypernatrémie brutale doit être traitée rapidement.
*Exemples pratiques
Lorsque l’hypernatrémie résulte d’une perte d’eau et d’électrolytes (et donc associée à
une hypovolémie), il importe d’abord de restaurer la volémie avant de corriger l’hypertonie
plasmatique. La correction s’effectue par le recours à des macromolécules et l’administration
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%