Brèves… Brè ves… Nouvel espoir dans la

41
Métabolismes Hormones Diabètes et Nutrition (XI), n° 1, janvier-février 2007
Brèves…
Brèves…
Nouvel espoir dans la
prévention du cancer du sein
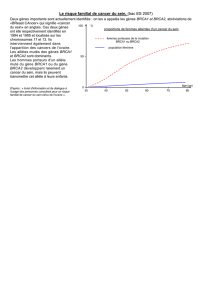
On sait aujourd’hui que 5 à 10 % des
cancers du sein seraient dus à une
prédisposition génétique majeure.
Ainsi, la présence d’une mutation dans
le gène BRCA1 (ou BRCA2), pour
BReast CAncer, expose la femme à
un risque plus élevé d’avoir un cancer
du sein et/ou de l’ovaire. Ce gène dit
“suppresseur de tumeur” est impliqué
à l’état normal dans le contrôle de la
prolifération cellulaire, la réparation
de l’ADN et la régulation de la trans-
cription. Paradoxalement, BRCA1
est exprimé dans toutes les cellules ;
toutefois, il protège particulièrement
contre le cancer les tissus hormonaux-
dépendants tels que le sein et l’ovaire.
Le traitement hormonal substitutif de
la ménopause, qui combine les estro-
gènes avec la progestérone, augmente
le risque de développer un cancer du
sein chez la femme ménopausée, ce
qui n’est pas observé lors d’un traite-
ment substitutif à base d’estrogènes.
Par ailleurs, des études ont montré
que, chez la souris, les récepteurs de
la progestérone (PR) sont indispensa-
bles au développement complet de la
glande mammaire et que la surexpres-
sion d’une des isoformes du PR (PR-A)
entraîne un développement anormal
de la glande mammaire associé à une
hyperplasie canalaire. L’ensemble de
ces observations indique fortement
l’implication des PR dans le dévelop-
pement du cancer du sein. Jusqu’à ce
jour, les interactions entre les gènes
BRCA1 et PR n’étaient pas élucidées.
Dans un article récent, Poole et al.
(2006) suggèrent que la spécificité
cellulaire de l’effet antitumoral de
BRCA1 résulte d’une action sur la voie
de signalisation de la progestérone. Ils
étudient un modèle murin qui présente
la double inactivation des gènes
BRCA1 et p53 ciblée dans les cellules
mammaires, reproduisant ce qui est
observé dans la majorité des tumeurs
mammaires associées à des mutations
de BRCA1 chez la femme. Le phéno-
type des animaux invalidés ressemble
à celui de souris sauvages gestantes,
et se trouve lié, par conséquent, à une
hyperplasie de la glande mammaire
avec augmentation des ramifications
canalaires et prolifération des cellules
épithéliales mammaires (MEC, pour
Mammary Epithelial Cells). Les cher-
cheurs montrent que les estrogènes et
la progestérone, administrés seuls ou
en combinaison, présentent un effet
mitogène puissant sur les cellules MEC
des souris déficientes en BRCA1 et
p53, alors que les deux hormones n’ont
aucun effet sur les souris normales ou
invalidées uniquement pour p53. Cette
prolifération cellulaire pourrait mettre
en jeu la protéine PR-A, dont les taux
sont augmentés par un mécanisme de
régulation post-transcriptionnelle. En
effet, dans des conditions normales,
l’exposition à la progestérone entraîne
la polyubiquitination de PR, puis sa
dégradation dans le protéasome. En
revanche, la dégradation de PR-A en
réponse à la progestérone n’est pas
observée dans les cellules MEC prove-
nant de souris invalidées pour p53 et
BRCA1. Les auteurs suggèrent donc
que BCRA1 orienterait la protéine PR
vers le protéasome afin qu’elle y soit
dégradée.
Les chercheurs du groupe califor-
nien ont également étudié le rôle de
BRCA1 sur des cellules épithéliales
cancéreuses humaines déplétées en
BRCA1 à l’aide d’un ARN interférant
anti-BRCA1. Ce traitement entraîne
une augmentation des concentrations
de protéines PR mais n’affecte pas les
taux de récepteurs α des estrogènes. En
outre, la quantité de PR ubiquitinées est
réduite dans les cellules humaines MEC
déplétées en BRCA1. Inversement, la
surexpression de BRCA1 provoque
une augmentation de la quantité de PR
ubiquitinées. Poole et al. montrent que
cet effet de BRCA1 est lié à son acti-
vité E3-ubiquitine ligase, une enzyme
qui catalyse le transfert de résidus
ubiquitine sur les protéines destinées à
être dégradées. Ainsi, comme chez la
souris, la protéine BRCA1 pourrait être
impliquée dans la stabilité du récep-
teur PR dans les cellules épithéliales
mammaires humaines.
Étant donné que la progestérone se
révèle être un puissant agent mito-
gène chez les souris invalidées pour
BRCA1 et p53, les auteurs ont ensuite
recherché les conséquences du blocage
de la protéine PR par un antagoniste de
la progestérone (RU 486) sur le déve-
loppement de tumeurs mammaires. De
façon intéressante, la présence d’un
patch libérant du RU 486 pendant
60 jours a prévenu, ou tout du moins
retardé, le développement de tumeurs
chez ces souris.
En conclusion, ces travaux apportent
des éléments nouveaux sur la fonc-
tion du gène BRCA1 et permettent
d’expliquer pourquoi sa mutation
est responsable de l’apparition de
tumeurs, spécifiquement dans la glande
mammaire et les ovaires. Par ailleurs,
ils ouvrent une piste thérapeutique
pharmacologique prometteuse pour
l’utilisation d’antiprogestérone dans
l’optique d’une stratégie préventive
chez les femmes à risque.
I. Lihrmann
INSERM U413, IFRMP23,
Université de Rouen.
Poole AJ et al. Science 2006;314:1467-70.
✓
Les articles publiés dans “Métabolismes-Hormones-Diabètes et Nutrition” le sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d’adaptation et de traduction par tous procédés réservés pour tous pays.
© octobre 1997 - DaTeBe SAS
Imprimé en France - Differdange S.A.S. - 95100 Sannois - Dépôt légal à parution
1
/
1
100%