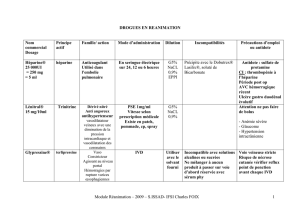
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE MINISTERE DE L’ENSEIGNEMENT SUPERIEUR

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE D’ORAN
FACULTE DES SCIENCES
DEPARTEMENT DE BIOLOGIE
LABORATOIRE DE PHYSIOLOGIE VEGETALE
MEMOIRE
Présenté par
Melle LAREDJ ZAZOU RAHMA
Pour l’obtention
DU DIPLOME DE MAGISTER
Formation Ecole Doctorale
Spécialité: Biodiversité Végétale Méditerranéenne de l’Algérie occidentale.
Option : Inventaire, Valorisation et Ecologie de la restauration.
Devant le jury composé de :
Mme BENNACEUR Malika Professeur Présidente Université d’Oran
M. BENHASSAINI Hachemi Professeur Examinateur Université de Sidi Bel Abbès
M. HADJADJ AOUL Seghir Professeur Examinateur Université d’Oran
M. BELKHODJA Moulay Professeur Encadreur Université d’Oran
Effet de la salinité sur le comportement hydrique
et minéral du haricot (Phaseolus vulgaris L.).
2012-2013

Remerciements
Le travail présenté dans ce mémoire a été réalisé au laboratoire de la
Post-Graduation de la physiologie végétale (Département biologie, Faculté
des Sciences, Université d’Oran dirigé par Monsieur BELKHODJA Moulay
Professeur à l’Université d’Oran.
Je suis honorée et il m’est agréable d’adresser mes remerciements les plus
sincères à Monsieur BELKHODJA Moulay, de qui j’ai tiré un immense
profit de son savoir ; par ses conseils éclairés et sa vision objective et
rationnelle de la problématique, ainsi que sa bienveillante disponibilité.
J’exprime ma profonde et respectueuse gratitude à Madame
BENNACEUR Malika Professeur à l’Université d’Oran, qui m’a fait
l’honneur de présider mon jury de thèse.
J’adresse mes vifs et sincères remerciements à Monsieur
BENHASSAINI Hachemi Professeur à l’Université de Sidi Bel Abbes, à
Monsieur HADJADJ AOUL Seghir Professeur à l’Université d’Oran, pour
l’honneur qu’ils m’ont fait en acceptant d’examiner ce travail et de participer
au jury.
Je remercie enfin tous les membres du laboratoire de la Post-graduation
de Physiologie végétale qui ont participé de prés ou de loin à la réalisation de
ce travail.

Dédicace
A Dieu tout Puissant, d’avoir été mon guide pendant toutes ces
années.
Cette thèse représente l’aboutissement du soutien et des
encouragements que mes parents m’ont prodigués tout au long de ma
scolarité. Cru en moi et m’avoir aidé à arriver là Où j’en suis ;
Merci pour tout.
La patience et l’encouragement de mon mari, au cours de cette thèse.
A Ma petite fille l’adorable Alaâ Kawther.
A mes frères et ma sœur.
A mes beaux parents, ma belle sœur et mes beaux frères.
.
Rahma.
Je tiens à exprimer un
Très Grand Merci
À tous ceux qui m’ont aidé, guidé et soutenu lors
de ma thèse
Je leur présente ici toute ma gratitude ainsi que
mon amitié.

RESUME
Notre étude est portée sur l'espèce Phaseolus vulgaris L., plante sensible à la
salinité. Ainsi nous avons utilisé des plantes des deux variétés El Djadida et Coco Rose
âgées entre six à sept semaines soumises aux traitements salins aux concentrations en
NaCl à 100 et à 200 meq.l-1 et à 100 meq.l-1 de NaCl +100 meq.l-1 de CaCl2 et à 100
meq.l-1 de NaCl + 150 meq.l-1 de CaCl2, les plantes témoins sont arrosées à la solution
nutritive .La sensibilité de ces variétés a été étudiée par la détermination des paramètres
suivants : la croissance du végétales (le poids frais et le poids sec aérien et racinaire), La
teneur en eau foliaire, Le taux des cendres et la distribution des ions Na+, K+ et Ca++ dans
les organes végétaux.
Les résultats obtenues montrent que : le sel a un effet dépressif sur la croissance
biologique ; cependant cet effet varie en fonction de l’intensité du stress. L’état hydriques
foliaire de la plante varie avec la concentration du milieu, la capacité modérer de la plante
sensible à ajuster progressivement leur pression osmotique même à des baisses
concentrations et grâce au maintien des concentrations élevées de K+. Le taux des cendres
et la distribution des ions Na+, K+ et Ca++ dans les organes végétaux feuilles-racines des
deux variétés a déclaré que le haut niveau de la salinité augmente les niveaux de Na+ ce
qui inhibe l’absorption des ions de Ca++ et K+, ce qui résulte dans le ratio K+/Na+ et
Ca++ / Na+. L’effet de ces accumulations varie en fonction des variétés, le type du sel et le
niveau de traitement salin.
L’addition du CaCl2 dans le milieu a pour but de constater le rôle du le calcium qui
peut non seulement contribuer à l’ajustement osmotique pendant les périodes néfastes,
mais a des rôles très importants dans le métabolisme de la plante contrairement au Na+ qui
peut être toxique pour les plantes.
Mots clés : salinité, haricot (Phaseolus vulgaris L.), paramètres de croissance, ajustement
osmotique, nutritions minérales.

SUMMARY
The aim of our work is to study the Phaseolus vulgaris L. species as a plant that is
sensitive to salinity. Thus we used two varieties of plants El Djadida and Coco Rose aged
six to seven weeks subjected to salt stress treatments by five concentrations (0, 100.200
meq.l -1NaCl) and (100 meq.l-1 CaCl2+ 100 meq.l-1 NaCl and 100 meq.l-1 NaCl +150 meq.l-1
CaCl2) . The sensitivity of these varieties was studied by determining the following
parameters: plant growth (fresh weight and dry weight and root air), the water content of
leaf, and ionic distribution of Na+, K+ and Ca++ in plant organs.
The results obtained revealed that: the salt has a depressive effect on growth; this
effect varied according to the intensity of stress. A change of water content in the plants
varies with the concentration of the medium, the ability moderate of sensitive plant to
progressively adjust their osmotic pressure and by using high accumulation of K +. The
distribution of Na +, K + and Ca++ in plant organs leaves, roots of both varieties said that
high level of salinity increases levels of Na+ which inhibits the absorption Ca++ and K+,
which results in the K+/Na+ and Ca++/ Na+. The effect of these accumulations varies
depending on the variety, type and level of salt treatment.
The addition of CaCl2 show the role of Calcium which can not only contribute to
osmotic adjustment but have the possibilities of translocation of K+ into high parts of the
plant in contrary of the toxic effect of Na+.
Keywords: salinity, bean (Phaseolus vulgaris L.), growth, osmotic adjustment, mineral
nutrition.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
1
/
123
100%