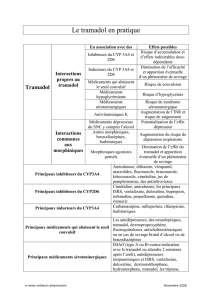
individuel. En général, la dose efficace la plus faible ayant

RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Tramadol EG 50 mg comprimés effervescents.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tramadol EG 50 mg comprimés effervescents contient respectivement 50 mg de tramadol
chlorhydrate par comprimé effervescent.
Excipients à effet notoire:
Chaque comprimé effervescent contient 75 mg de lactose monohydraté.
Chaque comprimé effervescent contient 10 mg d’aspartame.
Tramadol EG comprimés effervescents contient aussi du sodium (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimés effervescents.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement de douleurs modérées à intenses qui justifient l'emploi d'un analgésique à action centrale.
4.2 Posologie et mode d'administration
Posologie
La posologie doit être adaptée à l’intensité de la douleur et à la sensibilité à la douleur du patient
individuel. En général, la dose efficace la plus faible ayant un effet analgésique doit être
utilisée.
Les posologies recommandées sont des valeurs indicatives. En principe, il faut opter pour la posologie
la plus faible d'un analgésique. Pour le traitement de douleurs chroniques, il est recommandé d'établir
un schéma de dosage fixe.
Instaurer le traitement uniquement lorsqu'il est justifié du point de vue médical.
Ce médicament ne sera pas administré pendant plus longtemps que de besoin.
Adultes et enfants de plus de 14 ans:
En fonction de l'intensité de la douleur, la dose initiale est de 50 mg ou 100 mg, suivie par 50 ou 100
mg toutes les 4 heures.
Les douleurs aiguës exigent généralement une dose initiale de 100 mg.
Pour les douleurs chroniques, on recommande une dose initiale de 50 mg.
La posologie maximale usuelle est de 400 mg par jour.
La durée du traitement sera maintenue la plus brève possible, et le traitement sera régulièrement
interrompu.
1/8

En cas de douleur aiguë, lorsque le médicament n'est administré qu'une seule fois ou tout au plus à
quelques reprises; il n'est pas exigé d'adaptation de la dose.
Cependant, pour le traitement des douleurs chroniques, l'intervalle entre les administrations sera
augmenté en raison du risque d'accumulation dû à l'allongement de l'élimination.
Insuffisance/dialyse rénale et insuffisance hépatique:
L’élimination du tramadol est retardée chez les patients souffrant d’insuffisance rénale et/ou
hépatique. Chez ces patients, un allongement des intervalles posologiques doit être considéré de
manière prudente en fonction des besoins du patient.
Il convient d'éviter l'utilisation de tramadol chez des patients souffrant de troubles graves de la
fonction rénale (clairance de la créatinine < 10 ml/min). Il en va de même pour les patients
hémodialysés, étant donné que le tramadol est éliminé très lentement de l'organisme par hémodialyse
ou hémofiltration.
Population pédiatrique
Tramadol EG comprimés effervescents ne sont pas adaptés pour les enfants de moins de 14 ans.
Personnes âgées:
Une adaptation posologique n’est en général pas nécessaire chez les patients âgés de 75 ans ou moins
sans insuffisance hépatique ou rénale cliniquement manifeste. Chez les patients âgés de plus de 75
ans, l’élimination peut être prolongée. Dès lors, si nécessaire, les intervalles posologiques doivent être
prolongés en fonction des besoins du patient.
Dose journalière maximale autorisée et posologie en cas d'utilisation chronique:
En fonction de la gravité des douleurs, l'effet se fait sentir après 3 à 8 heures. En général, il n'est pas
nécessaire de dépasser une posologie journalière de 400 mg de tramadol chlorhydrate.
Cependant, la douleur provoquée par une malignité ou après une opération peut exiger une posologie
journalière plus importante. Pour cela, on utilisera une présentation pharmaceutique appropriée.
Troubles cérébraux:
Les patients atteints d'un trouble cérébral connu feront l'objet d'un suivi attentif pendant le traitement
avec ce produit.
Mode d’administration
Dissoudre les comprimés effervescents dans un verre d'eau avant de les avaler. Tramadol EG 50 mg,
comprimés effervescents peut être pris pendant le repas.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
Ce médicament est contre-indiqué en cas d'intoxication aiguë et/ou d'absorption excessive d'alcool,
d'hypnotiques, d'analgésiques, et de tout autre médicament qui a un effet sur le système nerveux
central.
Le tramadol ne peut pas être utilisé pendant le traitement de désintoxication de toxicomanes.
Le tramadol ne peut pas être administré à des patients qui prennent des IMAO ou qui en ont arrêté la
prise depuis moins de 2 semaines.
4.4 Mises en garde spéciales et précautions d’emploi
Le tramadol doit être administré avec prudence à ces patients souffrant d'un traumatisme crânien,
d'une pression intracrânienne accrue, d'une inconscience d'origine inconnue, d'une insuffisance
hépatique ou rénale grave, de convulsions, ou à des personnes en état de choc, ou à des patients qui
sont sensibles aux ou dépendants des opiacés.
Aux doses thérapeutiques, le risque de dépression respiratoire est faible.
2/8

La prudence est de mise chez les patients souffrant d'insuffisance respiratoire ou d'asthme, qui
prennent simultanément des médicaments qui dépriment le système nerveux central, ou lorsque la
dose recommandée de tramadol est très élevée.
On a rapporté des convulsions chez des patients traités par tramadol. Le risque de convulsions
augmente au fur et à mesure que les doses de tramadol dépassent la limite de la posologie quotidienne
de 400 mg. En outre, le risque de convulsions est plus grand chez les patients qui prennent en même
temps des médicaments qui abaissent le seuil de convulsion (voir rubrique 4.5).
Les patients épileptiques ou sensibles aux convulsions peuvent être traités au tramadol uniquement
dans des cas exceptionnels.
Le risque de dépendance est faible avec l'utilisation de tramadol. Cependant, lors d'un traitement de
longue durée, il peut apparaître une tolérance et une dépendance psychique et physique. C'est
pourquoi le tramadol doit être administré pendant de courtes périodes et sous supervision médicale à
des patients qui présentent un risque accru de toxicomanie ou de dépendance.
Le tramadol ne convient pas comme substitut pour les patients dépendant des opiacés. Bien qu'il soit
un agoniste opioïde, le tramadol ne peut pas soulager les symptômes de désintoxication de morphine.
Des effets indésirables peuvent devenir plus fréquents en cas d'administration concomitante de
millepertuis.
Il peut être nécessaire d'adapter la posologie.
Accentue le risque pour les patients qui sont suicidaires ou enclins à la dépendance, prenant des
tranquillisants ou des antidépresseurs et avertis de risque de surdosage.
Excipients à effet notoire:
- Lactose monohydraté: Ce médicament est contre-indiqué chez les patients présentant une
intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du
glucose et du galactose (maladies héréditaires rares).
- Aspartame: Contient une source de phénylalanine. Peut être dangereux pour les sujets atteints
de phénylcétonurie.
- Sodium: Ce médicament contient 9,24 mmol (ou 212,52 mg) de sodium par dose. A prendre en
compte chez les patients contrôlant leur apport alimentaire en sodium.
4.5 Interactions avec d'autres médicaments et autres formes d'interactions
L'administration concomitante de tramadol avec d’autres médicaments à action centrale, ainsi qu'avec
l'alcool, peut renforcer cette action centrale.
Le tramadol peut provoquer des convulsions et accroître le risque de convulsions causées par des
inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) tels que fluoxétine ou fluvoxamine, des
inhibiteurs de la recapture de sérotonine-noradrénaline (IRSN), des antidépresseurs tricycliques, des
antipsychotiques et d’autres médicaments abaissant le seuil convulsivant (tels que bupropione,
mirtazapine, tétrahydrocannabinole) (voir rubriques 4.4 et 5.2).
L'administration concomitante de tramadol et de cimétidine peut allonger la durée d'élimination du
tramadol. La vigilance est donc de mise lors du traitement prolongé à la cimétidine.
L'administration simultanée de carbamazépine peut réduire tant l'intensité que la durée de l'activité
analgésique du tramadol.
L'association de tramadol et d'IMAO est contre-indiquée.
Des études cliniques chez des adultes ne montrent pas d'interaction entre la warfarine et le tramadol.
Cependant, sur la base de cas isolés, la prudence s'impose lors de l'administration simultanée de
tramadol et de cet anticoagulant oral.
Lors de l'administration simultanée de tramadol et de digoxine, on a constaté dans de rares cas des
symptômes de toxicité de digoxine, comme des nausées, des vomissements et des troubles du rythme
cardiaque.
L'administration simultanée de ritonavir peut augmenter la concentration de tramadol dans le sérum,
ce qui peut provoquer une toxicité du tramadol (hébétude extrême et dépression respiratoire). Dans ce
cas, la posologie du tramadol doit être adaptée.
L'administration concomitante de tramadol et de dextrométhorphane peut entraîner une réduction du
3/8

métabolisme du tramadol par une inhibition compétitive du cytochrome P450 (CYP2D6).
L’utilisation thérapeutique concomitante de tramadol et de médicaments sérotoninergiques tels que
les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de
sérotonine-noradrénaline (IRSN), les inhibiteurs des MAO (voir rubrique 4.3), les antidépresseurs
tricycliques et la mirtazapine peut provoquer une toxicité sérotoninergique.
Un syndrome sérotoninergique est probable lorsqu’un des symptômes suivants est observé:
- Clonus spontané
- Clonus inductible ou oculaire avec agitation ou diaphorèse
- Tremblement et hyperréflexie
- Hypertonie et température corporelle > 38 °C et clonus inductible ou oculaire
L’arrêt des médicaments sérotoninergiques mène en général à une amélioration rapide. Le traitement
dépend du type et de la sévérité des symptômes.
L'administration concomitante de millepertuis peut entraîner une interaction. Celle-ci est due
probablement à l'induction de certaines isoenzymes du cytochrome P450 par le millepertuis. Il peut
être nécessaire d'adapter la posologie.
Les médicaments qui ont un effet inhibiteur avéré sur le CYP 3A4, comme le kétoconazole et
l'érythromycine, peuvent inhiber le métabolisme du tramadol (N-déméthylation) et sans doute
également le métabolisme du métabolite actif O-déméthyltramadol. L'importance clinique d'une telle
interaction n'a cependant pas encore été étudiée.
4.6 Fertilité, grossesse et allaitement
Des études conduites chez l’animal portant sur l’utilisation du tramadol ont mis en évidence, pour des
doses très élevées, un effet sur le développement organique ainsi que sur la formation osseuse et la
mortalité néonatale. Il n'a cependant pas été prouvé d'effets tératogènes.
Le tramadol franchit la barrière placentaire.
Les preuves en matière de sécurité d’utilisation du tramadol durant la grossesse chez l’espèce
humaine sont insuffisantes. Par conséquent, Tramadol EG 50 mg, comprimés effervescents, ne doit
pas être utilisé chez la femme enceinte.
Ce médicament n’influence pas les contractions de l’utérus lorsqu’il est administré avant ou après
l’accouchement.
Toutefois, l’utilisation du tramadol avant l’accouchement est absolument contre-indiquée, car elle est
susceptible de provoquer une dépression respiratoire chez le nouveau-né.
Le tramadol est contre-indiqué durant l’allaitement.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Même administré à la posologie recommandée, ce médicament est susceptible de diminuer l’aptitude
à conduire des véhicules et à utiliser des machines, un effet qui sera encore potentialisé par l’alcool et
les autres substances agissant sur le système central.
4.8 Effets indésirables
Les effets secondaires les plus fréquents sont les nausées et les vertiges, apparaissent tous deux chez
plus de 10% des patients.
Les effets indésirables ci-dessous, répertoriés selon les classes d’organes ont été rapportés avec les
fréquences suivantes: très fréquent (≥1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000,
<1/100), rare (≥1/10 000, <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être esti-
mée sur la base des données disponibles).
Affections cardio-vasculaires
Peu fréquent: troubles cardio-vasculaires (palpitations, tachycardie, hypotension orthostatique ou
collapsus cardio-vasculaire). Ils peuvent se produire surtout en orthostase et lors d'efforts physiques.
Rare: bradycardie, augmentation de la pression artérielle.
4/8

Affections du système nerveux
Très fréquent: vertiges.
Fréquent: céphalées, confusion.
Rare: altération de l'appétit, paresthésies, tremblements, dépression respiratoire, convulsions
épileptiformes.
En cas de dépassement considérable de la dose recommandée avec administration concomitante
d'autres substances à action centrale (voir rubrique 4.5), il peut se produire une dépression
respiratoire.
Des convulsions épileptiformes se produisent principalement après l'administration de doses élevées
de tramadol ou après l'administration simultanée de substances qui abaissent le seuil de convulsion
(voir rubriques 4.4 et 4.5).
Affections psychiatriques
Rare: hallucinations, confusions, troubles du sommeil et cauchemars. Des effets psychiques indésirables
peuvent se produire selon la personnalité et la durée du traitement. Il s'agit entre autres d'altérations de
l'humeur (le plus souvent résignation, parfois dysphorie), de modifications de l'activité (généralement
réduction, parfois augmentation) et de modifications de la capacité cognitive et sensorielle (p. ex.
comportement décisionnel, troubles de la perception). Il peut se manifester une dépendance.
Fréquence indéterminée: risque de suicide
Affections oculaires
Rare: vue trouble.
Affections respiratoires, thoraciques et médiastinales
On a signalé une aggravation de l'asthme, mais un lien causal n'a jamais été démontré.
Affections gastro-intestinales
Très fréquent: nausées.
Fréquent: constipations, bouche sèche, vomissements.
Peu fréquent: haut-le-cœur, irritation gastro-intestinale (lourdeur d'estomac, sensation de
ballonnement).
Affections de la peau et des tissus sous-cutanés
Fréquent: sueurs.
Peu fréquent: réactions cutanées (p. ex. démangeaisons, éruption cutanée, urticaire).
Affections musculo-squelettiques et systémiques
Rare: myasthénie.
Affections hépatobiliaires
Dans quelques cas isolés, on a rapporté une augmentation des valeurs des enzymes hépatiques.
Affections du rein et des vois urinaires
Rare: troubles de la miction (difficultés à uriner et rétention d'urine).
Trouble du métabolisme et de la nutrition
Fréquence indéterminée: hypoglycémie, hyponatrémie.
Troubles généraux et anomalies au site d’administration
Rare: réactions allergiques (p. ex. dyspnée, bronchospasme, respiration sifflante, œdème
angioneurotique) et anaphylaxie. Des symptômes de sevrage qui sont comparables aux symptômes de
sevrage chez les opiacés (p. ex. agitation, angoisse, nervosité, insomnies, hyperkinésie, tremblements et
symptômes gastro-intestinaux).
Dans ces cas, le tramadol ne sera administré que pendant de courtes périodes, sous contrôle médical
strict.
5/8
 6
6
 7
7
 8
8
1
/
8
100%