Lire l'article complet

Le Courrier de l’Arcol (2), n° 1, mars 2000
ACTUALITÉ
20
armi les causes multiples d’un syn-
drome de malabsorption chez l’en-
fant doivent être envisagées les hypocho-
lestérolémies génétiques. Le tableau
clinique inclut une diarrhée chronique, une
stéatorrhée et un retard staturo-pondéral.
L’endoscopie digestive est détermimante
pour établir ce diagnostic. En effet, la pré-
sence tout à fait remarquable d’une gelée
blanche recouvrant la muqueuse intestinale
est l’élément clef de ces pathologies que
sont : l’abêtalipoprotéinémie (ABL), l’hypo-
bêtalipoprotéinémie familiale (HBLF) et la
maladie d’Anderson (MA).
Ces maladies génétiques rares sont caracté-
risées par une hypocholestérolémie liée à
un défaut d’assemblage et/ou de sécrétion
des lipoprotéines contenant l’apolipo-
protéine B. En ce qui concerne l’origine
moléculaire de ces maladies, seuls les gènes
impliqués dans l’ABL et l’HBLF sont
connus.
L’ABL, maladie autosomique récessive rare
(environ 100 cas rapportés), est liée aux
mutations de la sous-unité lourde de la pro-
téine intramicrosomale de transfert des
lipides, (Microsomal Triglyceride Transfer
Protein, MTP), facteur essentiel à l’assem-
blage précoce intraréticulum de l’apoB avec
les lipides.
En ce qui concerne l’HBLF, maladie auto-
somique dominante (fréquence de 1/500 à
1/1 000 cas), le seul gène actuellement iden-
tifié est le gène de l’apoB. Les différentes
mutations décrites entraînent ou non l’exis-
tence de formes tronquées plasmatiques.
Le défaut moléculaire impliqué dans la mala-
die d’Anderson (appelée également “maladie
de rétention des chylomicrons”), maladie
autosomique récessive très rare (environ
36 cas rapportés), reste, à ce jour, inconnu.
Les gènes de l’apoB ainsi que des apolipopro-
téines AI, AIV, CI, CII, CIII et E, des FABP
(intestinale et hépatique) et de la MTP ont été
exclus par des études de liaison génétique.
Si le tableau clinique et biochimique
des patients atteints d’ABL ou de MA est
homogène, on note, en revanche, une
hétérogénéité au sein de l’HBLF. Celle-ci
est liée, d’une part, à l’état d’homozygotie
ou d’hétérozygotie et, d’autre part, au type
de mutation du gène de l’apoB, entraînant
ou non la circulation d’apoB tronquée dans
le plasma. Ainsi, parmi les formes homozy-
gotes, on distingue les formes sans et les
formes avec apoB tronquée plasmatique. En
revanche, il est important de noter que dans
les formes hétérozygotes, aucune distinc-
tion clinique ne peut être faite selon qu’une
apoB tronquée circule ou non dans le plas-
ma.
Contrairement aux formes asymptoma-
tiques d’HBLF (homozygotes avec apoB
tronquée plasmatique et hétérozygotes), les
patients HBLF homozygotes sans apoB
plasmatique, ABL et MA, présentent
constamment un syndrome de malabsorp-
tion lipidique associant spécifiquement :
– une stéatorrhée sous régime normo-
lipidique, résolutive sous régime hypo-
lipidique ;
– l’aspect de gelée blanche de la muqueuse
duodéno-jéjunale à l’endoscopie digestive
(qui est quasi pathognomonique de ces
pathologies) ;
– une surcharge lipidique des entérocytes à
l’examen histochimique ;
– l’absence d’augmentation des triglycé-
rides et d’apparition des chylomicrons à
l’épreuve de charge en lipides ;
– une diminution des taux plasmatiques des
vitamines liposolubles avec, comme corol-
laire, des risques secondaires de complica-
tions neuro-ophtalmiques ;
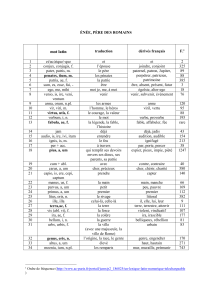
– une hypocholestérolémie : 0,20 à 0,50 g/l
de cholestérol total pour les ABL et HBLF
sans apoB plasmatique, supérieur à 0,50 g/l
pour les MA ; les triglycérides étant infé-
rieurs à 0,10 g/l pour les ABL et les HBLF
sans apoB plasmatique, normaux, voire aug-
mentés pour les patients MA ;
– une diminution ou une absence des lipo-
protéines contenant l’apoB ;
– une diminution de 50 % des HDL et de
l’apoAI.
De façon plus spécifique, l’ABL et l’HBLF
homozygote sans apoB plasmatique présen-
tent un phénotype identique au niveau bio-
chimique et ultrastructural et se caractéri-
sent, de plus, par une acanthocytose.
Biochimiquement, les deux formes d’ apoB
plasmatique, codées par le même gène,
B100 d’origine hépatique et B48 d’origine
intestinale, sont toutes deux absentes du
plasma, de même que les lipoprotéines les
contenant. Ultrastructuralement, il y a une
accumulation massive de lipides dans les
entérocytes et les hépatocytes. Celle-ci
résulte d’une absence complète d’assem-
blage des lipoprotéines contenant l’apoB,
que ce soit au niveau intestinal ou hépa-
tique. Le diagnostic différentiel entre l’ABL
et la forme HBLF sans apoB plasmatique ne
peut s’établir qu’à partir de l’enquête fami-
liale. L’ABL se transmettant sur un mode
autosomique récessif, les sujets hétérozy-
gotes ABL sont normocholestérolémiques.
Au contraire, l’HBLF se transmettant sur un
mode autosomique dominant, les sujets
hétérozygotes présentent des taux diminués
*INSERM U327, faculté de médecine
Xavier-Bichat, Paris.
** Centre de génétique moléculaire, UPR
9061, CNRS, Gif-sur-Yvette.
Les hypocholestérolémies
génétiques
N. Berriot-Varoqueaux*, L. P. Aggerbeck**, M.-E. Samson-Bouma
P
P

21
Le Courrier de l’Arcol (2), n° 1, mars 2000
de cholestérol, de LDL-cholestérol et
d’apoB.
En ce qui concerne la maladie d’ Anderson,
celle-ci est caractérisée, biochimiquement,
par l’absence des lipoprotéines contenant
l’apoB48, la diminution des lipoprotéines
contenant l’apoB100 et, ultrastructuralement,
par une accumulation massive de lipides
libres et de lipides assemblés sous forme de
particules lipoprotéiniques (chylomicrons)
dans les entérocytes. L’aspect ultrastructural
des entérocytes des patients atteints de la
maladie d’Anderson suggérerait plutôt un
défaut de sécrétion des chylomicrons.
Le syndrome de malabsorption lipidique
entraîne dans la petite enfance un syndrome
cœliaque avec une diarrhée chronique, un
retard staturo-pondéral ainsi que des
carences en vitamines liposolubles. Un régi-
me hypolipidique permet l’arrêt de la diar-
rhée avec normalisation de la stéatorrhée et
reprise de la courbe staturo-pondérale. Les
carences en vitamines liposolubles nécessi-
tent une supplémentation à fortes doses
pour prévenir l’apparition, à plus ou moins
long terme, de complications neuro-réti-
niennes. Celles-ci sont particulièrement pré-
coces et graves chez les patients ABL. Elles
apparaissent le plus souvent au cours de la
première ou de la deuxième décennie, et
miment une maladie de Friedreich. La myo-
pathie observée est complexe, résultant à la
fois de la dégénérescence nerveuse et/ou
d’une myosite intrinsèque. L’évolution cli-
nique est variable mais, en l’absence de trai-
tement, amène progressivement un impor-
tant handicap à la marche.
Au niveau ophtalmique, les premiers signes
sont l’altération de la vision de nuit et des
couleurs. Il s’ensuit une diminution de
l’acuité visuelle. À l’examen du fond d’œil
apparaît une rétinite pigmentaire. Aux
stades plus avancés, il y a disparition des
éléments scotopiques, puis évolution finale
vers l’extinction. Chez les patients HBLF
sans apoB plasmatique, il semble que l’ap-
parition des troubles neuro-rétiniens est
retardée par rapport à l’ABL, avec, de ce
fait, une évolution moins sévère. Il en est de
même chez les patients atteints de MA. La
fréquence d’apparition des signes neuro-
ophtalmiques augmente avec l’âge des
patients et est liée à la durée de la carence
vitaminique. Ainsi, à condition d’être ins-
tauré précocement, le traitement vitami-
nique E à fortes doses semble pouvoir pré-
venir l’apparition des lésions neurolo-
giques. Celui-ci est également indispen-
sable pour prévenir les lésions rétiniennes
pour lesquelles le traitement par vitamine A
n’est pas suffisant.
Contrairement à l’ABL, à l’HBLF sans
apoB plasmatique et à la MA, les autres
formes d’HBLF (hétérozygote et homozy-
gote avec apoB tronquée plasmatique) n’en-
traînent pas ce syndrome de malabsorption
lipidique. Cela suggère que la sécrétion
intestinale des formes tronquées d’apoB
suffit à éviter le syndrome de malabsorption
lipidique et par voie de conséquence les
déficits vitaminiques. Dans ce contexte, une
vitaminothérapie systématique ne se justifie
pas dans ces formes d’HBLF.
En ce qui concerne, de façon plus spéci-
fique, les patients ABL ou HBLF sans apoB
plasmastique, la fréquence de la stéatose
hépatique, avec risque d’évolution cirrho-
tique doit inciter à surveiller les fonctions
hépatiques de ces patients. En effet, plu-
sieurs cas de stéatose hépatique, confirmée
à l’examen anatomopathologique, sont rap-
portés chez ces sujets. Comme au niveau
intestinal, le foie semble donc être le siège
d’une surcharge lipidique. Parmi ces cas de
stéatose, quatre patients ont développé une
cirrhose (deux ABL, deux HBLF homo-
zygotes sans apoB). La physiopathogénie
de l’évolution cirrhotique est obscure, mais
il reste important de contrôler le bilan hépa-
tique de ces patients et d’évaluer systémati-
quement la stéatose au diagnostic. De façon
inconstante, dans les formes hétérozygotes
avec et sans apoB tronquée plasmatique et
dans la maladie d’Anderson, une stéatose
modérée est également rapportée. Mais
aucun cas d’évolution cirrhotique n’est
actuellement décrit. Dans ce contexte, le
bilan étiologique d’une stéatose hépatique
isolée doit comporter un dosage plasma-
tique d’apoB pour écarter une forme hétéro-
zygote d’HBLF.
Dans le contexte de ces hypocholestérolé-
mies génétiques, il nous paraît important de
souligner que, en dehors de l’ABL, de
l’HBLF et de la MA, deux autres grands
axes étiologiques sont à éliminer : les hypo-
cholestérolémies génétiques liées à une
diminution des HDL et les hypocholestéro-
lémies secondaires à une pathologie non
liée aux lipoprotéines (états chroniques
de malabsorption et de malnutrition,
hépatopathies sévères, néphropathies, hyper-
splénisme, hémopathies malignes et enfin
dysthyroïdies).
Conclusion
Il est important de signaler que certains cas
d’hypocholestérolémie (isolés ou fami-
liaux), au mécanisme physiopathogénique
inexpliqué, ne peuvent être classés dans
aucun des cadres nosologiques actuellement
définis. ■
Pour en savoir plus
✘
Kane J. P., Havel R. J. The metabolic and mole-
cular basis of inherited disease. Scriver C. R.,
Beaudet A. L., Sly W. S., Valle D. (eds.)
McGraw-Hill, New York, 1995, Vol. 2 : pp. 1853-85.
✘
Linton M. F., Farese R. V., Young S. G. Familial
hypobetalipoproteinemia. J Lipid Res 1993 ; 34 :
521-41.
✘
Gordon D. A. Recent advances in elucidating the
role of the microsomal triglyceride transfer protein
in apolipoprotein B lipoprotein assembly. Curr Op
Lipidol 1997 ; 8 : 131-7.
✘
Bouma M. E., Beucler I., Aggerbeck L. P., Infante R.,
Schmitz J. Hypobetalipoproteinemia with accumula-
tion of an apoprotein B-like protein in intestinal
cells. J Clin Invest 1986 ; 78 : 398-410.
✘
Roy C. C., Levy E., Green P.H.R., Sniderman A.,
Letartre J., Buts J. P., Orquin, J., Brochu P.,Weber A.M.,
Morin C.L., Marcel Y., Deckelbaum R.J.
Malabsorption, hypocholesterolemia and fat-filled
enterocytes with increased intestinal apolipoprotein B.
Gastroenterology 1987 ; 92 : 390-9.
1
/
2
100%