La découverte à la une

A l z h e i m e r I n f o s H o r s - s é r i e d é c e m b r e 2 0 1 5
- 7
* G8 : Groupe de discussion formé des chefs d’État et de gouvernement des 8 pays les plus industrialisés.
La découverte à la une
DANS LE SECRET DES AMYLOÏDES
Connu pour former des plaques qui étouffent les neurones, le peptide amyloïde ȕ
semble jouer un rôle important dans la maladie d’Alzheimer. Mais des chercheurs
viennent de découvrir un autre peptide amyloïde, nettement plus abondant, qui
perturbe aussi le processus de mémorisation et paraît fort néfaste.
Alpha, bêta, gamma… Loin de se résumer à un seul membre, les peptides amyloïdes
constituent une véritable famille. Nombreux et variés, longs ou courts, légers ou lourds.
Mais jusqu’à présent, tous s’effaçaient derrière un chef de file au notoire succès :
le peptide amyloïde ȕ. Dans le cerveau des personnes atteintes de la maladie d’Alzhei-
mer, il s’accumule et forme des plaques. Marqueurs biologiques de la pathologie, ces
plaques étouffent et affaiblissent les neurones, qui ne parviennent plus à transmettre
correctement l’information. Mais voilà qu’un petit nouveau vient de lui voler la vedette :
le peptide amyloïde Ș (prononcez êta). Présent dans le cerveau en quantité bien plus
importante, il serait, lui aussi, capable de perturber le fonctionnement des cellules
nerveuses.
Neurones perturbés
Pour les chercheurs allemands qui l’ont mis au jour(1), le peptide amyloïde Ș constitue-
rait une clé importante de compréhension de la maladie. In vitro, il altère la plasticité
synaptique. Il empêche donc les neurones de communiquer entre eux. Plus précisé-
ment, le peptide s’oppose au renforcement du passage de l’information d’un neurone
à l’autre. Or, ce phénomène est à l’origine du processus de mémorisation. En outre,
le peptide Ș agit spécialement dans l’hippocampe, cette région cérébrale parfois
considérée comme le siège de la mémoire. Pour confirmer leurs premiers résultats, les
scientifiques ont conduit des expériences in vivo. Ils ont mesuré l’activité des neurones
dans le cerveau de souris endormies, le temps de la manipulation. Ici encore, le pep-
tide amyloïde Ș a déréglé l’activité neuronale.
Jeux de ciseaux
En réalité, tous les peptides amyloïdes (Alpha, bêta, gamma…) proviennent d’une
grosse protéine, baptisée APP, pour amyloïd precursor protein (protéine précurseur
amyloïde). Dans les neurones, cette grosse molécule, enchâssée dans la membrane
des cellules, est découpée par des « ciseaux moléculaires » appelés enzymes. Première
paire de ciseaux à intervenir, la ȕ-sécrétase. Elle coupe la protéine APP en deux. Puis
la Ȗ-sécrétase intervient à son tour. En tranchant le morceau d’APP resté à l’intérieur
du neurone, elle libère le peptide amyloïde ȕ, celui qui s’accumule dans le cerveau
des patients. Les spécialistes parlent de « voie toxique ». Dans leur recherche de thé-
rapie contre la maladie, ils sont nombreux à vouloir bloquer cette voie. Actuellement,
plusieurs pistes visent à inhiber l’action de l’enzyme ȕ-sécrétase. Des essais cliniques,
assez encourageants, sont en cours.
(1) Michael Willem et al. « Ș-Secretase processing of APP inhibits neuronal activity in the hippocampus », Nature, 31 août 2015
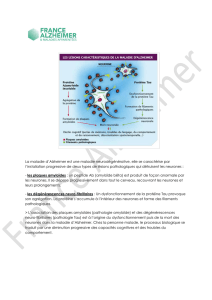
Ce que l’on sait déjà
sur la pathologie amyloïde Ce que l’on a découvert
1. l’enzyme ȕ-sécrétase
vient couper la protéine APP,
puis l’enzyme Ȗ-sécrétase
intervient à son tour
L’objectif jusqu’à présent,
bloquer l’enzyme Ȗ-sécrétase
libérant le peptide aȕ qui va s’accumuler
dans le cerveau.
Une découverte qui interroge,
car le peptide aȘ, nettement plus abondant que
le peptide aȕ, semble lui aussi avoir des effets
néfastes.
1. une nouvelle paire de ciseaux,
l’enzyme Ș-sécrétase pourrait
générer une autre voie toxique
Enzyme
ȕ-sécrétase
Peptide aȕPeptide aȘ
Enzyme
Ș-sécrétase
Enzyme
Ȗ-sécrétase
Enzyme
Į-sécrétase
2. Ce mécanisme
libère
le Peptide aȕ
2. Ce mécanisme
libère
le Peptide aȘ

La découverte du peptide amyloïde Ș est-elle
vraiment importante ?
On connaissait déjà de nombreux peptides
amyloïdes. La protéine précurseur amyloïde APP
est coupée par plusieurs enzymes. Il y a donc une
multitude de fragments, qui sont autant de peptides
amyloïdes. Dans cette dernière étude, l’équipe de
chercheurs allemands a identifié un
nouveau site de coupure sur cette grosse
protéine. Les scientifiques ont également
bien identifié l’enzyme à l’origine de cette
coupure, ainsi que les peptides générés.
Désormais, il faudra les rechercher chez
les patients. En termes de réalisation
scientifique, cette nouvelle étude est un
beau travail. C’est de la biochimie de haut
vol. Mais pour être complet, il faudrait
ajouter des tests comportementaux sur
les souris. Ils permettraient d’observer dans quelle
mesure la mémoire des animaux est affectée. Ces
expériences manquent encore.
Cette découverte peut-elle conduire à une
nouvelle piste thérapeutique ?
Oui. D’ailleurs, une équipe française travaillait déjà
sur cette nouvelle piste thérapeutique. Elle a rendu
ses résultats publics en juillet dernier, soit peu avant la
publication des chercheurs allemands sur le peptide
amyloïde Ș. Les deux groupes travaillent sur la même
enzyme, que les chercheurs allemands ont baptisée
Ș-sécrétasse. L’équipe dirigée par Santiago Rivera, à
Marseille, a obtenu des résultats spectaculaires. En
travaillant sur un modèle de souris qui mime une forme
familiale de la maladie d’Alzheimer, les Français ont
montré que la suppression de l’enzyme Ș-sécrétase
diminue la formation des plaques amyloïdes et
réduit l’inflammation cérébrale dans le cerveau des
animaux. Surtout, les expériences ont montré que la
mémoire des souris était alors préservée ! C’est donc
une piste sérieuse.
Faut-il abandonner les essais cliniques en cours ?
L’inhibition de la ȕ-sécrétase est une voie
thérapeutique prometteuse. Elle empêche la
fabrication du peptide amyloïde ȕ. Lorsqu’il
s’accumule, les plaques caractéristiques de la
maladie d’Alzheimer se forment. Plusieurs essais
cliniques avancés sont en cours. Malheureusement,
les travaux de l’équipe allemande
montrent qu’en parallèle, cette voie
thérapeutique augmente la concentration
du peptide Ș. Or ce dernier paraît avoir
une action défavorable sur les processus
mnésiques. Cela prouve qu’il ne faut pas
complètement bloquer l’activité d’une
enzyme. Heureusement, aujourd’hui, les
doses administrées ne permettent pas
d’inhiber l’enzyme à 100 %. Elles devraient
donc limiter l’augmentation de production
de peptide Ș. Je crois surtout que dans la maladie
d’Alzheimer, comme dans de nombreuses autres
pathologies, la solution viendra d’une multithérapie.
A l’avenir, nous pourrons combiner plusieurs
molécules qui agissent à des endroits différents.
Par exemple, nous pourrions inhiber en partie la
ȕ-sécrétase, pour réduire la production de peptide
amyloïde ȕ, et inhiber en partie la Ș-sécrétase, pour
réduire la production de peptide amyloïde Ș. A ces
deux voies, il sera possible d’ajouter une molécule qui
s’attaque aux symptômes de la maladie, comme le
donépézil. Tout cela n’est qu’hypothèse, mais je crois
à cette multithérapie. D’ailleurs, la combinaison se
fera peut-être en fonction du profil du patient. Cette
identification des profils de patients est importante,
car la maladie d’Alzheimer est très hétérogène.
(2) Labélisée chercheuse d’avenir par la région Languedoc-Roussillon
Un peptide néfaste
En cherchant à comprendre comment ce nouveau peptide amyloïde Ș est fa-
briqué, les scientifiques allemands ont mis la main sur une nouvelle paire de
ciseaux moléculaires. Ils ont baptisé cette enzyme l’Ș-sécrétase. Son action sur
la grosse protéine précurseur amyloïde APP génère un fragment qui pourra, à
son tour, être coupé par l’une ou l’autre des enzymes déjà connues. Quand la
ȕ-sécrétase intervient après l’Ș-sécrétase, elle libère un fragment inoffensif. En
revanche, quand une autre enzyme, l’Į-sécrétase, entre en jeu après l’Ș-sécré-
tase, elle génère un fragment plus long, donc plus stable, aux effets néfastes.
C’est le fameux peptide amyloïde Ș.
De futurs médicaments déjà périmés ?
Problème ? : le blocage de la ȕ-sécrétase, piste thérapeutique fort promet-
teuse pour lutter contre la formation des plaques amyloïdes dans le cerveau
des patients, entraîne une augmentation massive de la concentration du pep-
tide Ș. Ainsi, en voulant supprimer la fabrication du peptide amyloïde ȕ, on
génère davantage de peptide amyloïde Ș. Ces résultats inquiètent l’ensemble
de la communauté scientifique. Faut-il pour autant abandonner les essais cli-
niques en cours ? Pas si vite, répondent les chercheurs. Il faudra seulement
être extrêmement vigilant sur les possibles effets indésirables des thérapies
à l’étude.
Pour Sylvie Claeysen(2), chercheuse Inserm à l’Institut de génomique fonction-
nelle de Montpellier, la découverte du peptide Ș peut conduire à une nouvelle
piste thérapeutique. D’ailleurs, une équipe française l’a déjà étudiée,
avec des résultats prometteurs.
« Cette
nouvelle piste
thérapeutique
a montré des
résultats
spectaculaires »
8 -
A l z h e i m e r I n f o s H o r s - s é r i e d é c e m b r e 2 0 1 5
LAURÉATE
2010
DE FRANCE
ALZHEIMER
1
/
2
100%