LÉSIONS DE L`ADN ET MALADIE D`ALZHEIMER

LA FEUILLE ROUGE -
Comité de rédaction : E. Molva, J. Planès (DIR), P. Dalmas de Réotier (SPSMS), L. Dubois (SCIB), N. Luchier (SBT).
S. Lyonnard (SPRAM), G. Prenat (SPINTEC), P. Warin (SP2M) - Mise en page : M. Benini (DIR) tél. 04 38 78 36 33
INSTITUT NANOSCIENCES ET CRYOGÉNIE
Commissariat à l’Énergie Atomique et aux Énergies Alternatives - Direction des Sciences de la Matière - Centre de Grenoble
Mais quelle est la relation entre une mala-
die neurodégénérative et les dommages de
l’ADN ? Ces dommages, ou modifications
de la structure chimique, sont habituellement
évoqués dans l’apparition des cancers puisqu’ils
induisent des mutations capables de déclencher
la croissance anarchique des cellules en tumeur.
La présence des lésions de l’ADN a cependant
une autre conséquence moins souvent mise
en avant : la mort cellulaire. En effet, pour
éviter que des cellules mutées ne se propagent
dans les organes, un processus de « suicide »
cellulaire est déclenché lorsque la fréquence
des dommages de l’ADN est trop élevée.
C’est l’apoptose. Dans la plupart des tissus, les
cellules ainsi perdues sont facilement rempla-
cées par division cellulaire. Malheureusement,
il n’en va pas de même pour les neurones
qui n’ont pas de capacité à se diviser. C’est
ainsi que l’induction de l’apoptose est une des
explications à la mort massive de cellules dans
les cerveaux des patients atteints de la maladie
d’Alzheimer.
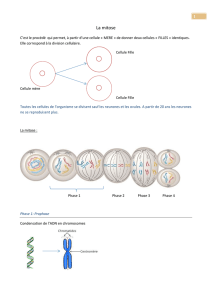
Réparation déficiente
Il est maintenant bien établi que la maladie
conduit à une accumulation des dommages
de l’ADN dans les neurones (voir encart).
De même, il a été observé que ces neurones
avaient des capacités réduites à éliminer les
dommages, en un mot que leurs systèmes de
réparation de l’ADN fonctionnait mal. Nous
nous sommes penchés sur l’origine de ces phé-
nomènes. Nous avons en particulier étudié le
rôle d’un petit morceau de protéine, le peptide
Aβ (voir encart). Pour cette étude, nous avons
utilisé des cellules en culture (Fig. 1) capables,
ou non, de sécréter ce peptide Aβ. Nous avons
vérifié dans un premier temps que la présence
de ce peptide rendait bien l’ADN plus sensible
à la formation des dommages, notamment en
présence d’espèces oxydantes comme l’eau
oxygénée (Fig. 2).
Les effets délétères du peptide Aβ
La seconde étape du travail a consisté à
déterminer l’expression des gènes codant des
enzymes de réparation de l’ADN, mesurer les
quantités de protéines correspondantes, et enfin
évaluer l’efficacité des activités de réparation.
Toutes les données sont convergentes : la répa-
ration de l’ADN est moins efficace dans les
cellules où est produit le peptide Aβ. Et pire,
alors que l’exposition à des agents oxydants
stimule la réparation dans les cellules normales,
elle la diminue dans les cellules produisant Aβ.
Il y a donc deux effets synergiques dans les
neurones malades sous l’influence de la
présence d’Aβ : une plus importante induction
de dommages de l’ADN, et une moins bonne
capacité à les éliminer. Cette combinaison
d’effets délétères est particulièrement néfaste
et ouvre la voie à l’apoptose des neurones
observée chez les patients. Le rôle du peptide
Aβ devra par la suite être étudié dans un
contexte prenant en compte une autre protéine
s’accumulant dans les cellules des malades : la
protéine Tau.
Les symptômes de la maladie d’Alzheimer s’expliquent par la mort des neurones du cerveau, en particulier dans le cortex et
l’hippocampe. Le laboratoire LAN vient de mettre en évidence un lien entre la présence du peptide Aβ, un bout de protéine sécrété
anormalement lors de la maladie, et une augmentation des dommages de l’ADN accompagnée d’une baisse des capacités de
réparation.
Alzheimer et neuropeptide Aβ
La maladie d’Alzheimer est liée au vieillisse-
ment, le risque étant de 1 % entre 65 et 69 ans,
20 % entre 85 et 89 ans et 38 % entre 90 et 95 ans.
C’est une pathologie évolutive dont les symptômes
s’intensifient sur la dizaine d’année d’espérance de
vie après diagnostic.
L’étude post-mortem des cerveaux de patients
atteint de la maladie a montré deux phénomènes
physiopathologiques liés à la présence en excès de
certaines protéines. Les premières, les protéines Tau,
sont à l’intérieur des neurones où elles forment des
filaments, les fibrilles.
L’autre espèce protéique impliquée est le
peptide béta-amyloïde, ou Aβ que l’on retrouve
accumulé sous forme de plaque dans les stades
avancés. Ce peptide, ou fragment de protéine, est
engendré par les cellules, par coupure sélective
d’une protéine ancrée dans leur membrane : l’APP
(amyloid precursor protein). C’est donc un processus
tout à fait normal qui joue un rôle important dans les
fonctions cérébrales.
Cependant, dans les cerveaux malades, la
coupure de l’APP ne se fait pas correctement est
c’est un peptide Aβ tronqué et toxique qui est
produit. On peut noter, parmi ses propriétés
néfastes, une forte capacité à interagir avec les
ions métalliques et à engendrer radicaux libres et
espèces oxydantes.
LÉSIONS DE L’ADN ET MALADIE D’ALZHEIMER
Contact : Walid Rachidi – SCIB – [email protected]
santé
N° 580 Février 2012 - inac.cea.fr/feuille_rouge
Fig. 2 : Dommages de l’ADN vu par la méthode
des comètes. Les brins d’ADN cassés sont « extraits »
du noyau des cellules par un champ électrique, et
l’ADN est visualisé par fluorescence. Les noyaux
prennent une forme de comète et le pourcentage de
fluorescence dans la queue est corrélé à l’endom-
magement. Le peptide Aβ augmente le taux de
lésion par rapport à l’échantillon témoin, et de façon
encore plus marquée en présence d’eau oxygénée.
Fig. 1 : Des neurones en culture, ou plus exactement
une lignée de neurones cancéreux, ont été utlisées
pour ce travail. On en voit un échantillon sur la
photographie. Chacune de ces cellules avec sa
forme caractéristique mesure quelques dizaines de
microns.
1
/
1
100%