Lire l'article complet

La Lettre du Rhumatologue - n° 238 - janvier 1998
25
AUTRES MALADIES SYSTÉMIQUES
SCLÉRODERMIE
Les facteurs de risque
L’exposition aux solvants augmente le risque de sclérodermie
systémique. Lacey et coll. (États-Unis) ont effectué une étude
cas-témoin aux États-Unis (Michigan et Ohio) de 1985 à 1992.
Ils ont comparé 472 sclérodermies féminines à 2 027 témoins
appariés qu’ils ont contactés téléphoniquement. Cet interroga-
toire a eu comme objectif d’analyser le type d’activité profes-
sionnelle ou ménagère exposant les patients à des solvants.
Parmi 16 professions exposées, le nettoyage à sec (risque relatif :
1,46) et la coiffure (risque relatif : 1,64) augmentent le risque de
sclérodermie systémique. Différents solvants et décapants sem-
blent incriminés, en particulier le trichloréthylène (risque relatif :
2,3) et le gazoline (risque relatif : 1,78).
Pathogénie
Anomalies de la synthèse du collagène de type I dans la sclé-
rodermie
Les lésions sclérodermiques se caractérisent par une production
excessive de collagène de type I par les fibroblastes dermiques.
Cet excès de synthèse collagénique s’explique par une hyperac-
tivité transcriptionnelle du gène du collagène I qui est liée à deux
types d’anomalies :
– Le promoteur du gène du collagène I peut être activé par le TGF
bêta sécrété par les fibroblastes dermiques. Il s’agit donc d’un
véritable mécanisme autocrine dont le signal inducteur est encore
inconnu (Trojanowska et coll., États-Unis).
– La régulation du promoteur du gène du collagène I des fibro-
blastes dermiques pourrait être anormale, comme l’a montré
l’étude de la séquence du premier intron de ce gène (Hitraya et
coll., États-Unis).
Une meilleure connaissance de ces mécanismes peut aboutir à de
nouvelles stratégies thérapeutiques dans la sclérodermie.
L’analogie entre la sclérodermie systémique et la réaction du
greffon contre l’hôte (GVHD “Graft-Versus-Host Disease”)
s’explique par un microchimérisme materno-fœtal.
Les analogies cliniques (sclérose cutanée, troubles de la pig-
mentation, syndrome sec) entre la sclérodermie systémique et la
GVHD sont frappantes. En raison de cette analogie, plusieurs
auteurs ont recherché un microchimérisme (c’est-à-dire la pré-
sence de cellules étrangères) dans le sang et les tissus de la sclé-
rodermie.
L’hypothèse d’un microchimérisme fœto-maternel a été évoquée
en raison de la prédominance féminine de la sclérodermie, et sur-
tout en raison de son déclenchement après une ou plusieurs gros-
sesses. Ainsi un grand intérêt a été porté à la découverte de cel-
lules fœtales dans la circulation sanguine ou les tissus maternels,
même très longtemps après la grossesse (jusqu’à 37 ans après !).
Il a été aussi démontré qu’un chimérisme materno-fœtal est pos-
sible, car des cellules maternelles peuvent passer et persister
(durée non précisée) dans la circulation sanguine et les tissus de
l’enfant. La survie de ces cellules “étrangères” s’explique par une
compatibilité HLA de classe 2 qui permet de comprendre pour-
quoi elles ne sont pas éliminées par le système immunitaire de
l’hôte.
Ainsi ce microchimérisme pourrait, dans certaines conditions,
participer à la pathogénie de la sclérodermie, comme l’ont signalé
White et coll., Nelson et coll. et Artlett (États-Unis).
Ils ont constaté que la fréquence de la compatibilité HLA de
classe 2 mère-enfant était de 17 à 21 % dans la population géné-
rale mais de 64 à 73 % dans la sclérodermie. Cette constatation
suggère qu’une compatibilité HLA de classe 2 mère-enfant pour-
rait favoriser l’apparition d’une sclérodermie en facilitant les phé-
nomènes de microchimérisme.
Dans les sclérodermies masculines et les formes féminines (sans
antécédent de grossesses), ce microchimérisme peut être lié à la
transmission de cellules lors d’une transfusion ou par la persis-
tance dans l’organisme de cellules d’origine maternelle (HLA
classe 2 compatibles). En effet Nelson et coll. (États-Unis) ont
Autres maladies systémiques
■L’exposition aux solvants augmente le risque de scléro-
dermie systémique.
■L’analogie entre la sclérodermie systémique et la réaction
du greffon contre l’hôte s’explique par un microchimérisme
materno-fœtal.
■Le rhumatisme fibroblastique : un diagnostic différentiel
de la sclérodermie systémique.
■L’association aspirine-héparine de bas poids
moléculaire : un traitement des fausses couches répétées
dans les maladies auto-immunes.
■La ciclosporine peut être un traitement efficace des
néphropathies lupiques sévères.
■La pilocarpine per os : un traitement du syndrome de
Gougerot-Sjögren.
POINTS FORTS
POINTS FORTS

La Lettre du Rhumatologue - n° 238 - janvier 1998
26
AUTRES MALADIES SYSTÉMIQUES
démontré que chez une patiente atteinte de sclérodermie (n’ayant
jamais eu d’enfant), il existe une sous-population lymphocytaire
exprimant des marqueurs HLA classe 1 exclusivement d’origine
maternelle. En effet, en comparant les haplotypes HLA, ils ont
constaté que les antigènes HLA de classe 2 sont strictement iden-
tiques mais que les molécules de classe 1 diffèrent. La mère est
HLA B44 et B35 et la fille B8 et B35. L’étude de l’ADN des lym-
phocytes de la patiente sclérodermique objective la présence
d’ADN HLA B44 d’origine maternelle par une technique d’am-
plification génique (PCR). Il s’agit de la première description
d’un microchimérisme materno-fœtal lié à la persistance de cel-
lules maternelles dans la circulation d’un sujet adulte.
La persistance de cellules fœtales peut être affirmée par la détec-
tion d’ADN chromosome Y par PCR chez des femmes scléro-
dermiques ayant donné naissance à un enfant mâle. Cette
méthode, qui a été utilisée dans la plupart des études, a permis
de constater que :
– des cellules fœtales circulantes (lymphocytes) sont présentes
dans la circulation de 40 à 50 % des sclérodermies, mais aussi de
20 à 50 % de femmes témoins saines,
– des cellules fœtales ont été isolées dans la peau, le rein et le
poumon sclérodermique chez 5 patients, mais ces résultats n’ont
pas été comparés à ceux obtenus dans différents tissus sains.
Au total, la constatation d’un microchimérisme materno-fœtal ou
fœto-maternel est un phénomène tout à fait étonnant. Ce phéno-
mène semble physiologique, surtout quand il existe une compa-
tibilité HLA de classe 2 mère-enfant. Ce microchimérisme pour-
rait intervenir dans la pathogénie de la sclérodermie, mais des
études ultérieures sont nécessaires pour comprendre les méca-
nismes des lésions cutanées ou viscérales sclérodermiques.
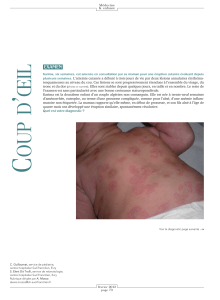
Le rhumatisme fibroblastique : un diagnostic différentiel de
la sclérodermie systémique
Masson et coll. (Angers, France) ont décrit trois nouvelles obser-
vations de rhumatisme fibroblastique, portant à 17 l’ensemble des
observations actuellement publiées. Cette affection, dont le sex-
ratio est proche de 1/1, se caractérise surtout par des nodules cuta-
nés (100 % des cas), des polyarthralgies ou une polyarthrite (95 %
des cas), une sclérodactylie (90 % des cas) souvent associée (50 à
60 % des cas) à une contracture des doigts ou de la main
(figure 1)
.
Dans un tiers des cas, il existe aussi un œdème de la main, avec
parfois un phénomène de Raynaud. Les signes généraux sont
rares, mais une fièvre est signalée dans près de 30 % des cas. Dans
les formes chroniques, des érosions osseuses épiphysaires sont
notées dans 50 % des cas, avec exceptionnellement des arthro-
pathies destructrices.
Le diagnostic est évoqué devant les manifestations cliniques mais
confirmé par l’histologie spécifique des nodules. Les diagnostics
différentiels qui doivent être évoqués sont : la sclérodermie sys-
témique, la fasciite palmaire paranéoplasique, la réticulo-histio-
cytose multicentrique, la cheiroarthropathie diabétique.
Traitement de la sclérodermie par le collagène I per os
Le principe de cette étude est le même que celui qui avait débou-
ché sur l’utilisation du collagène II (per os) dans la polyarthrite
rhumatoïde. L’objectif est d’induire une tolérance spécifique par
l’administration de la protéine cible par voie orale.
Postlethwaite et coll. (États-Unis) ont mené une étude ouverte
incluant 20 sclérodermies systémiques traitées pendant 6 mois
par du collagène I bovin administré per os à la dose de 0,1 mg/j
pendant un mois puis 0,5 mg/j pendant les 5 mois suivants.
Ce traitement a permis d’obtenir, après 6 mois, une amélioration
significative du score cutané de Rodnan (p = 0,01) et une amé-
lioration du score fonctionnel HAQ (Health Assessment Ques-
tionnaire) (p = 0,005). En revanche, on ne note pas d’améliora-
tion de la capacité vitale ou de la capacité de transfert du CO
(DLCO). Il n’y a eu aucun effet indésirable notable.
L’amélioration clinique est confirmée par l’étude in vitro des lym-
phocytes de ces patients. Ces lymphocytes ont été cultivés (avant
et après traitement) en présence des chaînes alpha 1 et alpha 2 du
collagène I humain. Après traitement, on observe une décrois-
sance significative des taux d’interféron gamma (IFNγ) et d’in-
terleukine 10 (IL10) dans le surnageant de culture. Ces résultats
démontrent que le traitement par collagène I per os a véritable-
ment modulé la réponse lymphocytaire anti-collagène I.
LUPUS ET SYNDROME DES ANTIPHOSPHOLIPIDES
Incidence et morbidité du lupus : résultats d’une enquête épi-
démiologique de 1950 à 1992 (Mayo Clinic, Rochester, États-
Unis)
Depuis quelques années, il semble que l’incidence du lupus soit
en augmentation, mais aucune donnée épidémiologique précise
ne permet de le confirmer. Gabriel et coll. ont mené à la Mayo
Clinic une enquête rétrospective qui a permis de comparer l’in-
cidence et la mortalité du lupus durant la période de 1950 à 1979
à celle de 1980 à 1992. Cette étude a permis de faire différentes
constatations :
– Durant la période de 1950 à 1979, l’incidence du lupus est éva-
luée à 1,53 nouveau lupus pour 100 000 habitants par an (lupus
induits exclus) alors que cette incidence est de 5,8 pour la période
de 1980 à 1992. Cette augmentation de l’incidence est parallèle
à une baisse de la mortalité. En effet la mortalité, par rapport à la
population générale, est moins forte de 1980 à 1992 (p = 0,015)
que de 1950 à 1979 (p < 0,0001). Cette étude suggère que l’amé-
lioration des traitements et surtout la découverte de lupus moins
sévères grâce à l’utilisation de tests plus sensibles expliquent à
la fois l’augmentation de l’incidence et la baisse de la mortalité.
Figure 1.

La Lettre du Rhumatologue - n° 238 - janvier 1998
27
– Globalement, la prévalence actuelle du lupus aux États-Unis et
dans différents pays européens (Royaume-Uni, Suède, Danemark)
est évaluée de 0,25 à 1/1 000. Pour l’instant, nous n’avons pas de
données épidémiologiques équivalentes en France.
Morbidité et mortalité du lupus en Europe : résultats de l’en-
quête Eurolupus de 1990 à 1995
Hugues et coll. décrivent les résultats de l’enquête Eurolupus qui
a inclus prospectivement, depuis 1990, 1 000 lupus issus de sept
pays européens (Belgique, Italie, Norvège, Pologne, Espagne,
Turquie et Royaume-Uni).
– Après 5 ans d’évolution, seuls 9 % (n = 90) des lupus ont été
perdus de vue.
– 4 % (n = 37) des patients sont décédés d’atteintes viscérales
lupiques (38 % des cas), d’infections (21 % des cas) et de throm-
boses liées à un syndrome antiphospholipides (16 % des cas).
– 30 % (n = 308) des patients ont été hospitalisés (durée
moyenne : 12 jours) pour une infection (11 % des cas), une
néphropathie lupique (11 % des cas), une thrombose (7 % des
cas), une complication cardiaque (7 % des cas), ou une atteinte
du système nerveux central (6 % des cas).
Les manifestations cliniques observées au cours de cette période
sont très diverses, dominées par des manifestations articulaires
(42 % des cas), des lésions cutanées (24 % des cas), une photo-
sensibilité (14 % des cas) et une néphropathie (22 % des cas). Les
autres manifestations sont plus rares (figure 2).
L’intérêt de cette enquête est de décrire de façon prospective l’évo-
lution du lupus en Europe. En particulier, il est intéressant de
constater que le syndrome des antiphospholipides est responsable
de 16 % des décès et de 7 % des hospitalisations.
Les complications du lupus
L’atteinte cardiaque (bloc auriculo-ventriculaire congénital)
du lupus néonatal : de nouveaux arguments en faveur du rôle
pathogène des anti-Ro/SS-A et anti-La/SS-B
Miranda et coll. (États-Unis) ont démontré qu’en induisant une
apoptose de cellules myocardiaques fœtales humaines en culture,
les antigènes Ro/SS-A et La/SS-B, initialement localisés dans le
noyau cellulaire, vont être exprimés à la surface de vésicules cel-
lulaires apoptotiques appelées “blebs”. Dans ces conditions, ces
antigènes nucléaires deviennent accessibles aux anticorps anti-
Ro et anti-La de la mère qui ont traversé la barrière fœto-pla-
centaire. Ces anticorps maternels peuvent alors aggraver les
lésions cardiaques fœtales en provoquant une véritable myocar-
dite dont les lésions séquellaires néonatales sont des troubles de
la conduction (bloc). In vivo, il reste à comprendre quels sont les
facteurs qui induisent l’apoptose des cellules myocardiaques
fœtales. En fait cette complication, qui ne touche qu’une femme
sur vingt avec des anti-Ro/SS-A, nécessite la conjonction de plu-
sieurs facteurs et probablement une agression myocardique inau-
gurale (infection virale ?).
Des travaux récents de cette équipe avaient démontré que les anti-
corps anti-Ro 52 kDa bêta (forme tronquée de Ro 52 kDa) étaient
significativement associés à l’atteinte cardiaque fœtale, en parti-
culier parce que le cœur du fœtus exprime une plus grande quan-
tité d’antigène Ro 52 bêta pendant la phase de mise en place de
l’ébauche cardiaque (16eet 24esemaines in utero). Miranda et coll.
(États-Unis) ont immunisé des souris femelles Balb/C avec
des
antigènes humains recombinants La 48 kDa, Ro 60 kDa, Ro 52
kDa alpha et bêta. Seules les souris immunisées avec Ro
52 kDa
alpha et bêta ont donné naissance à des souriceaux atteints de blocs
auriculo-ventriculaires complets (respectivement chez 1 souriceau
sur 32 pour Ro 52 kDa alpha et 4 sur 45 pour Ro 52 kDa bêta).
Ce travail confirme bien l’importance des anticorps anti-Ro 52
kDa (surtout bêta) dans la pathogénie de l’atteinte cardiaque du
lupus néonatal. Cette étude expérimentale démontre également
que cette complication est aussi inconstante dans le modèle expé-
rimental que chez la femme avec anti-Ro/SS-A.
Le syndrome des antiphospholipides
Les anticorps anti-bêta 2-glycoprotéine I sont des marqueurs de
la thrombose. Alarcon-Segovia et coll. (Mexico, Mexique) ont
comparé 24 lupus compliqués d’un syndrome des antiphospho-
lipides à 102 lupus sans thromboses. L’objectif de cette étude
prospective a été de comparer la valeur des anti-bêta 2-glyco-
protéines I (bêta 2 GPI) à celle des anticorps anti-cardiolipines
(ACL). Différentes constatations ont été faites :
– Les anticorps anti-bêta 2 GPI sont constamment présents en cas
de thrombose, mais seulement chez 17 % des lupus sans throm-
bose (p < 0,0001). En revanche, il n’y a pas de différence de pré-
valence ou de titre des ACL dans ces deux groupes de lupus.
– Une décroissance significative du titre des anti-bêta 2 GPI est
observée chez tous les patients au moment de la thrombose, alors
que le titre d’ACL ne baisse que chez 25 % des lupus qui throm-
bosent.
Les anti-bêta 2 GPI sont donc un meilleur marqueur du risque
thrombogène du syndrome des antiphospholipides du lupus. La
fluctuation du titre des anticorps lors de l’événement thrombo-
tique suggère que ces anticorps exercent un véritable rôle throm-
bogène.
L’association aspirine-héparine de bas poids moléculaire : un
traitement des fausses couches répétées dans les maladies auto-
immunes. Laskin et coll. (Toronto, Canada) ont mené une étude
ouverte destinée à juger de l’efficacité d’une association aspirine
(100 mg/j) + héparine de bas poids moléculaire (rivéparine
4 900 U/j autoadministrée par voie sous-cutanée). Ce traitement
a été administré à 50 patientes ayant la particularité d’avoir subi
0 10 20 30 40 50 %
Arthrites
Lésions cutanées
Néphropathies
Photosensibilité
Atteinte SNC
Syndrome de Raynaud
Sérites
Vascularites
Thromboses
Figure 2. Manifestations cliniques cumulatives : Eurolupus 1990-1995.

La Lettre du Rhumatologue - n° 238 - janvier 1998
28
AUTRES MALADIES SYSTÉMIQUES
au moins deux pertes fœtales associées à la présence d’au moins
un autoanticorps (anticorps antinucléaire, anti-DNA natif, anti-
lymphocytes, anticardiolipine et/ou anticoagulant lupique).
Parmi les 43 patientes sur 50 qui ont fini l’étude, 35 (80 %) ont
accouché normalement. Il n’y a pas eu d’anomalie congénitale,
d’incidence anormale de prématurité ou de nouveau-nés hypo-
trophes. Il n’y a pas eu de complications hémorragiques (throm-
bopénie). Le seul effet indésirable a été une ecchymose aux points
d’injection.
Cette étude a également montré l’absence de retentissement des
héparines de bas poids moléculaire sur la masse osseuse (sans que
soient précisés les données techniques et les résultats chiffrés).
L’association héparine de bas poids moléculaire et aspirine semble
être un traitement efficace et bien toléré des fausses couches répé-
tées présumées d’origine auto-immune. La rivéparine est dispo-
nible en France depuis quelques semaines pour la prévention des
thromboses.
Les ostéonécroses aseptiques
Quel est le rôle des corticoïdes ? Wong et coll. (Hong Kong) ont
observé 29 cas (10 %) d’ostéonécrose aseptique, essentiellement
de la hanche (bilatérale dans 69 % des cas), parmi 291 lupus étu-
diés rétrospectivement. Ils ont comparé le groupe de lupus avec
ostéonécroses aseptiques à 53 lupus appariés sans ostéonécrose.
Ces deux groupes de lupus n’ont pas de différence clinique, bio-
logique (anticardiolipine et anticoagulant lupique) significative
en dehors d’une plus grande fréquence d’atteintes rénales (69 %
versus 45 %, p = 0,02) et d’atteintes du système nerveux central
(41 % versus 14 %, p = 0,0005) dans le groupe avec ostéonécrose.
Dans ces deux groupes, la dose totale de corticoïdes est compa-
rable (19,7 g versus 14,1 g, p = 0,09) mais le facteur qui semble
favoriser le risque d’ostéonécrose est la dose totale initiale admi-
nistrée pendant le premier mois (1,7 g versus 1,1 g, p = 0,01) et
pendant les 4 premiers mois (4,4 g versus 2,8 g, p = 0,01).
Ce travail confirme donc que la corticothérapie, en particulier la
dose totale initiale, est le facteur de risque d’ostéonécrose le plus
important au cours du lupus. La plus grande fréquence d’atteinte
rénale et neurologique qui a été observée est donc simplement le
reflet d’une maladie sévère nécessitant une corticothérapie plus
forte.
Quel est le rôle des anti-phospholipides ? Wong et coll. (Hong
Kong) ont montré dans leur étude rétrospective qu’il n’existait
pas de corrélation entre l’ostéonécrose aseptique et la présence
d’anticorps anticardiolipines ou d’un anticoagulant circulant. En
revanche, Gharavi et coll. (États-Unis) ont montré que les diffé-
rents anticorps antiphospholipides (anticardiolipines, anti-bêta 2-
glycoprotéine I, anti-phosphatidyléthanolamine) peuvent être un
facteur de risque de l’ostéonécrose dans le lupus et le syndrome
des antiphospholipides primaires. Ce facteur de risque pourrait
potentialiser le risque induit par la corticothérapie.
Rôle de l’hyperhomocystéinémie ? Pétri et coll. (États-Unis) ont
montré que l’hyperhomocystéinémie (> 13 µmole/l) peut aug-
menter le risque d’ostéonécrose. Dans une cohorte de 337 lupus
suivis prospectivement pendant plus de 10 ans, ils ont constaté
que l’hyperhomocystéinémie était significativement associée au
risque d’ostéonécrose aseptique et de fractures ostéoporotiques.
Cette hyperhomocystéinémie semble liée à l’atteinte rénale (en
raison du métabolisme rénal de l’homocystéine) et à la prise de
corticoïdes. L’hyperhomocystéinémie pourrait favoriser non seu-
lement la morbidité cardiovasculaire, mais aussi l’ostéonécrose
aseptique du lupus.
Traitement du lupus
Le méthotrexate peut être un traitement efficace du lupus
sans atteinte viscérale sévère
Sato et coll. (São Paulo, Brésil) ont présenté une étude prospec-
tive randomisée en double aveugle comparant le méthotrexate
(15 à 20 mg per os par semaine) à un placebo dans le lupus sans
atteinte viscérale sévère.
Parmi les 41 patients inclus, 37 ont suivi le traitement pendant
6 mois, ce qui a permis d’objectiver une certaine efficacité du
méthotrexate :
– une efficacité sur les signes articulaires et cutanés (p < 0,01),
– une efficacité sur le score d’activité clinique SLEDAI (p < 0,01),
– un effet d’épargne cortisonique (p = 0,02),
– une hypocomplémentémie moins fréquente (p < 0,01).
L’efficacité de ce traitement est intéressante mais on a noté des
effets secondaires chez 13 patients sur 20 (65 % des cas). Ces
effets indésirables sont, pour la plupart, mineurs : dyspepsie, cyto-
lyse. Seuls deux patients ont arrêté le traitement pour des cyto-
pénies sans complications infectieuses.
Arce-Salinas et coll. (Mexico, Mexique) ont comparé le métho-
trexate (7,5 à 15 mg per os/semaine) à l’azathioprine (< 50 mg/j)
et à la chloroquine (< 225 mg/j) dans des lupus sans atteinte vis-
cérale. Parmi 36 lupus stables sous azathioprine ou chloroquine
depuis 6 mois, 19 ont poursuivi leur traitement et les 19 autres
ont été traités par méthotrexate après randomisation. Les résul-
tats de cette étude après 18 mois de traitement ont été :
– une efficacité comparable de ces différents traitements d’en-
tretien sur l’évolutivité globale évaluée par le score SLEDAI et
par un score fonctionnel (HAQ),
– un meilleur effet d’épargne cortisonique du méthotrexate
(p = 0,05),
– l’absence d’effet indésirable grave du méthotrexate.
Cette étude démontre que le méthotrexate est comparable à l’aza-
thioprine et à la chloroquine dans le traitement d’entretien du
lupus sans atteinte viscérale sévère.
La ciclosporine peut être un traitement efficace des néphro-
pathies lupiques sévères
Dostal et coll. (Prague, République tchèque) ont comparé, dans
une étude ouverte, la ciclosporine (3 à 5 mg/kg/j) au cyclophos-
phamide (Endoxan®) utilisé aux doses thérapeutiques usuelles
(per os ou intraveineux). Vingt-trois glomérulonéphrites dont 14
prolifératives diffuses (classe IV OMS) ont été traitées pendant
24 mois. Parmi les 11 patients traités par ciclosporine, 7 avaient
été traités préalablement par cyclophosphamide, arrêté pour inef-
ficacité (3 patients) ou intolérance (4 patients). Les deux groupes
de lupus étaient comparables et ont bénéficié d’une corticothé-
rapie identique. Les résultats de cette étude ont été les suivants :
– Une efficacité équivalente des deux traitements sur l’atteinte
rénale et les signes extrarénaux, notamment le score SLEDAI.
Parmi les 14 patients qui ont eu une biopsie rénale de contrôle
après un an, tous ont eu une diminution des critères d’activité his-
tologiques (critères OMS). .../...

La Lettre du Rhumatologue - n° 238 - janvier 1998
31
AUTRES MALADIES SYSTÉMIQUES
– Aucun patient n’a arrêté la ciclosporine pendant la durée
d’étude. Il n’y a pas eu de néphrotoxicité particulière.
La ciclosporine et le cyclophosphamide sont des traitements effi-
caces des néphropathies lupiques sévères, mais la ciclosporine
peut être une alternative intéressante, en particulier chez les
patients résistants ou intolérants au cyclophosphamide. Un des
intérêts principaux est que la ciclosporine n’expose pas aux
mêmes risques carcinologiques (cancers, lymphomes) et gynéco-
obstétricaux (stérilité, tératogénicité) que le cyclophosphamide.
SYNDROME DE GOUGEROT-SJÖGREN
Les lymphomes du syndrome de Gougerot-Sjögren ont des
caractéristiques originales
Les lymphomes non hodgkiniens sont une complication assez
fréquente du syndrome de Gougerot-Sjögren primaire (risque
relatif 44). Ces lymphomes pourraient survenir dans 10 % des
cas après 15 années d’évolution.
Mariette et coll. (France) ont étudié 16 lymphomes B non hodg-
kiniens collectés dans deux centres français (Paris et Strasbourg).
Il s’agit de 12 formes de bas grade et de 4 formes de haut grade.
Les localisations sont essentiellement extranodales (glandes sali-
vaires n = 7, estomac n = 4, poumon n = 3, peau n = 3, thymus
n = 1) et plus rarement nodales (n = 8). Histologiquement, ces
lymphomes sont décrits comme des lymphomes de la zone mar-
ginale de type MALT (“Mucosa Associated Lymphoid Tissue”)
quand ils sont à tropisme muqueux, ou de type monocytoïde
quand ils sont ganglionnaires.
L’étude du tissu lymphoïde a montré qu’il existe assez peu d’ano-
malies des oncogènes et antioncogènes. Dans la plupart des pré-
lèvements, il existe une hyperexpression non spécifique de
Bcl-2 liée, une seule fois, à une translocation chromosomique
14-18 (t, 14-18) identique à celle que l’on observe dans les lym-
phomes folliculaires. Une hyperexpression de l’antioncogène P53
n’est observée que chez un seul patient. Cette hyperexpression
est vraisemblablement la conséquence d’une mutation du gène
P53 qui rend la protéine non fonctionnelle. Ce type d’anomalie,
observée dans 10 à 15 % de l’ensemble des lymphomes, a donc
une prévalence analogue dans les lymphomes associés au syn-
drome de Gougerot-Sjögren.
L’étude virale des prélèvements, justifiée par les relations qui
existent entre virus et syndrome sec, n’a pas permis d’isoler de
génome viral des principaux virus lymphocytotropes (virus d’Ep-
stein-Barr, HLTV 1, HHV 8), même avec des techniques d’am-
plification génique (PCR) spécifiques.
Un traitement du syndrome de Gougerot-Sjögren : la pilocar-
pine per os
Il n’y a pas de traitement spécifique du syndrome de Gougerot-
Sjögren, mais différents traitements symptomatiques visant à flui-
difier ou stimuler les sécrétions (par un agent cholinergique) sont
possibles à condition qu’il n’y ait pas d’atrophie glandulaire trop
importante.
Deux études prospectives randomisées en double aveugle contre
placebo ont été menées pour démontrer l’efficacité de la pilo-
carpine per os en comprimé (Vivino et coll., Papas et coll., Sher-
rer et coll., États-Unis). Dans ces deux études, l’efficacité a été
appréciée en étudiant 6 symptômes oraux, 4 symptômes extra-
oraux et la mesure du flux salivaire (en ml/min). Les résultats
sont exprimés en pourcentage de répondeurs. La réponse est
considérée comme positive quand l’amélioration, définie sur une
échelle visuelle analogique (0 à 100 mm), a été estimée supé-
rieure ou égale à 55 mm pour la réponse globale et supérieure à
25 mm pour les autres symptômes. Ce traitement a été évalué :
– soit à dose croissante chez 256 patients traités par le placebo
ou par 4 x 5 mg/j pendant 6 semaines, puis 4 x 7,5 mg/j pendant
les 6 semaines suivantes de pilocarpine per os,
– soit à dose constante chez 373 patients traités soit par placebo,
soit par 4 x 5 mg/j ou 4 x 2,5 mg/j de pilocarpine per os.
Les résultats montrent que seule la pilocarpine à la dose de
20 mg/j améliore significativement les symptômes oraux et extra-
oraux (figure 3). Ce traitement améliore également le flux sali-
vaire (0,22 versus 0,01 ml/min, p < 0,001).
Ce traitement n’a pas d’inconvénients majeurs, mais on constate
fréquemment des sueurs, des dysuries ou des sensations de fris-
sons. Seuls 4% des patients ont arrêté leur traitement en raison
de ces effets indésirables.
LES MALADIES AUTO-IMMUNES : DE LA SOURIS À L’HOMME
Anomalies de l’apoptose et maladies auto-immunes : la sou-
ris lupique Lpr/Lpr et le syndrome de Canale-Smith
La souris Lpr/Lpr développe spontanément un syndrome lupique
et un syndrome lymphoprolifératif T (CD4–, CD8). Il a été
démontré récemment que ces anomalies étaient liées spécifique-
ment à un déficit de l’apoptose cellulaire de la voie Fas-Fas ligand.
Ce modèle expérimental démontre qu’un défaut d’apoptose peut
favoriser l’apparition de phénomènes auto-immuns et lympho-
prolifératifs.
Très récemment, il a été démontré que le syndrome de Canale-
Smith est l’équivalent humain du syndrome de la souris Lpr/Lpr.
En effet ces patients développent un syndrome lupique (néphro-
pathie, atteinte du système nerveux central, ulcération muqueuse,
anémie hémolytique auto-immune, présence de différents autoan-
ticorps) et des syndromes lymphoprolifératifs de malignités
diverses. L’étude de plusieurs familles a démontré que ce syn-
drome était aussi lié à différentes mutations (hétérozygotes) du
gène Fas (Elkon et coll., États-Unis, Hass et coll., Allemagne).
Cette affection exceptionnelle, liée à un défaut d’apoptose,
démontre que ce système contrôle la tolérance aux antigènes des
60
55
50
45
40
35
30
25
20
15
10
5
0
% de répondeurs
Amélioration
globale de la
xérostomie
Sévérité
de la sécheresse
Inconfort
oral
Utilisation
de substituts
salivaires
Dysphonie Absorption
nocturne
de boisson
s
*
** **
**
**
Placebo
Pilocarpine 20 m
g
* p0,0001
** p 0,04
Figure 3. Amélioration des symptômes oraux après pilocarpine per os.
.../...
 6
6
1
/
6
100%