Urgences

232
Métabolismes Hormones Diabètes et Nutrition (IX), n° 6, novembre/décembre 2005
Urgences
en endocrinologie, diabétologie
et maladies métaboliques
en endocrinologie, diabétologie
et maladies métaboliques
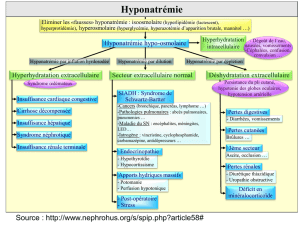
Hyponatrémie de dilution sévère
dans le cadre du syndrome de sécrétion
inappropriée d’hormone antidiurétique
Severe hyponatremia revealing an inappropriate antidiuretic
hormone secretion
H. Lefebvre*
Introduction, définition
La natrémie représente le principal
déterminant de l’osmolalité plasma-
tique. Elle doit donc être maintenue
en permanence dans des limites
étroites (135-145 mmol/l), notamment
grâce à l’intervention de plusieurs
hormones régulant le capital sodé et
le volume d’eau total. L’hormone
antidiurétique (ADH), ou arginine
vasopressine (AVP), joue un rôle
majeur dans le contrôle de l’homéo-
stasie hydrique en stimulant la réab-
sorption d’eau libre au niveau du
néphron distal. Sa sécrétion par
l’hypothalamus est normalement
activée par l’hyperosmolalité plas-
matique et l’hypovolémie. En dehors
de ces deux situations, l’augmenta-
tion de la libération d’ADH dans la
circulation est inadaptée et caracté-
rise le syndrome de sécrétion inap-
propriée d’hormone antidiurétique
(SIADH). L’excès d’ADH va favo-
riser une rétention hydrique et une
augmentation de la volémie. La sti-
mulation de la sécrétion de facteur
natriurétique auriculaire qui en résulte
va entraîner une inflation de la natriu-
rèse. Le SIADH se traduit par une
hyponatrémie de dilution le plus sou-
vent sans traduction clinique. Néan-
moins, l’excès d’ADH peut parfois
induire l’apparition d’une hypona-
trémie sévère (<125 mmol/l) respon-
sable de signes cliniques, notamment
neurologiques, nécessitant une prise
en charge thérapeutique rapide.
Cadre de survenue
Le SIADH peut compliquer l’évo-
lution d’une maladie déjà connue,
telle qu’une néoplasie bronchique,
par exemple, ou constituer la cir-
constance révélatrice d’une affec-
tion encore non diagnostiquée néces-
sitant souvent un traitement spécifique
(1). Les causes de SIADH sont très
nombreuses (tableau). Elles incluent
divers médicaments capables de
stimuler la sécrétion d’ADH ou de
potentialiser son action rénale, ainsi
qu’une grande variété de patholo-
gies neurologiques, pulmonaires,
endocriniennes et tumorales. Les
étiologies endocriniennes des SIADH
comportent l’insuffisance cortico-
trope et l’insuffisance thyroïdienne,
qu’elles soient isolées ou associées
dans le cadre de l’insuffisance anté-
hypophysaire.
Diagnostic positif
Signes cliniques
L’hyponatrémie de dilution est habi-
tuellement bien supportée sur le
plan clinique. L’apparition de signes
cliniques est corrélée à sa profon-
deur, mais surtout à sa vitesse d’ins-
tallation. Ainsi, une hyponatrémie
sévère chronique (115-125 mmol/l)
peut être bien tolérée. En règle géné-
rale, les signes cliniques s’installent
lorsque la natrémie s’abaisse rapi-
dement au-dessous de 125 mmol/l.
Ils associent des signes d’encépha-
lopathie hyponatrémique : nausées,
céphalées, asthénie, voire désorien-
tation, troubles de la conscience,
convulsions et coma. En revanche,
malgré l’inflation hydrique, il n’y a
pas d’œdème en raison de l’éléva-
tion du facteur natriurétique plas-
matique responsable d’une fuite
sodée urinaire.
Diagnostic biologique
Le diagnostic biologique du SIADH
sévère repose en premier lieu sur la
mise en évidence de l’hyponatrémie,
classiquement inférieure à 125 mmol/l
dans ce cadre. Les pseudohypona-
trémies liées aux hyperlipidémies
majeures et aux hyperprotidémies
monoclonales satellites de la mala-
die de Waldenström ou du myélome
multiple seront suggérées par le
contexte pathologique, par l’aspect
lactescent du sérum ou par la mise
en évidence d’une hyperprotidémie
considérable. Outre l’hyponatrémie,
les examens biologiques usuels
montrent une kaliémie normale et
des signes d’hémodilution : hypo-
protidémie et abaissement du taux
d’hématocrite. Une hypo-uricémie
* Service d’endocrinologie, diabète et maladies
métaboliques, CHU de Rouen.

Métabolismes Hormones Diabètes et Nutrition (IX), n° 6, novembre/décembre 2005
233
Troisième partie : Hypophyse-Surrénales
est fréquemment rencontrée et
constitue un excellent signe de
SIADH. L’absence d’insuffisance
rénale fonctionnelle (l’urémie est
même souvent abaissée) est égale-
ment un bon indice diagnostique
dans la mesure où elle permet
d’écarter une éventuelle hyponatré-
mie de déplétion. Les dosages uri-
naires montrent une concentration
de sodium supérieure à 20 mmol/l
ainsi qu’une osmolalité urinaire
inappropriée (> 100 mosmol/kg)
contrastant avec l’hypo-osmolalité
sanguine (< 280 mosmol/kg). Enfin,
le dosage de l’ADH circulante n’a
pas d’intérêt dans le cadre de la
prise en charge rapide du SIADH
sévère.
Diagnostic étiologique
La détermination de la cause du
SIADH est une étape importante de
la prise en charge en urgence de
l’hyponatrémie de dilution sévère,
et ce pour deux raisons principales :
l’hyponatrémie résiste souvent au
traitement symptomatique lorsque
son étiologie n’a pas été traitée ; la
maladie causale peut nécessiter
l’instauration rapide d’une théra-
peutique spécifique. Les circons-
tances de survenue et les données
cliniques permettent le plus souvent
de préciser la cause du SIADH.
L’interrogatoire doit rechercher en
premier lieu les prises médicamen-
teuses ainsi que les antécédents
médicaux et chirurgicaux. L’appari-
tion d’un SIADH en période post-
chirurgicale n’est pas exception-
nelle puisqu’elle concerne environ
1% des opérés. Il faut également
rappeler qu’un SIADH transitoire
peut survenir six à dix jours après la
résection transphénoïdale d’un adé-
nome hypophysaire. Plusieurs affec-
tions ne posent aucun problème dia-
gnostique, comme les pneumopathies
ou les maladies neurologiques évo-
lutives. La potomanie chez un patient
psychiatrique traité par neurolep-
tique ou par antidépresseur peut
favoriser l’apparition d’une hypona-
trémie parfois sévère. La recherche
de signes cliniques d’insuffisance
antéhypophysaire doit être systéma-
tique (2). En revanche, l’hypothy-
roïdie isolée ne peut entraîner une
hyponatrémie profonde, à l’exception
du coma myxœdémateux, qui fait
l’objet d’un chapitre spécifique du
présent ouvrage. Lorsque l’enquête
étiologique n’a pas permis de préciser
le mécanisme causal du SIADH, la
réalisation d’examens complémen-
taires radiologiques (échographie,
scanner) et d’une fibroscopie bron-
chique est indiquée pour rechercher
un éventuel processus néoplasique
profond. Les SIADH inexpliqués
sont relativement rares, sauf chez la
personne âgée où leur fréquence
peut atteindre 60 % (3).
Conduite à tenir
La prise en charge thérapeutique du
SIADH sévère répond à
deux grands
principes généraux
:
✓
elle doit impérativement com-
prendre deux volets : le traitement
de l’affection causale et la correc-
tion de l’hyponatrémie ;
✓
le traitement de l’hyponatrémie
symptomatique obéit à des règles
strictes dans la mesure où, si les
risques de l’hyponatrémie sévère
sont bien connus, sa correction trop
rapide ou excessive (amenant la
natrémie à des valeurs supérieures à
140 mmol/l) est susceptible d’entraî-
ner des lésions cérébrales à type de
myélinolyse centropontine et extra-
pontine. Il faut malgré tout souli-
gner que la correction rapide d’une
hyponatrémie aiguë est mieux tolé-
rée que celle d’une hyponatrémie
chronique (4, 5).
En pratique, la conduite suivante
peut être proposée (6) :
✓
arrêt de la médication responsable
du SIADH si le contexte patholo-
gique le permet, ce qui n’est pas
toujours le cas. À titre d’exemple, il
est souvent impossible d’arrêter
brutalement un traitement psycho-
Causes endocriniennes
– Insuffisance corticotrope
– Hypothyroïdie
– Insuffisance antéhypophysaire
Causes neurologiques
et psychiatriques
– Infections méningées ou cérébrales
– Tumeur primitive ou secondaire
– Traumatisme cérébral
– Thromboses vasculaires, hémorragie
méningée, hématome sous-dural
– Hydrocéphalie
– Psychose
– Delirium tremens
– Affections diverses : sclérose en
plaques, syndrome de Guillain et
Barré, neurosarcoïdose, porphyrie
aiguë intermittente
Causes pulmonaires
– Pneumopathies bactériennes ou
virales, tuberculose
– Pneumoconioses
– Insuffisance respiratoire aiguë
– Pneumothorax
– Atélectasie
Causes tumorales
– Carcinomes bronchiques, notamment
à petites cellules
– Tumeurs digestives
– Carcinome prostatique
– Thymomes malins
– Leucémies
Médicaments ou toxiques
Stimulant la production d’ADH
– Neuroleptiques
– Antidépresseurs tricycliques
et sérotoninergiques,
inhibiteurs de la monoamino-oxydase
– Carbamazépine
– Antimitotiques : cyclophosphamide,
vincristine, vinblastine
– Bromocriptine
– Nicotine
Potentialisant l’action rénale de l’ADH
– Chlorpropamide
– Clofibrate
– Oméprazole
– AINS, salicylés
– Carbamazépine
– Cyclophosphamide
– Colchicine
Surdosage en ADH d’origine exogène
– Desmopressine
– Ocytocine
Nausées importantes répétées
Période postopératoire
SIADH idiopathique
Tableau. Principales étiologies du SIADH.

Métabolismes Hormones Diabètes et Nutrition (IX), n° 6, novembre/décembre 2005
234
Urgences
en endocrinologie, diabétologie
et maladies métaboliques
en endocrinologie, diabétologie
et maladies métaboliques
trope chez des patients atteints de
dépression endogène ou de psy-
chose chronique ;
✓
traitement spécifique de l’étio-
logie : antibiothérapie en cas de
pneumopathie, exérèse chirurgicale
d’une tumeur sécrétrice d’ADH
après correction (au moins partielle)
de l’hyponatrémie si cette dernière
est symptomatique.
En cas de forte suspicion d’insuf-
fisance corticotrope (présence de
signes d’insuffisance antéhypophy-
saire, antécédent de corticothérapie,
d’adénome et/ou de chirurgie hypo-
physaire), il est indispensable d’ad-
ministrer, sans délai, de l’hydrocor-
tisone par voie parentérale (lire le
chapitre consacré à l’insuffisance
surrénale aiguë) après avoir effec-
tué un prélèvement veineux pour
dosage ultérieur de la cortisolémie.
De même, l’hypothyroïdie profonde
avec hyponatrémie de dilution sera
prise en charge selon les modalités
décrites dans le chapitre consacré au
coma myxœdémateux.
Le traitement de l’hyponatrémie sera
mené selon les modalités suivantes :
✓
lorsque l’hyponatrémie est peu ou
pas symptomatique, la restriction
hydrique modérée à sévère (1 200 à
500 ml/j), éventuellement associée à
un apport sodé oral ou parentéral,
permet en règle générale la normali-
sation progressive de la natrémie ;
✓
si l’hyponatrémie est symptoma-
tique, il est nécessaire de perfuser
du chlorure de sodium isotonique,
voire hypertonique, notamment en
cas de manifestations neurologiques
graves. La vitesse de remontée de la
natrémie peut être initialement éle-
vée (2 mmol/l/h pendant les quatre
premières heures). Par la suite, le
rythme de perfusion du chlorure de
sodium devra être ralenti pour que
l’augmentation de la natrémie ne
dépasse pas 12 à 15 mmol/l au
terme des 24 premières heures et
25 mmol/l au bout de 48 heures (7).
L’apport en sel est associé à une res-
triction hydrique lorsque la régres-
sion des symptômes neurologiques
permet la reprise de l’alimentation ;
✓
lorsque l’association restriction
hydrique/apport sodé ne permet pas
d’obtenir une natrémie supérieure à
130 mmol/l, le recours au furosé-
mide à petite dose (40 à 60 mg/j en
deux prises) peut être proposé en
compensant les pertes électroly-
tiques. L’urée administrée par voie
orale (30 g/j dilués dans 100 ml
d’eau) a également fait la preuve de
son efficacité. Elle permet en effet
d’entretenir une diurèse significative
en générant une charge osmotique
urinaire importante. La déméclocy-
cline (Ledermycine®), une tétra-
cycline qui s’oppose à l’action de
l’ADH, peut être délivrée sur pres-
cription hospitalière lorsque la
natrémie reste inférieure à 125 mmol/l
malgré les mesures thérapeutiques
citées précédemment. La posologie
recommandée est de 900 à 1 200 mg
par jour en deux prises pour les dix
premiers jours, puis de 600 mg par
jour par la suite. Elle nécessite une
surveillance étroite de la fonction
rénale en raison de sa néphrotoxi-
cité. Le lithium, qui diminue la sen-
sibilité du tubule rénal à l’ADH, a
lui aussi été utilisé dans ce cadre,
mais sa toxicité potentielle le rend
difficile à manier. Enfin, des anta-
gonistes du récepteur rénal de
l’ADH (récepteur V2), tels que le
conivaptan et le tolvaptan, sont
actuellement développés par l’in-
dustrie pharmaceutique. Les études
cliniques déjà publiées confirment
l’efficacité de ces molécules dont la
tolérance paraît satisfaisante.
Prévention
Les déficits endocriniens, les insuf-
fisances surrénale et thyroïdienne,
doivent bien sûr être correctement
substitués. Les patients insuffisants
corticotropes doivent, en outre, par-
faitement connaître les mesures de
prévention de l’insuffisance surré-
nale aiguë (lire le chapitre “Insuffi-
sance surrénale aiguë chez l’adulte”
p. 212). Chez les patients atteints de
maladies chroniques potentiellement
responsables de SIADH ou traités
au long cours par un médicament
stimulant la sécrétion ou les effets
de l’ADH, il est logique de proposer
une limitation des apports hydriques
pour maintenir la natrémie dans les
valeurs normales.
Références
1.
Anderson RJ, Chung HM, Kluge R et al. Hypo-
natremia: a prospective analysis of its epidemio-
logy and the pathogenetic role of vasopressin. Ann
Intern Med 1985;102:164-8.
2.
Oelkers W. Hyponatremia and inappropriate
secretion of vasopressin (antidiuretic hormone) in
patients with hypopituitarism. N Engl J Med
1989;321:492-6.
3.
Hirshberg B, Ben-Yehuda A. The syndrome of
inappropriate antidiuretic hormone secretion in
the elderly. Am J Med 1997;103:270-3.
4.
Berl T. Treating hyponatremia: damned if we
do and damned if we don’t. Kidney Int 1990;
37:1006-18.
5.
Sterns RH. The treatment of hyponatremia:
first, do no harm. Am J Med 1990;88:557-60.
6.
Decaux G, Soupart A. Treatment of symptoma-
tic hyponatremia. Am J Med Sci 2003;326:25-30.
7.
Arieff AI. Management of hyponatremia. Brit
Med J 1993;307:305-8.
1
/
3
100%