Exercice 2 -

CHIMIE GÉNÉRALE – TRAVAUX DIRIGES 5 – 2013/2014 1 CH
1/4
95, rue du Dessous des Berges
75013 PARIS
http://www.etsl.fr
TD N° 5
http://ligodin.free.fr
Lundi 30 SEPTEMBRE 2013
10h00 – 12h30
RÉACTIONS EN SOLUTION AQUEUSE
LES DIAGRAMMES POTENTIEL-pH
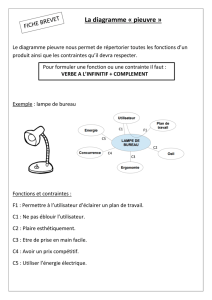
Exercice 1 : Lecture du diagramme E-pH du cuivre
Le document ci-après présente le diagramme E-pH de l'élément cuivre, limité aux espèces suivantes :
en solution : Cu+, Cu2+
solides : Cu, Cu2O et Cu(OH)2
Ce diagramme a été tracé avec les conventions suivantes :
la concentration totale en élément cuivre à l'état dissous est égale à Ctra :

CHIMIE GÉNÉRALE – TRAVAUX DIRIGES 5 – 2013/2014 1 CH
2/4
Cu+ + Cu2+ Ctra = 0,010 mol.L-1
sur une droite frontière séparant les domaines de deux espèces dissoutes, les concentrations en élément
cuivre dans chacune de ces deux espèces sont égales.
1) Déterminer le degré d'oxydation du cuivre dans les différentes espèces prises en compte.
2) - a - Déterminer, en justifiant, les espèces numérotées de à , majoritaires dans les différents
domaines.
- b - Quelle est l'espèce qui n'est pas stable ? Par quelle réaction disparaît-elle ? Calculer la
constante thermodynamique de la réaction correspondante et déterminer la concentration de cette
espèce en équilibre avec l'espèce majoritaire à la concentration :
Ctra = 0,010 mol.L-1
3) À l'aide du diagramme, déterminer le potentiel standard du couple Cu2+/Cu(s) et le produit de solubilité
de Cu(OH)2.
4) Retrouver les pentes des frontières BC et BD.
Données :
potentiels standard rédox : E10(Cu+/Cu(s)) = 0,52 V ; E20(Cu2+/Cu+) = 0,16 V
Produit ionique de l'eau : Ke = 10-14.
On prendra 𝑅.𝑇
𝐹.lnx = 0,060.log10x.
Exercice 2 : Utilisation du diagramme E-pH du cuivre
1) Rappeler les équations des droites (a) et (b) délimitant le domaine de stabilité thermodynamique de
l'eau. Donner leur équation avec la convention : p(O2) = p(H2) = 1 bar.
Les reporter sur le diagramme précédent.
2) Discuter de la stabilité des différentes espèces contenant l'élément cuivre en présence d'eau, puis au
contact de l'atmosphère.
Données : E10(O2/H2O) = 1,23 V ; E20(H3O+/H2) = 0,00 V.
Produit ionique de l'eau : Ke = 10-14.
On prendra 𝑅.𝑇
𝐹.lnx = 0,060.log10x.
Exercice 3 : Établissement du diagramme E-pH du cérium
Établir le diagramme E-pH du cérium pour une concentration de tracé égale à 10 mmol.L-1.
Données :
E10(Ce3+/Ce(s)) = - 2,33 V ; E20(Ce4+/ Ce3+) = 1,74 V.
pKs1(Ce(OH)3(s)) = 21 ; pKs2(Ce(OH)4(s)) = 50.
Lundi 7 OCTOBRE 2013

CHIMIE GÉNÉRALE – TRAVAUX DIRIGES 5 – 2013/2014 1 CH
3/4
10h00 – 12h30
Exercice 4 : Lecture du diagramme E-pH du mercure
Le document ci-après présente le diagramme E-pH de l'élément mercure à 25 °C.
Ce diagramme a été tracé avec les conventions suivantes :
la concentration totale en atomes de mercure dissous, Ctra, est égale à 10 mmol.L-1 en l'absence de phase
condensée ;
la frontière entre espèces dissoutes correspond à l'égalité des concentrations en atomes de mercure ;
en ne considérant que les quatre espèces chimiques suivantes : mercure métal Hg (liquide pur), oxyde
de mercure (II) HgO (solide pur), ion mercure (II) Hg2+ (en solution) et ion mercure (I) Hg22+ (en
solution) ;
On prendra 𝑅.𝑇
𝐹.lnx = 0,060.log10x.
1) Identifier chacun des domaines repérés de A à D, en précisant s'il s'agit du domaine de stabilité ou de
prédominance de l'espèce considérée.
Par la suite, une espèce chimique sera désignée, dans le texte, par la lettre de son domaine.
2) Déterminer, à l'aide du diagramme, les potentiels standard E10 et E20 des couples Hg(II)/Hg(I) et
Hg(I)/Hg(0).
3) Écrire l'équation de la réaction A D et déterminer le produit de solubilité correspondant.
4) Quelles sont les pentes des segments 4 et 5 ? Vérifier la concordance avec le diagramme.
5) Équilibrer l'équation rédox : B = C + D. Calculer, à l'aide du diagramme, sa constante K0 d'équilibre.

CHIMIE GÉNÉRALE – TRAVAUX DIRIGES 5 – 2013/2014 1 CH
4/4
6) Représenter les droites et ' limitant le domaine de stabilité de l'eau avec les conventions p(O2) =
p(H2) = p0.
- a - Le métal mercure est-il attaqué par un acide fort à anion non oxydant comme l'acide
sulfurique dilué ?
- b - Existe-t-il une espèce pouvant oxyder l'eau ?
- c - Quelles sont les espèces susceptibles d'être oxydées par le dioxygène de l'air ? Écrire les
réactions d'oxydation éventuelles à pH = 5.
1
/
4
100%