Lire l'article complet

COMPOSITION: Comprimé: Extrait de Ginkgo biloba standardisé
(EGb761®) titré à 24% d'hétérosides de Ginkgo et 6% de Ginkgolides-
bilobalide 40,00mg. Excipient à effet notoire: lactose monohydraté: 82,5mg (cf. mises
en garde), pour un comprimé enrobé. Solution buvable: Extrait de Ginkgo biloba standardisé (EGb 761®) titré à 24% d'hétérosides de Ginkgo et 6 % de Ginkgolides-
bilobalide 4,00 g. Excipients: saccharine sodique, huile essentielle d'orange soluble, huile essentielle de citron soluble, alcool (cf. mises en garde), eau purifiée. Pour
100,00ml. INDICATIONS THÉRAPEUTIQUES: Traitement à visée symptomatique du déficit pathologique cognitif et neurosensoriel chronique du sujet âgé (à l’exclusion
de la maladie d’Alzheimer et des autres démences). Traitement symptomatique de la claudication intermittente des artériopathies chroniques oblitérantes des membres
inférieurs (au stade 2). N.B. : Cette indication repose sur des essais cliniques en double aveugle par rapport à un placebo qui montrent une augmentation du périmètre
de marche d'au moins 50 % chez 50 à 60% des malades traités contre 20 à 40% des malades suivant uniquement des règles hygiénodiététiques. Traitement d’appoint
des baisses d’acuité et troubles du champ visuel présumés d’origine vasculaire. Traitement d’appoint des baisses d’acuité auditive et de certains syndromes vertigineux
et/ou acouphènes présumés d’origine vasculaire. Amélioration du phénomène de Raynaud. POSOLOGIE ET MODE D'ADMINISTRATION : Comprimé: Voie orale.
3 comprimés par jour à prendre au moment des repas. CTJ: 0,52 à 0,54 €. Solution buvable: Utiliser la mesurette graduée: 1 dose = 1 ml de solution buvable = 40mg
d'extrait pur. 3 doses (3 ml) par jour, à répartir dans la journée. Les doses sont à diluer dans un demi-verre d'eau et à prendre au moment des repas. CTJ: 0,51 à 0,53€.
CONTRE-INDICATIONS : Hypersensibilité à l’un des constituants du comprimé ou à l'un des constituants de la solution buvable. MISES EN GARDE: Galactosémie
congénitale, syndrome de malabsorption du glucose et du galactose ou déficit en lactase, en raison de la présence de lactose. Solution buvable: ATTENTION : LE TITRE
ALCOOLIQUE DE CE MÉDICAMENT EST DE 57%V/V, SOIT 0,45g D'ALCOOL PAR UNITÉ DE PRISE (POUR 1 DOSE). GROSSESSE ET ALLAITEMENT: Utilisation déconseillée
pendant la grossesse ou l’allaitement. EFFETS INDÉSIRABLES: Rarement troubles digestifs, troubles cutanés, céphalées. PHARMACODYNAMIE: VASODILATATEUR
PÉRIPHÉRIQUE. AMM- DONNÉES ADMINISTRATIVES : 329 904.0 : 30 comprimés sous plaquettes thermo-formées (aluminium-PVC). 329 906.3: 90 comprimés sous
plaquettes thermoformées (aluminium-PVC). 316 324.0: 30 ml en flacon avec mesurette graduée (verre brun). 330 279.9: 90ml en flacon (verre brun) avec mesurette
graduée. Remb. Séc. Soc. à 35 %. Agr. Coll. Prix public, boîte de 30 comprimés: 5,44€. Prix public, boîte de 90 comprimés: 15,69€. Prix public, flacon de 30 ml: 5,36 €.
Prix public, flacon de 90ml : 15,46 €. DATE DE MISE A JOUR: Janvier 2009. REF : TK(cp-sb)R-V04. EXPLOITANT : BEAUFOUR IPSEN Pharma (en cours de transfert vers
IPSEN PHARMA) 65 quai Georges Gorse - 92100 Boulogne-Billancourt. Tél : 01.58.33.50.00.
Information médicale: 01.58.33.58.20.
Pour une information complète, consulter le RCP disponible sur le site internet de l’AFSSAPS
ou sur demande auprès de notre Laboratoire.
Les avis de la Transparence de ces spécialités sont disponibles à l’adresse www.has-sante.fr
*Innover pour mieux soigner 2TK0262
TANAKAN 40 mg, comprimé enrobé.
TANAKAN 40 mg/ml, solution buvable.
** Boîtes de 30 et 90 comprimés.
Flacons de solution buvable de 30 et 90 ml.
Traitement à visée symptomatique du déficit pathologique cognitif et neurosensoriel
chronique du sujet âgé
(à l’exclusion de la maladie d’Alzheimer et des autres démences)
TNKCiblKub A4 MLc 2tk0262:Mise en page 1 23/09/09 13:38 Page1
CAS CLINIQUE
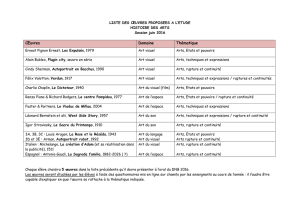
▲ Figure 1. IRM avec injection de gadolinium (A : coupe sagittale
médiane T1 ; B : coupe coronale) démontrant une volumineuse
tumeur hypophysaire. Le chiasma optique n’est pas individualisable.
La Lettre du Neurologue • Vol. XIII -n° 11 - décembre 2009 | 381
Mots-clés
Tomographie en cohérence optique - Couche de fibres optiques péripapillaires -
Compression chiasmatique - Pronostic visuel - Champ visuel
Keywords
Optical coherence tomography - Peripapillary retinal nerve fiber layer -
Chiasmal compression - Visual Prognosis - Visual field
Compression du chiasma optique
et tomographie en cohérence optique
Optical coherence tomography and chiasmal compression
C. Lamirel*, N.J. Newman*, V. Biousse*
La tomographie en cohérence optique (OCT) permet de
quantifier la perte axonale des voies visuelles antérieures
dans de nombreuses pathologies, y compris dans les
compressions chiasmatiques (1, 2). Il a été récemment suggéré
que la mesure de l’épaisseur de la couche des fibres optiques
(souvent appelée retinal nerve fiber layer [RNFL]) dans la région
péripapillaire est un facteur pronostic de récupération visuelle
chez les patients ayant une tumeur comprimant les voies
visuelles antérieures (3, 4).
Observation
Un homme âgé de 44 ans est vu en consultation neuro-
ophtalmologique avant résection d’une tumeur hypophysaire.
Il a présenté en 2004 une perte progressive de la vision péri-
phérique des 2 yeux alors qu’il résidait en Afrique. Une tumeur
hypophysaire a été diagnostiquée en juin 2005 et traitée par
résection transsphénoïdale. Après cette chirurgie, sa vision
s’est améliorée temporairement, mais s’est ensuite aggravée.
En mars 2009, il s’est plaint d’impuissance et une IRM a
démontré la récidive d’une volumineuse masse hypophysaire
nécessitant un nouveau traitement chirurgical (figure 1). Une
évaluation de sa fonction visuelle est alors demandée avant
le traitement chirurgical. Son acuité visuelle pré opératoire
est de 1,6/10 pour l’œil gauche, et son œil droit ne perçoit
pas la lumière. Ses pupilles sont peu réactives à la lumière
avec un déficit du réflexe pupillaire afférent à droite. Le
fond d’œil montre une pâleur papillaire diffuse et bilaté-
rale. Le champ visuel de Goldman montre du côté gauche
une hémianopsie temporale ; à droite, aucun isoptère n’est
perçu (figure 2A).
* Emory Eye Center, neuro-ophthalmology Unit, Atlanta, États-Unis.

CAS CLINIQUE
▲ Figure 2. Champ visuel de Goldman (stimuli V-4 et III-4) préopératoire (A) et postopératoire (B).
382 | La Lettre du Neurologue • Vol. XIII - n° 11 - décembre 2009
Un OCT est obtenu pour étudier l’épaisseur de la RNFL (figure 3).
Celle-ci mesure 48 µm à droite et 52 µm à gauche, soit dans le
percentile le plus fin de la base de données normative.
Une résection partielle transsphénoïdale de la tumeur hypophysaire
est réalisée sans complication. Trois mois plus tard, l’acuité visuelle
est alors “compte les doigts à 1 m” à droite, et 1,6/10 à gauche.
Ses pupilles sont inchangées. Le champ visuel de Goldman ne
montre pas d’amélioration à gauche avec toujours une hémianopsie
temporale (figure 2B). À droite, le champ visuel s’est amélioré
avec perception des stimuli dans le champ nasal.
Discussion
L’OCT est une méthode d’imagerie non invasive permettant de
réaliser des coupes transversales de la rétine et d’en visualiser les
différentes couches histologiques. L’une des applications de l’OCT
est de pouvoir mesurer de manière automatique, fiable et repro-
ductible l’épaisseur de la RNFL, qui contient les axones formant
le nerf optique. De nombreuses études ont confirmé la diminu-
tion de l’épaisseur de la RNFL dans tous types de neuropathie
optique (1). Bien que non spécifiques, les résultats de l’OCT sont
corrélés à la fonction visuelle et sont souvent utilisés en addition
au champ visuel dans le suivi des neuropathies optiques chroniques.
Le pronostic visuel après décompression chirurgicale du chiasma
est lié à la durée de la compression et à l’existence d’une atro-
phie optique au moment du diagnostic, mais il reste très difficile
à prédire. Il a récemment été suggéré que l’OCT pouvait aider à
prévoir la récupération visuelle après résection chirurgicale des
tumeurs hypophysaires comprimant les voies visuelles antérieures
(3, 4). En 2008, H.V. Danesh-Meyer et al. ont rapporté une série
prospective de 35 patients avec une compression chiasmatique

CAS CLINIQUE
ED
00 20 40 60 80 100 120 140 160 180
INF TEMPNASSUPTEMP
OD
200 240 90
95
38 26
46 27
39 25
71 58
58 54
64
90
32 36
35 47
27 37
66 40
59 42
73
69
41 26
57
S
I
64
31 T 40
Signal Strength (max 10) 9
Signal Strength (max 10)
Patient scan/information
DOB 1965
OD (n = 3)
Imax/Smax
Smax/Imax
Smax/Tavg
Smax/Navg
Savg
Iavg
Avg. thickness
Smax
Imax
Max-min
Imax/Tavg
OS (n = 3) OD-OS
1,19 0,98 – 0,21
2,88 3,91 – 1,04
3,42 3,83 – 0,41
2,25 2,50 – 0,26
90,00 102,00 – 12,00
107,00 100,00 7,00
57,00 73,00 – 16,00
64,00 69,00 – 5,00
47,85 52,16 – 4,31
82,00 79,00 3,00
0,84 1,02 – 0,18
M. Compression chiasmatique
Scan Type Fast RNFL thickness (3,4)
Scan Date
Scan Length 10,87 mm
Normal
distribution
percentiles
100 %
95 %
5 %
1 %
0 %
9
N
220
100
200
300
Microns
00 20 40 60 80 100 120 140 160 180
INF TEMPNASSUPTEMP
OS
OSOD
200 240220
100
200
300
Microns
00 20 40 60 80 100 120 140 160 180
INF TEMPNASSUPTEMP
200 240220
100
200
300
Microns
B
A
C
▲ Figure 3. Résumé des étapes suivies pour l’interprétation d’un OCT (cf. fiche technique). La date de naissance du patient a été correctement entrée
(A). Les paramètres de fiabilité sont corrects (B). L’épaisseur moyenne de la couche des fibres optiques (C) est de 47,85 µm à droite et de 52,16 µm
à gauche, correspondant au percentile le plus fin de la population normale (couleur rouge). L’amincissement est diffus comme le montre l’épaisseur
par quadrant (D) et les courbes TSNIT (E). Le patient a de très faibles chances de récupérer un champ visuel normal en postopératoire.
La Lettre du Neurologue • Vol. XIII -n° 11 - décembre 2009 | 383
(adénome hypophysaire dans 77 % des cas) ayant comme
unique traitement une chirurgie transsphénoïdale (3). Tous
les patients ont eu un OCT mesurant l’épaisseur de la RNFL
dans la région péripapillaire. Un champ visuel automatisé de
Humphrey était réalisé en préopératoire et dans les 6 semaines
après la chirurgie. Parmi les 19 yeux avec un déficit sévère du
champ visuel en préopératoire, les yeux ayant une épaisseur
de la RNFL supérieure à 80 µm ont eu une amélioration nette
du champ visuel (14,6 ± 3,1 dB) en postopératoire, tandis que
les yeux dont la couche des fibres optiques était inférieure à
80 µm ne s’amélioraient que faiblement (1,6 ± 14,7 dB). Dans le
groupe des patients ayant une épaisseur de la RNFL inférieure
à 85 µm, les chances de récupérer un champ visuel normal ou
quasi normal étaient d’autant plus grandes que l’épaisseur de
la RNFL était épaisse. En 2009, une équipe lyonnaise a confirmé
ces résultats (4). Dix-neuf patients ayant une compression
chiasmatique par adénome hypophysaire ont été comparés
à 23 sujets sains. Les patients ont été divisés en 3 groupes en
fonction du champ visuel initial et de son évolution postopé-
ratoire. L’épaisseur de la RNFL préopératoire des patients sans
déficit du champ visuel était de 100 ± 11 µm. Celle des patients ayant
un déficit initial du champ visuel qui s’est complètement amélioré
après la chirurgie était de 101 ± 20 µm. L’épaisseur moyenne de la
RNFL des patients qui n’ont pas eu d’amélioration complète du champ
visuel était de 73 ± 12 µm, soit significativement plus fine que les deux
autres groupes de patients et que le groupe contrôle (102 ± 9 µm). Les
chances de récupération complète étaient significativement corrélées à
l’épaisseur initiale de la RNFL, indépendamment de l’âge ou de la durée
des symptômes. Pour chaque augmentation de l’épaisseur moyenne
de la couche des fibres optiques de 10 µm, les chances de récupération
complète étaient multipliées par 13. Cette relation était encore plus
forte pour l’épaisseur de la RNFL au niveau de la partie inférieure du
disque optique où une augmentation de 10 µm d’épaisseur correspondait
à 63 fois plus de chances de récupération complète. Pour ce secteur,
une épaisseur classée dans les 5 percentiles les plus fins de la base
normative (c’est-à-dire une épaisseur classée jaune ou rouge) diminue
de 100 fois les chances de récupération complète du champ visuel.
Ces 2 études suggèrent que la mesure de l’épaisseur moyenne de
la RNFL par OCT dans le cadre des tumeurs hypophysaires compri-
mant le chiasma n’est cliniquement utile que chez les patients ayant

- 2009/09 - AVO3 - FRA - 25056
DÉNOMINATION DU MEDICAMENT : AVONEX 30 microgrammes/0,5 ml (Interféron bêta-1a) solution injectable. COMPOSITION QUALITATIVE ET QUANTITATIVE ET FORME PHARMACEUTIQUE *: Solution injectable - Interféron bêta-1a 30 microgrammes (6 millions d’UI) dans 0,5 ml contenus
dans une seringue préremplie. Solution limpide et incolore. DONNÉES CLINIQUES : • Indications thérapeutiques : AVONEX est indiqué dans le traitement : - Des patients atteints de sclérose en plaques (SEP ) de forme rémittente. Dans les essais cliniques, celle-ci était caractérisée par deux
poussées ou plus survenues au cours des trois années précédentes sans évidence de progression régulière entre les poussées ; AVONEX ralentit la progression du handicap et diminue la fréquence des poussées. - Des patients ayant présenté un seul évènement démyélinisant, accompagné
d’un processus inflammatoire actif, s’il est suffisamment sévère pour nécessiter un traitement par corticostéroïdes par voie intraveineuse, si les diagnostics différentiels possibles ont été exclus et si ces patients sont considérés à haut risque de développer une sclérose en plaques cliniquement
définie. Le traitement par AVONEX doit être interrompu chez les patients développant une forme progressive de SEP.•Posologieetmoded’administration : Le traitement devra être initié par un praticien expérimenté dans le traitement de cette maladie. Adulte : La posologie recommandée
dans le traitement des formes de SEP évoluant par poussées est de 30 microgrammes (0,5 ml de solution) administrés par voie intramusculaire (IM) une fois par semaine (voir « Précautions particulières d’élimination et manipulation »). Aucun bénéfice supplémentaire n’a été observé en
administrant une dose supérieure (60 microgrammes) une fois par semaine. »). A l’instauration du traitement, les patients peuvent commencer avec une dose totale de 30 microgrammes (0,5 ml de solution) ou bien avec approximativement la moitié de la dose une fois par semaine afin de
les aider à s’adapter au traitement ; ensuite, la dose sera augmentée jusqu’à obtention de la dose totale de 30 microgrammes (0,5 ml de solution). Afin d’obtenir une efficacité satisfaisante, une dose de 30 microgrammes (0,5 ml de solution) une fois par semaine devra être atteinte et maintenue
après la période d’augmentation initiale. Il existe un dispositif manuel permettant d’administrer environ la moitié de la dose pour les patients débutant le traitement par AVONEX. Aucun bénéfice supplémentaire n’a été observé en administrant une dose supérieure (60 microgrammes) une fois
par semaine. Enfant et adolescent : Aucune étude formelle clinique ou de pharmacocinétique n’a été conduite chez l’enfant ou l’adolescent. Cependant, des données publiées limitées suggèrent que le profil de sécurité d’AVONEX chez les adolescents âgés de 12 à 16 ans recevant une injection
par voie intramusculaire de 30 microgrammes une fois par semaine, est similaire à celui observé chez les adultes. Il n’existe pas d’information sur l’utilisation d’AVONEX chez l’enfant de moins de 12 ans. Par conséquent, AVONEX ne doit pas être utilisé dans cette population. Sujet âgé : les
études cliniques n’ont pas inclus suffisamment de patients âgés de 65 ans et plus pour permettre de déterminer si cette population répond différemment au traitement que celle des patients plus jeunes. Toutefois, sur la base du schéma d’élimination du principe actif, il n’existe aucune raison
théorique de modifier la posologie chez le sujet âgé. Il convient de changer le site d’injection intramusculaire chaque semaine. Le médecin peut prescrire l’utilisation d’une aiguille de 25 mm de taille 25G pour les patients chez qui cette aiguille est plus appropriée pour l’injection intramusculaire.
Afin de réduire les symptômes pseudo-grippaux associés au traitement par AVONEX, l’administration d’un antalgique antipyrétique avant l’injection et pendant les 24 heures suivant chaque injection est conseillée. Ces symptômes sont habituellement présents pendant les premiers mois de
traitement. A ce jour, la durée totale du traitement n’est pas connue. Les patients devront être examinés au plan clinique après deux ans de traitement et la prolongation du traitement devra être décidée au cas par cas par le médecin traitant. Le traitement devra être interrompu chez les
patients développant une forme chronique progressive de SEP. • Coûtdutraitementjournalier:33,60 Euros. • Contre-indications : - Initiation du traitement pendant la grossesse (voir « Grossesse et Allaitement ») - Patients ayant des antécédents d’hypersensibilité aux interférons ß naturels
ou recombinants ou à l’un des excipients - Patients présentant une dépression sévère et/ou des idées suicidaires (voir « Mises en garde spéciales et précautions d’emploi » et « Effets Indésirables »). •Misesengardespécialesetprécautionsd’emploi* : AVONEX doit être utilisé avec
prudence chez les patients déprimés. Dépression et idées suicidaires sont connues pour survenir plus fréquemment chez les patients atteints de sclérose en plaques et être associées à l’utilisation des interférons. Il est recommandé aux patients de signaler immédiatement tout symptôme
de dépression et/ou d’idées suicidaires à leur médecin traitant. Prudence en cas d’administration d’AVONEX chez les patients ayant des antécédents d’épilepsie et /ou sous traitement antiépileptique, en particulier si les crises ne sont pas contrôlées de façon satisfaisante par le traitement
antiépileptique. Administration avec prudence et surveillance étroite en cas d’insuffisance hépatique ou rénale sévères et de myélosuppression sévère. Les patients doivent faire l’objet d’une surveillance particulière afin de déceler tout signe d’atteinte hépatique et la prudence est de rigueur
lorsque des interférons sont administrés en même temps que d’autres médicaments connus pour provoquer une atteinte hépatique. Surveillance particulière en cas de maladie cardiaque (angor, insuffisance cardiaque congestive ou arythmie), afin de déceler une aggravation éventuelle de
leur état clinique durant le traitement par AVONEX. L’utilisation des interférons peut entraîner des perturbations des examens biologiques. Des patients sont susceptibles de développer des anticorps contre AVONEX. • Interactionsavecd’autresmédicamentsetautresformes
d’interactions* : Aucune étude spécifique d’interaction n’a été réalisée chez l’homme. L’expérience clinique a montré que les patients atteints de SEP peuvent recevoir AVONEX et des corticostéroïdes ou de l’ACTH au cours des poussées. Il convient d’être prudent en cas d’administration
simultanée d’AVONEX avec d’autres médicaments à marge thérapeutique étroite et dont l’élimination dépend largement du cytochrome P-450 (antiépileptiques et certaines classes d’antidépresseurs…). •Grossesseetallaitement* : Les informations sur l’utilisation d’AVONEX pendant la
grossesse sont limitées. Les données disponibles traduisent l’éventualité d’un risque accru d’avortement spontané. L’initiation du traitement est contre-indiquée en cours de grossesse. Les femmes en âge de procréer devront utiliser les moyens contraceptifs appropriés. En l’absence de
données concernant le passage d’AVONEX dans le lait maternel et en raison de la possibilité d’effets indésirables graves chez les nourrissons, interrompre l’allaitement ou le traitement par AVONEX. • Effetssurl’aptitudeàconduiredesvéhiculesetàutiliserdesmachines* • Effets
indésirables* : le plus fréquemment : symptômes pseudo-grippaux tels que myalgies, fièvre, frissons, hypersudation, asthénie, céphalées, nausées ; plus marqués en début de traitement et dont la fréquence diminue avec la poursuite du traitement. Effets indésirables déclarés lors des essais
cliniques et/ou rapportés en post-AMM : Investigations : fréquent : lymphopénie, leucopénie, neutropénie, baisse de l’hématocrite, hyperkaliémie, augmentation de l’urée sanguine ; peu fréquent : thrombopénie ; fréquence indéterminée : perte de poids, prise de poids, anomalies des tests
hépatiques. Affections cardiaques : fréquence indéterminée : Cardiomyopathie, insuffisance cardiaque congestive (voir « Mises en garde spéciales et précautions d’emploi »), palpitations, arythmie, tachycardie. Affections hématologiques et du système lymphatique : fréquence indéterminée :
pancytopénie, thrombopénie. Affections du système nerveux : très fréquent : céphalée ; fréquent : spasticité musculaire, hypoesthésie ; fréquence indéterminée : symptômes neurologiques, syncope, hypertonie, vertiges, paresthésie, crises d’épilepsie, migraine. Affections respiratoires,
thoraciques et médiastinales : fréquent : rhinorrhée ; rare : dyspnée. Affections gastro-intestinales : fréquent : vomissements, diarrhée, nausées. Affections de la peau et du tissu sous-cutané : fréquent : éruptions cutanées, hypersudation, contusion ; peu fréquent : alopécie ; fréquence
indéterminée : œdème de Quincke, prurit, érythème vésiculaire, urticaire, aggravation de psoriasis. Affections musculo-squelettiques et systémiques:fréquent : crampes musculaires, cervicalgie, myalgie, arthralgie, douleurs dans les extrémités, lombalgie, raideur musculaire, raideur musculo-
squelettique ; fréquence indéterminée : lupus érythémateux disséminé, faiblesse musculaire, arthrite. Affections endocriniennes : fréquence indéterminée : hypothyroïdie, hyperthyroïdie. Troubles du métabolisme et de la nutrition : fréquent : anorexie. Infections et infestations : fréquence
indéterminée : abcès au site d’injection. Affections vasculaires:fréquent : rougeur du visage ; fréquence indéterminée : vasodilatation. Troubles généraux et anomalies au site d’administration : très fréquent : syndrome pseudo-grippal, fièvre, frissons, hypersudation ; fréquent : douleur au site
d’injection, érythème au site d’injection, ecchymose au site d’injection, asthénie, douleur, fatigue, malaise, sueurs nocturnes ; peu fréquent : sensation de brûlure au site d’injection ; fréquence indéterminée : réaction au site d’injection, inflammation au site d’injection, cellulite au site d’injection,
nécrose au site d’injection, saignement au site d’injection, douleur thoracique. Affections du système immunitaire : fréquence indéterminée : réaction anaphylactique, choc anaphylactique, réactions d’hypersensibilité (œdème de Quincke, dyspnée, urticaire, éruption, éruption prurigineuse).
Affections hépatobiliaires : fréquence indéterminée : insuffisance hépatique (voir « Mises en garde spéciales et précautions d’emploi »), hépatite, hépatite auto-immune. Affections des organes de reproduction et du sein : peu fréquent : métrorragie, ménorragie. Affections psychiatriques :
fréquence indéterminée : dépression (voir « Mises en garde spéciales et précautions d’emploi »), insomnie, suicide, psychose, anxiété, confusion, labilité émotionnelle. • Surdosage* PROPRIÉTÉSPHARMACOLOGIQUES* : • Propriétéspharmacodynamiques* : interférons, code ATC : L03
AB07. • Propriétéspharmacocinétiques*•Donnéesdesécuritépréclinique*•DONNÉESPHARMACEUTIQUES* : •Listedesexcipients* • Incompatibilités* • Durée de conservation : 2 ans. •Précautions particulièresdeconservation: A conserver au réfrigérateur (2°C - 8°C).
NEPASCONGELER. AVONEX peut être conservé à température ambiante (entre 15°C et 30°C) pendant une durée n’excédant pas une semaine. A conserver dans l’emballage extérieur d’origine à l’abri de la lumière. • Natureetcontenudel’emballageextérieur*: Seringue de 1 ml munie
d’un opercule avec sécurité et d’un piston contenant 0,5 ml de solution. • Précautionsparticulièresd’éliminationetmanipulation* : AVONEX est fourni sous forme d’une solution injectable prête à l’emploi, en seringue préremplie. Une fois sorti du réfrigérateur, AVONEX doit être amené à
température ambiante (15°C-30°C) environ 30 minutes avant l’injection. Ne pas utiliser de source externe de chaleur comme, par exemple, de l’eau chaude pour réchauffer AVONEX. Si la solution contient des particules en suspension ou si elle n’est pas limpide et incolore, la seringue préremplie
ne doit pas être utilisée. L’aiguille pour l’injection intramusculaire est fournie. La solution ne contient pas de conservateur. Chaque seringue préremplie contient une seule dose d’AVONEX. Eliminer toute fraction inutilisée. Tout produit non utilisé ou déchet doit être éliminé conformément à la
réglementation en vigueur.• LISTE I • Médicamentsoumisàunesurveillanceparticulièrependantletraitement.Médicamentsoumisàprescriptioninitialeetrenouvellementréservésauxspécialistesenneurologie.TITULAIREDEL’AMM: Biogen Idec Limited, Innovation House,
70 Norden Road, Maidenhead, Berkshire, SL6 4AY, Royaume-Uni. Information médicale et Pharmacovigilance : N° Vert 0 800 84 16 64.NUMÉROD’AUTORISATIONDEMISESURLEMARCHE:EU/1/97/033/003. •CODECIP: 343 232-6 : solution injectable ; boîte de 4 seringues préremplies
+ 4 aiguilles. •Prix: 940,87 Euros. Remb. Séc. Soc. à 65%. Agréé aux Collectivités. Médicament d’exception et prescription en conformité avec la FIT. DATEDEPREMIEREAUTORISATION/DERENOUVELLEMENTDEL’AUTORISATION:Datedepremièreautorisation:13/03/1997 – Date
dedernierrenouvellementdel’autorisation:13/03/2007 DATEDEMISEAJOURDUTEXTE:12/2008*Pour des informations plus complètes, veuillez consulter la monographie sur le site http://www.emea.europa.eu/. MLR 03/09
FIT AVONEX®, J.O. du 5 avril 2003 : médicament d’exception et prescription en conformité avec la FIT. AVONEX® est remboursé pour les patients ayant présenté un 1er événement démyélinisant accompagné d’un processus inflammatoire
actif, si les diagnostics différentiels ont été exclus et si les critères IRM de dissémination temporo-spatiale définis dans l’avis de la Commission de la Transparence du 18/12/2002 et dans la Fiche d’Information Thérapeutique sont réunis.
AVEX275b_ML.indd 1 23/07/09 17:38:55
CAS CLINIQUE
un champ visuel anormal. Dans ce groupe de patients, une
épaisseur moyenne de la couche des fibres optiques supérieure
à 80 µm indique de bonnes chances de récupération complète du
champ visuel. En dessous de ce seuil, les chances de récupération
complète sont d’autant moins bonnes que l’épaisseur moyenne de
la couche des fibres optiques est fine, en particulier dans le secteur
inférieur du nerf optique. Il est intéressant de souligner que ce seuil
de 80 µm est très proche de celui de 75 µm retrouvé par F. Costello
et al. après une névrite optique inflammatoire (5). Notre patient
avait une compression des voies visuelles antérieures de longue
durée avec un déficit du champ visuel sévère et une diminution
importante de l’épaisseur moyenne de la RNFL, le plaçant dans
le groupe de patients ayant très peu de chances de récupération
complète après décompression chirurgicale. Néanmoins, l’amé-
lioration de son œil droit fut relativement importante, ce qui
souligne que l’OCT permet d’estimer les chances de récupération
“complète” chez les patients ayant une acuité visuelle suffisante
pour réaliser un champ visuel automatique, mais ne garantit pas
l’amélioration partielle du champ visuel chez les patients ayant
une baisse visuelle très sévère. Pour ces sujets ayant une épaisseur
de la RNFL extrêmement fine, la relation entre RNFL et champ
visuel n’est pas la même du fait d’une relation non linéaire (6).
Cette application de l’OCT en tant que facteur pronostique dans les
neuropathies optiques compressives est encourageante et deviendra
probablement utile cliniquement dans les prochaines années (2). ◾
Références bibliographiques
1. Lamirel C, Newman NJ, Biousse V. The use of Optical Coherence Tomography
(OCT) in Neurology. Rev Neurol Dis 2009;Sous presse.
2. Sakata LM, Deleon-Ortega J, Sakata V et al. Optical coherence tomography of
the retina and optic nerve - a review. Clin Experiment Ophthalmol 2009;37:90-9.
3. Danesh-Meyer HV, Papchenko T, Savino PJ et al. In vivo retinal nerve fiber layer
thickness measured by optical coherence tomography predicts visual recovery after
surgery for parachiasmal tumors. Invest Ophthalmol Vis Sci 2008;49:1879-85.
4. Jacob M, Raverot G, Jouanneau E et al. Predicting visual outcome after treatment
of pituitary adenomas with optical coherence tomography. Am J Ophthalmol. 2009;
147:64-70 e2.
5. Costello F, Coupland S, Hodge W et al. Quantifying axonal loss after optic neuritis
with optical coherence tomography. Ann Neurol 2006;59:963-9.
6. Hood DC, Anderson SC, Wall M et al. Structure versus function in glaucoma: an
application of a linear model. Invest Ophthalmol Vis Sci. 2007; 48:3662-8.
Remerciements : Le Dr Lamirel a reçu un support financier de l’Institut Servier
(Paris, France), de la Fondation Thérèse et René Planiol (Varennes, France)
et de la Philippe Foundation Inc (New York, États-Unis).
1
/
4
100%