Lire l'article complet

22 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 329 - avril-mai-juin 2012
DOSSIER THÉMATIQUE
Syndrome d’apnées du sommeil
Troubles respiratoires
obstructifs du sommeil
de l’enfant
Sleep-disordered breathing in children
V. Couloigner*
* Service d’ORL pédiatrique, hôpital
Necker - Enfants malades, Paris.
Prévalence
Les troubles respiratoires obstructifs (TROS) sont une
pathologie fréquente chez l’enfant. Leur prévalence
est comprise entre 1 et 3 %, avec un pic de fréquence
entre 2 et 6 ans. Contrairement à ce qui est observé
chez l’adulte, l’obésité est rare chez l’enfant atteint
de TROS (moins de 10 % des cas).
Définitions
Les TROS comportent 2 entités.
➤
Le syndrome d’apnées/hypopnées obstructives
(SAOS). Son diagnostic nécessite la réalisation d’une
polysomnographie (PSG) et se définit par un index
d’apnées-hypopnées (IAH) supérieur ou égal à 1/h.
Les apnées correspondent chez l’enfant à un arrêt du
flux respiratoire sur au moins 2 cycles respiratoires,
et les hypopnées à une réduction du flux respiratoire
d’au moins 50 % associée à une désaturation en
oxygène d’au moins 3 à 4 % ou à un micro-éveil en
électroencéphalographie. Le calcul de l’IAH ne doit
pas prendre en compte les apnées centrales.
➤
Le syndrome d’augmentation des résistances
des voies aériennes supérieures (SARVAS). Certains
obstacles des VAS durant le sommeil n’entraînent pas
de SAOS, mais une simple augmentation des résis-
tances des VAS, avec un IAH restant inférieur à 1/h. Le
diagnostic du SARVAS repose sur la mesure du travail
respiratoire par manométrie œsophagienne. Du fait de
son caractère relativement invasif, cet examen n’est
pas de pratique courante. Chez l’enfant non obèse
sans pathologie sévère associée, les manifestations
cliniques du SARVAS ne semblent pas différentes
de celles d’un vrai SAOS (1). Des techniques moins
invasives permettant de mesurer le travail respiratoire
sont en cours d’évaluation chez l’enfant (électromyo-
graphie intercostale, temps de transit du pouls).
Diagnostic
Chez qui suspecter des TROS ?
L’existence de TROS doit être suspectée chez des
enfants présentant :
➤des ronflements nocturnes ;
➤
des manifestations cliniques associées aux ronfle-
ments :
➤durant le sommeil : réveils fréquents, agitation,
cauchemars, sueurs, mouvements anormaux
(syndrome des jambes sans repos), voire somnam-
bulisme, énurésie,
➤
dans la journée : céphalées matinales, asthénie,
difficultés de concentration, hyperactivité, difficultés
scolaires,
➤
une respiration bouche ouverte permanente :
ce symptôme n’est pas la conséquence des TROS
mais des obstacles des voies respiratoires qui en
sont habituellement responsables (hypertrophie
des végétations adénoïdiennes et des amygdales
palatines). Elle induit un mauvais appui de la langue
sur le palais, favorisant le développement d’un visage
long et étroit (faciès adénoïdien), d’un palais étroit
et ogival et de fosses nasales étroites,
➤
des difficultés à avaler les morceaux (consé-
quence de l’hypertrophie amygdalienne),

La Lettre d’ORL et de chirurgie cervico-faciale • n° 329 - avril-mai-juin 2012 | 23
Résumé
➤
un retard de croissance staturo-pondéral
secondaire.
Alors que chez l’adulte, le retentissement métabo-
lique et cardiovasculaire du SAOS est essentiel, chez
l’enfant non obèse et dépourvu de pathologie sévère
associée, ces manifestations sont absentes.
Examen clinique
Outre la recherche de symptômes évocateurs de
TROS, l’interrogatoire recherche des terrains à
risque : antécédents de prématurité, obésité, malfor-
mations cranio-faciales (syndromes de Crouzon,
de Pierre-Robin, etc.), maladies de surcharge
(muco polysaccharidoses), maladies neuromuscu-
laires. Ces cas complexes et sévères nécessitent une
prise en charge multidisciplinaire dans des centres
pédiatriques spécialisés.
Chez l’enfant, l’étiologie habituelle des TROS est
l’hypertrophie adénoïdo-amygdalienne. Cependant,
l’obstruction des voies aériennes durant le sommeil
ne dépend pas uniquement du volume adénoïdo-
amygdalien, mais aussi de la tonicité de la muscu-
lature pharyngée durant le sommeil : certains enfants
avec grosses amygdales, mais bon tonus nocturne,
n’ont pas de TROS (2) ; à l’inverse, d’autres ont des
amygdales de taille modérée, mais souffrent d’un
SAOS du fait d’une importante hypotonie musculaire
pharyngée durant le sommeil. Dans ce deuxième
cas, malgré la petite taille des amygdales, leur
exérèse permet souvent de diminuer considéra-
blement, voire de guérir les TROS, sans doute en
partie parce que l’amygdalectomie, par la fibrose
cicatricielle locorégionale qu’elle entraîne, rigidifie
la paroi pharyngée durant le sommeil. Par ailleurs, il
convient de bien observer les pôles postéro-inférieurs
des amygdales : leur rapprochement vers la ligne
médiane est prédictif d’apnées du sommeil, même si
la taille globale des amygdales semble modérée (3).
Concernant les végétations adénoïdes, plusieurs
attitudes sont possibles : soit on vérifie en préopé-
ratoire leur hypertrophie par une radiographie de
cavum de profil ou une nasofibroscopie, soit le
chirurgien explique aux parents que leur volume
et leur caractère obstructif seront évalués en
peropératoire, et qu’en fonction de cet examen, les
végétations seront ou non retirées. Il est rare, sauf
chez le nourrisson, qu’une hypertrophie isolée des
végétations adénoïdes puisse entraîner des TROS (4).
D’autres obstacles seront également recherchés : une
étroitesse des fosses nasales, appréciée par des tests
fonctionnels simples (exemple : coton effiloché placé
sous le nez), l’inspection de la pyramide nasale et des
orifices narinaires, la rhinoscopie antérieure, voire
la nasofibroscopie, et des anomalies dentofaciales :
palais ogival, rétrognathie, troubles occlusifs dentaires.
La nasofibroscopie, éventuellement complétée par
une imagerie des VAS (tomodensitométrie ou IRM
en coupes axiales, coronales et sagittales), doit être
réalisée en cas de discordance entre la symptoma-
tologie obstructive et l’examen clinique ou en cas
de syndrome polymalformatif (car dans ce cas, il
existe souvent plusieurs obstacles situés à différents
niveaux des VAS) [5].
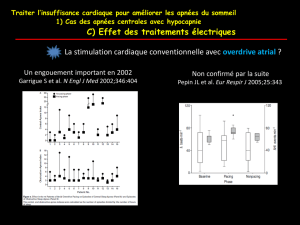
◆Étude du sommeil
À ce jour, la seule technique validée d’étude du
sommeil de l’enfant est la PSG dans un laboratoire
du sommeil, sur une nuit de sommeil (figure 1,
p. 24). Les principaux paramètres analysés et outils
de mesure sont résumés dans le tableau, p. 24
(exemple de tracé sur la figure 2, p. 24).
Compte tenu des difficultés d’accès à un labora-
toire du sommeil pédiatrique, du coût élevé de cet
examen – son analyse n’est pas automatisable, car
il faut éliminer les artéfacts et repérer des anomalies
subtiles électroencéphalographiques –, du caractère
instantané de l’information fournie – les résultats
peuvent être faussement alarmants si la PSG a été
effectuée en période de rhinopharyngite –, la Société
française d’ORL (5) ne recommande le recours à la
PSG qu’en cas de :
➤
pathologie sévère sous-jacente nécessitant
une prise en charge complexe : obésité morbide,
malformation cranio-faciale ou des voies aériennes
supérieures, maladie neuromusculaire ;
➤
discordance entre l’examen clinique et les
troubles respiratoires : symptômes évoquant un
SAOS sans hypertrophie adénoïdo-amygdalienne
ou hypertrophie adénoïdo-amygdalienne majeure
sans signe évocateur de TROS à l’interrogatoire ;
➤
risque opératoire élevé : troubles de l’hémostase,
anomalie cardiaque.
Les troubles respiratoires obstructifs (TROS) de l’enfant constituent une pathologie fréquente, avec comme
principale complication les troubles neurocognitifs. Le seul examen complémentaire actuellement validé
pour les confirmer est la polysomnographie (PSG) en laboratoire. Cependant, les limites de cet examen
font qu’il n’est indiqué que dans des cas particuliers.
L’étiologie habituelle des TROS de l’enfant est l’hypertrophie des végétations adénoïdes et des amygdales
palatines. L’efficacité clinique de leur exérèse chirurgicale n’est cependant pas totale, du fait d’obstacles
associés, dont les plus fréquents sont les anomalies dentofaciales et l’obstruction nasale.
La prise en charge des TROS de l’enfant est donc multidisciplinaire, impliquant de façon variable l’ORL,
l’orthopédiste dentofacial, l’allergologue, le radiologue et le spécialiste du sommeil.
Mots-clés
Apnées du sommeil
Polysomnographie
Amygdales
Végétations
Obstruction nasale
Orthodontie
Abstract
Sleep-Disordered Breathing
(SDB) is a frequent pathological
condition in children. Its main
complication is neurocognitive
and behavioral problems. The
only validated investigation
to confirm the existence of
pediatric SDB is polysomno-
graphy (PSG). However, due
to economical, technical and
availability issues, it is only
indicated in rare and specific
situations.
The usual etiology of pediatric
SDB is the hypertrophy of
tonsils and adenoids. Never-
theless, SDB may persist after
adenoidectomy and tonsillec-
tomy, due to other upper airway
obstructions, mainly dentofacial
anomalies, and nasal obstruc-
tion.
Thus the management of
pe diatric SDB is multidisci-
plinary, involving the ENT but
also the dentofacial orthope-
dics, the allergology and the
sleep specialists.
Keywords
Sleep apneas
Polysomnography
Tonsils
Adenoids
Nasal obstruction
Orthodontics

Figure 1. Harnachement
d’un enfant pour une
polysomnographie (photo
du Dr Seailles, Montesson).
Figure 2. Tracé polysomnographique d’un enfant de 2 ans et demi avec des apnées désaturantes et des micro-éveils
éléctroencéphalographiques (tracé du Dr Seailles, Montesson).
De haut en bas, on note, sur 2 minutes d’enregistrement :
1) l’intensité du son ; 2) la courbe de flux nasal ; 3) la saturation en oxygène de l’hémoglobine ; 4) la fréquence
cardiaque ; 5) l’indication des apnées ; 6) les mouvements des ceintures thoraciques ; 7) les mouvements des cein-
tures abdominales ; 8) le déphasage entre les ceintures abdominales et thoraciques ; 9) l’indication et l’intensité
des micro-éveils du cortex ; 10) le tracé de la première voie éléctroencéphalographique ; 11) le tracé de la deuxième
voie éléctroencéphalographique ; 12) le tracé du premier éléctro-oculogramme ; 13) le tracé du deuxième éléctro-
oculogramme ; 14) le tracé de l’éléctromyogramme du muscle mentonnier.
On remarquera les baisses d’oxygène après les apnées, les modifications du rythme cardiaque liées aux apnées,
l’accélération des fréquences éléctroencéphalographiques durant les réactions d’éveil à la fin des apnées, les mouve-
ments des ceintures en opposition de phase durant les efforts respiratoires inefficaces survenant pendant les apnées.
24 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 329 - avril-mai-juin 2012
Troubles respiratoires obstructifs du sommeil del’enfant
DOSSIER THÉMATIQUE
Syndrome d’apnées du sommeil
Tableau. Principaux paramètres analysés en polysomnographie.
Paramètre étudié Outil de mesure
Ronflements Microphone placé sur le cou
Flux respiratoires Canule nasale mesurant la pression + la thermistance orale
Mouvements respiratoires Pléthysmographie d’inductance (sangles thoracique et abdominale)
Échanges gazeux PO2 (+ ECG), PCO2
Sommeil (stades, micro-éveils) EEG (+ électro-oculographie)
Travail respiratoire Manométrie œsophagienne
Mouvements des membres inférieurs Électromyographie des membres inférieurs
ECG : électrocardiographie ; EEG : électroencéphalographie ; PCO2 : pression partielle en dioxyde de carbone ; PO2 : pression partielle
en oxygène.

Figure 3. Adénoïdectomie au microdébrideur.
Début de la procédure
Végétations obstruant les choanes Bourrelets tubaires
Releveurs du voile Cornets inférieursMicrodébrideur réséquant les végétations
Septum
Fin de la procédure : les choanes sont désormais bien visibles
La Lettre d’ORL et de chirurgie cervico-faciale • n° 329 - avril-mai-juin 2012 | 25
DOSSIER THÉMATIQUE
Le recours à la PSG est également utile lorsqu’il
existe une indication claire d’adénoïdo-amygda-
lectomie mais que les parents restent réticents et
ont besoin d’un examen objectif pour les aider à
prendre une décision.
Le simple enregistrement de la saturation nocturne
en oxygène est peu sensible pour diagnostiquer un
TROS et n’a donc de valeur que lorsqu’il montre des
anomalies. De nombreuses recherches sont en cours
pour valider chez l’enfant des tests plus simples et
moins coûteux que la PSG.
Traitement
Adénoïdo-amygdalectomie
L’amygdalectomie doit être réalisée sous anesthésie
générale et intubation endotrachéale ou masque
laryngé. Elle peut être totale ou subtotale, laissant
dans ce deuxième cas une toute petite lame
d’amygdale au fond de la loge amygdalienne.
En France, l’amygdalectomie totale reste la règle, et
aucune cotation spécifique n’est prévue par l’Union
nationale des caisses d’assurance maladie (UNCAM)
pour l’amygdalectomie subtotale. À l’inverse, dans
les pays anglo-saxons, l’amygdalectomie subtotale
(intracapsular tonsillectomy) réalisée selon diverses
modalités techniques (coblation, radiofréquence,
microdébrideur, serre-nœud) est devenue la règle
chez l’enfant (6). Elle n’entraîne aucun trauma-
tisme thermique ou mécanique de la paroi muscu-
laire pharyngée et est donc en moyenne moins
douloureuse en postopératoire que les techniques
totales (7). En outre, le fait de rester dans le tissu
amygdalien évite les risques d’hémorragies sévères
par blessure des branches de l’artère carotide
externe. À noter que l’amygdalectomie est contre-
indiquée en ambulatoire chez l’enfant de moins de
3 ans et en cas de SAOS sévère (5, 8, 9).
L’adénoïdectomie est classiquement faite à la curette.
La technique de contrôle à l’optique avec résection des
végétations au microdébrideur permet une exérèse
plus complète, en particulier en cas de végétations
choanales ou d’échec d’une première tentative d’adé-
noïdectomie selon la technique classique (figure 3)
[10]. Notons que les pulvérisations nasales de corti-
coïdes n’ont pas fait la preuve de leur efficacité à
long terme sur les hypertrophies adénoïdiennes (11).

26 | La Lettre d’ORL et de chirurgie cervico-faciale • n° 329 - avril-mai-juin 2012
Troubles respiratoires obstructifs du sommeil del’enfant
DOSSIER THÉMATIQUE
Syndrome d’apnées du sommeil
Si l’on s’en réfère aux résultats polysomnogra-
phiques, l’adénoïdo-amygdalectomie réduit sensi-
blement les apnées/hypopnées (diminution de l’IAH
de 14/h en moyenne), mais ne les guérit complè-
tement que dans 60 à 83 % des cas (12). L’efficacité
est moins bonne lorsque l’IAH préopératoire est
supérieur à 10 et en cas d’obésité.
Les études cliniques montrent une très bonne
efficacité de cette intervention. Ainsi, concernant les
troubles neurocognitifs (troubles de la concentration
et du comportement, difficultés scolaires), une étude
prospective menée sur un groupe d’enfants avec
TROS nécessitant une adénoïdo-amygdalectomie
(n = 67; âges : 5-13 ans) comparé à un groupe témoin
(n = 27) a montré, en préopératoire, une plus grande
fréquence de troubles neurocognitifs chez les futurs
opérés, et, 1 an après la chirurgie, l’absence de diffé-
rence résiduelle entre les 2 groupes concernant ces
mêmes troubles (13).
Autres traitements
◆Obstruction nasale
Les petits nourrissons ne peuvent pas respirer
par la bouche et deviennent dyspnéiques en cas
d’obstruction nasale. Certains enfants plus âgés,
et même des adultes, ne peuvent pas respirer
correctement par la filière oropharyngée et font
des apnées du sommeil en cas d’obstruction nasale.
Il est donc essentiel de diagnostiquer et de traiter les
obstructions nasales en utilisant des thérapeutiques
médicales ou chirurgicales :
➤
traitement des allergies respiratoires, après leur
objectivation par des “prick tests” cutanés, par anti-
histaminiques anti-H1, désensibilisations ou corti-
coïdes locaux par voie nasale ;
➤
traitement d’orthopédie dentofaciale, la
“disjonction maxillaire rapide” (14) ;
➤
turbinoplasties (réduction de volume des cornets
inférieurs) sous anesthésie générale au laser ou en
radiofréquence, et plus rarement septoplastie.
◆Inflammation des voies aériennes supérieures
L’inflammation chronique des VAS, fréquente chez
l’enfant de moins de 5 ans du fait de l’immaturité
physiologique de son système immunitaire (maladie
d’adaptation), induit la prolifération des lympho-
cytes adénoïdo-amygdaliens ; réciproquement,
les hypoxies intermittentes associées aux TROS
favorisent un état inflammatoire des VAS. Par
ailleurs, l’inflammation majore les conséquences
cardiovasculaires des TROS (15).
Sur le plan thérapeutique, si les anti-inflamma-
toires ne modifient pas les indications d’adénoïdo-
amygdalectomie, ils peuvent être utiles lorsque cette
intervention n’a pas permis de guérir totalement les
TROS. Ainsi, L. Kheirandish et al. (16) ont montré
que des corticoïdes administrés par voie nasale
associés au montélukast (Singulair®, un inhibiteur
des récepteurs des leucotriènes) diminuaient l’IAH
en cas d’anomalies persistantes sur la PSG après
adénoïdo-amygdalectomie.
La diminution d’un état inflammatoire chronique
des VAS peut également passer par un traitement
antiallergique ou antireflux gastro-œsophagien, en
particulier chez l’enfant de moins de 18 mois, chez
lequel le reflux est particulièrement fréquent.
◆Orthopédie dentofaciale
Un bilan d’orthopédie dentofaciale est toujours
nécessaire dans les TROS de l’enfant. Un traitement
est indiqué si des anomalies dentofaciales à risque
de majoration des TROS sont objectivées (14), mais
cela ne représente pas la majorité des cas.
Cas particuliers
Les TROS sur terrain d’obésité morbide ou de
pathologie sévère sous-jacente (malformations
cranio-faciales, syndromes de Pierre-Robin,
maladies de surcharge, pathologies neuromus-
culaires, etc.) nécessitent une prise en charge
multidisciplinaire en centre pédiatrique spécialisé.
Le bilan est plus complexe, tant dans l’analyse
de l’obstacle (recours habituel à l’endoscopie et
à l’imagerie des VAS) que dans la détection des
complications des TROS (recherche d’un reten-
tissement métabolique et cardiovasculaire). Sur
le plan thérapeutique, des traitements chirur-
gicaux peuvent parfois diminuer le SAOS dans le
cadre de certaines malformations ou de troubles
dynamiques pharyngolaryngés : désobstruction
nasale et rhinopharyngée par voie endoscopique
dans les hypoplasies du tiers moyen de la face
(dysostoses cranio-faciales, achondroplasies),
labioglossopexie ou ostéodistraction mandibulaire
dans les glossoptoses du syndrome de Pierre-Robin,
réduction basilinguale par voie endoscopique dans
les hypertrophies basilinguales chez les obèses et
les trisomiques 21 (17).
Cependant, ces anomalies nécessitent le plus
souvent la mise en place d’un traitement prolongé
par ventilation non invasive avec un masque
nasal (18), voire une trachéotomie. ■
Retrouvez l’intégralité
des références
bibliographiques
sur www.edimark.fr
 6
6
1
/
6
100%