D Les inhibiteurs de tyrosine kinase de l’EGFR dans le CBNPC :

La Lettre du Cancérologue • Vol. XXIII - n° 6 - juin 2014 | 225
MISE AU POINT
Les inhibiteurs
de tyrosine kinase de l’EGFR
dans le CBNPC :
sont-ils tous identiques ?
Non-small-cell lung cancer with EGFR mutation:
are all tyrosine kinase inhibitors equivalent?
C. Audigier-Valette*
* Service de pneumologie, centre
hospitalier Sainte-Musse, Toulon.
D
epuis ces 10 dernières années, la plus grande
avancée dans l’arsenal thérapeutique des
cancers bronchiques a été dominée par la
découverte des “drivers oncogéniques” et le déve-
loppement des thérapies ciblées. Depuis 2010, les
analyses en biologie moléculaire sont systématiques
pour les patients présentant un adénocarcinome
primitif pulmonaire de stade métastatique. L’exis-
tence d’une mutation EGFR est un facteur prédictif
de l’effi cacité des inhibiteurs de tyrosine kinase (ITK),
comme l’ont déjà montré de nombreuses études de
phase III (1). Prescrire une chimiothérapie à base
de sels de platine en première ligne et un ITK de
l’EGFR lors de la progression est une autre option
validée puisque aucune étude n’a mis en évidence
de différence en termes de survie globale (SG) entre
ces 2 stratégies. Trois ITK, le géfi tinib, l’erlotinib,
et l’afatinib, sont indiqués et ont l’autorisation de
mise sur le marché (AMM) en première ligne chez
les patients présentant un cancer bronchique non à
petites cellules (CBNPC) métastatique avec muta-
tion activatrice de l’EGFR.
Des mécanismes d’action
différents
Les récepteurs HER sont au nombre de 4, compre-
nant l’EGFR (HER1), HER2, HER3 et HER4 (Human
Epidermal growth factor Receptor ou ErbB). Les récep-
teurs HER sont impliqués dans le déclenchement
des signaux de prolifération. Il s’agit d’une cible
privilégiée pour les ITK qui entrent en compétition
avec l’adénosine triphosphate (ATP) au niveau de sa
liaison au domaine catalytique de la tyrosine kinase.
De ce fait, ils inhibent l’autophosphorylation et l’en-
semble de la signalisation en aval (2). Les inhibiteurs
réversibles de tyrosine kinase sont le géfi tinib et
l’erlotinib ; l’afatinib se distingue de ces molécules
car il bloque la totalité des récepteurs ErbB (HER),
et de manière irréversible. Les ITK irréversibles (de
seconde génération) se lient au récepteur de façon
défi nitive via une liaison covalente à des résidus
cystéines situés au niveau de leur domaine cata-
lytique et inhibent leur activité kinase. Une fois
l’ITK irréversible lié, seules l’internalisation et la
dégradation du récepteur permettent à la cellule
de l’éliminer. L’afatinib est un inhibiteur pan-HER,
c’est-à-dire capable d’inhiber l’activité kinase de
tous les membres de la famille HER présentant une
activité kinase (HER1 ou EGFR, HER2 et HER4), alors
que le géfi tinib et l’erlotinib n’inhibent qu’EGFR
(HER1). Les ITK irréversibles ont initialement été
développés dans l’espoir de surmonter la mutation
de résistance T790M, observée dans environ 50 %
des cas de rechute après traitement par géfi tinib ou
erlotinib chez les patients porteurs d’une mutation
activatrice de l’EGFR (3).
Molécules bénéfi ciant
d’une AMM par ordre
chronologique d’obtention
Géfi tinib
Plusieurs études de phase II avaient montré un
taux de réponse élevé (55-60 %) et une survie
sans progression (SSP) [9 mois] plus longue que

226 | La Lettre du Cancérologue • Vol. XXIII - n° 6 - juin 2014
Points forts
»
La présence d’une mutation EGFR a modifié radicalement la prise en charge thérapeutique des cancers
bronchiques non à petites cellules (CBNPC).
»
L’activité supérieure des inhibiteurs de tyrosine kinase (ITK) par rapport à la chimiothérapie (survie
sans progression [SSP], taux de réponse, tolérance et amélioration de la qualité de vie) a été largement
démontrée sans pour autant entraîner de modification de la survie globale, en raison du nombre important
de crossover dans les études randomisées.
»
Les ITK constituent tout de même un standard thérapeutique en situation de première ligne métastatique
en présence d’un driver oncogénique.
»
Actuellement, aucun des 3 ITK n’a été évalué en comparaison directe, et nos critères de choix se
fondent donc sur des paramètres secondaires tels que les données pharmacocinétiques et la gestion des
effets indésirables.
Mots-clés
EGFR
Inhibiteurs de tyrosine
kinase
Erlotinib
Géfi tinib
Afatinib
Highlights
»
It has been demonstrated
that activating EGFR muta-
tions lead to increased affi nity
of tyrosine kinase inhibitors
(TKIs) for the mutant receptor.
»
Randomized clinical trials
have demonstrated the supe-
riority of TKIs over chemothe-
rapy as first-line therapy of
EGFR mutated non-small-cell
lung cancer (NSCLC), in terms
of response rate, progression-
free survival, quality of life
and tolerability. However, no
improvement in overall survival
has been observed, probably
because of cross over from fi rst-
line chemotherapy to second-
line therapy with EGFR TKIs.
»
Nevertheless, TKIs of EGFR
are the current standard fi rst-
line treatment of patients with
advanced NSCLC harboring
activating EGFR mutations.
»
Currently, there are no direct
comparisons between different
TKIs and our choice is based
on pharmacocinetic data and
toxicity profi le.
Keywords
EGFR
Tyrosine kinase inhibitors
Erlotinib
Gefi tinib
Afatinib
sous chimiothérapie dans une population sélec-
tionnée, aussi bien asiatique que caucasienne (4).
Par conséquent, des études de phase III ont été
mises en place sur ce type de population, l’essai
IPASS étant le plus important avec 1 217 patients
randomisés entre géfitinib et chimiothérapie.
Cette étude a montré la supériorité du géfitinib
en termes de SSP limitée aux patients présentant
un driver oncogénique (EGFR). Dans le sous-groupe
des patients EGFR muté (n = 261), la SSP est signi-
ficativement plus longue (9,5 versus 6,3 mois) de
même que les taux de réponse (71 versus 47 %)
en faveur du géfitinib par rapport à l’association
carboplatine et paclitaxel. Il n’y avait pas de diffé-
rence en SG en raison du fort taux de crossover
à l’issue de la première ligne (64 % des patients
ont reçu un ITK en deuxième ligne après la chimio-
thérapie) [5]. Des résultats similaires ont été
retrouvés dans l’étude First-SIGNAL, de phase III
randomisée, qui comparait le géfitinib et le doublet
cisplatine et gemcitabine en première ligne chez
309 patients asiatiques non fumeurs, porteurs
d’un adénocarcinome. Dans le sous-groupe des
patients EGFR muté (n = 42), les taux de réponse
sous géfitinib étaient remarquables (84,6 %), et
la SSP prolongée (8 versus 6,3 mois) par rapport
à la chimiothérapie (6). L’étude de phase III du
WJTOG3405 a comparé le cisplatine et le docé-
taxel au géfitinib chez 172 patients japonais dont
la tumeur était EGFR muté, le groupe géfitinib
avait une SSP plus longue : 9,2 versus 6,3 mois.
Le taux de réponse objective était de 62 % dans le
groupe géfitinib et de 32 % dans le groupe chimio-
thérapie. Dans cet essai, aucune différence de SG
n’a été démontrée (7). Enfin, l’étude NEJ002 a
comparé le géfitinib avec le doublet carboplatine
et paclitaxel en première ligne chez 230 patients
atteints d'un CBNPC muté pour l’EGFR. L’étude a
été interrompue prématurément après l’analyse
intermédiaire en raison d’un gain de SSP, et l’ana-
lyse finale a confirmé ce bénéfice (SSP médiane :
10,8 versus 5,4 mois) [8]. Tout récemment, une
étude de phase IV (IFUM), réalisée dans une
population caucasienne (n = 107), a été publiée
et retrouvait des taux de réponse de 70 %, un taux
de contrôle tumoral de 91 %, une SSP médiane à
9,7 mois et une SG à 19 mois (9).
Erlotinib
L’activité de l’erlotinib chez les patients EGFR muté a
d’abord été évaluée dans un essai espagnol de grande
envergure dans lequel 2 105 patients ont bénéfi cié
d’une analyse en biologie moléculaire montrant
la faisabilité de ce type de sélection en vue d’un
traitement par ITK. Le taux de réponse tumorale
était élevé (70,6 %), et une SSP de 14 mois avait été
observée chez les 350 patients présentant une muta-
tion EGFR (10). Deux essais randomisés de phase III
ont évalué l’effi cacité de l’erlotinib en situation de
première ligne en présence d’une mutation EGFR.
L’étude OPTIMAL a comparé l'erlotinib à l’associa-
tion carboplatine et gemcitabine chez 154 patients
chinois. Le bénéfi ce est en faveur de la thérapie ciblée
pour la SSP (objectif principal) avec une médiane de
13,7 mois, versus 4,6 mois pour la chimiothérapie.
Les patients traités par erlotinib avaient un meil-
leur taux de réponse (83 versus 36 %), et la SG ne
différait pas dans les 2 groupes pour des raisons de
crossover (11). Ces résultats ont été confi rmés par
l’étude EURTAC, de phase III randomisée en première
ligne chez des patients caucasiens, comparant un
groupe avec chimiothérapie standard comportant
un doublet à base d’un sel de platine et un groupe
expérimental avec erlotinib. Sur les derniers résultats
actualisés (janvier 2013), 173 patients ont été inclus
dans cette étude qui est positive sur son objectif
principal − avec une SSP de 10,4 mois pour l’erlotinib
contre 5,1 mois pour la chimiothérapie −, les taux de
réponse sont de 65,1 % pour l’ITK contre 16,1 % pour
la chimiothérapie, et la médiane de SG ne diffère
pas dans les 2 groupes (22,9 mois pour l’erlotinib
et 22,1 mois pour le groupe contrôle) [12].
Afatinib
Les données in vitro montrent une effi cacité anti-
tumorale des ITK irréversibles sur les lignées cellu-
laires porteuses d’une mutation T790M. C’est la
raison pour laquelle le programme de dévelop-
pement de l’afatinib a concerné dans un premier
temps les patients dont la maladie progresse à l’issue
d’un traitement par ITK de première génération.
L’essai de phase IIb/III LUX-Lung 1 a comparé l'afa-

La Lettre du Cancérologue • Vol. XXIII - n° 6 - juin 2014 | 227
MISE AU POINT
tinib à un placebo chez 585 patients présentant
un CBNPC avancé ou métastatique en échec de
1 ou de 2 lignes de chimiothérapie et ayant reçu au
moins 3 mois de traitement par erlotinib ou géfi tinib
(population non sélectionnée sur la mutation EGFR).
Cet essai était négatif sur son objectif principal,
la SG (10,8 versus 12 mois ; HR = 1,08 ; p = 0,74),
et, bien que la SSP fût en faveur du groupe expéri-
mental (3,3 versus 1,1 mois ; HR = 0,38 ; p < 0,0001),
le taux de réponse au traitement par afatinib n’était
que de 7 %.
Lors de l’essai LUX-Lung 2, de phase II évaluant
l’afatinib chez le patient EGFR muté, le taux de
réponse était de 61 % (objectif principal) avec une
SSP médiane de 10 mois. L’essai LUX-Lung 3 a donc
été conçu pour démontrer la supériorité de l’afatinib
sur la chimiothérapie en première ligne. L’afatinib a
été comparé, sur une population mixte (asiatique et
caucasienne), à une chimiothérapie par cisplatine et
pémétrexed. Cet essai de phase III a été mis en place
chez 345 patients (dont 91 caucasiens) porteurs d’un
adénocarcinome avec mutation EGFR recevant l'afa-
tinib en première ligne versus une chimiothérapie par
cisplatine/pémétrexed (6 cycles sans maintenance).
Cet essai est positif sur son objectif principal, la SSP
(11,1 versus 6,9 mois), et pour les mutations les plus
fréquentes (exon 19 et exon 21 ; n = 308), la SSP
s’élève à 13,6 mois pour l’afatinib contre 6,9 mois
pour la chimiothérapie (HR = 0,47 ; p = 0,001). Les
taux de réponse sont en faveur du traitement ciblé
(56 versus 23 %). Le crossover étant autorisé, aucune
différence en SG entre les 2 groupes n’est attendue.
Cette étude est la seule à avoir comparé un inhi-
biteur de tyrosine kinase au doublet de référence
actuellement le plus utilisé en première ligne de
traitement des adénocarcinomes. L’essai LUX-Lung 6
a également comparé afatinib et chimiothérapie,
mais dans une population exclusivement asiatique
de patients (n = 364) porteurs d’un adénocarcinome
muté pour l’EGFR (89 % de mutations communes)
et randomisés entre l’afatinib et le doublet cisplatine
et gemcitabine en première ligne de traitement.
L’objectif principal de la SSP est atteint (11,0 versus
5,6 mois) avec des taux de réponse objective en
faveur de l’ITK (67 versus 23 %) ; les données de SG
ne sont pas matures, mais étaient de 22 mois dans
les 2 groupes au moment de l’analyse intermédiaire.
En dépit du mécanisme d’action particulier de l’afa-
tinib, qui laissait suggérer une activité supérieure
chez les patients ayant déjà reçu un ITK de l’EGFR,
les données actuelles ayant permis l’obtention de
l’AMM sont restreintes à son activité en première
ligne par rapport à un doublet de sel de platine chez
les patients naïfs d’ITK. Les études évaluant l’asso-
ciation afatinib/cétuximab ou d’autres combinaisons
dans cette situation de résistance acquise aux ITK
sont en cours de recrutement, et ces stratégies, bien
qu’encourageantes, ne sont pas encore validées (3).
Différences d’effi cacité
entre les molécules
En l’absence d'études comparatives directes de
phase III entre les ITK, nous sommes contraints de
comparer les essais − bien que ce procédé soit criti-
quable sur le plan statistique −, et l’effi cacité entre
les 3 ITK semble similaire (tableau I, p. 228). Une
étude de phase II a comparé le géfi tinib à l’erlotinib
sur une population enrichie mais non sélectionnée
sur la mutation EGFR (n = 96) et n’a pas retrouvé
de différence signifi cative aussi bien en SSP qu’en
taux de réponse (13). L’analyse poolée de L. Paz-Ares,
publiée en 2010 et réactualisée en 2012 (14, 15),
a comporté une revue de la littérature des études
rétrospectives et prospectives entre 2004 et 2009
ayant évalué l’erlotinib ou le géfi tinib et la chimio-
thérapie dans le CBNPC avec mutation de l’EGFR.
Un total de 54 études avait été répertorié auquel
ont été ajoutés secondairement, en 2012, les prin-
cipaux essais de phase III (NEJ, WJTOG, OPTIMAL,
EURTAC) avec, au fi nal, 20 essais avec la chimio-
thérapie (n = 984), 27 avec l’erlotinib (n = 735), et
56 avec le géfi tinib (n = 1 843). Sur ces données
actualisées, une SSP prolongée était retrouvée
en faveur de l’erlotinib (12,4 mois) par rapport au
géfi tinib (9,3 mois) et à la chimiothérapie (5,6 mois),
et ce pour toutes les lignes de traitement. L’obser-
vation d’une supériorité de l’erlotinib par rapport
au géfi tinib engage à mettre en place une étude
comparative directe entre les différents ITK de l’EGFR
disponibles. De même, d’après la méta-analyse de
F. Petrelli et al. (16), les taux de réponse et la SSP
sont supérieurs avec l’erlotinib comparé au géfi tinib.
Les auteurs ont repris 13 études randomisées, toutes
de phase III (8 études en première ligne, 1 étude en
maintenance et 4 études en deuxième ou en troi-
sième ligne) ayant inclus 10 433 patients au total,
dont 1 260 avec mutation EGFR. Le taux de réponse
avec l'erlotinib donne un HR de 2,78 versus 1,83 pour
le géfi tinib (test d’interaction bilatéral : 2p < 0,0001),
ce qui signifi e que l’erlotinib semble avoir un meilleur
effet sur la réduction du volume tumoral. La SSP avec
l'erlotinib donne un HR de 0,19 versus 0,39 pour le
géfi tinib (2p < 0,0001), ce qui signifi e que l’erlo-
tinib retarde la progression par rapport au géfi tinib.

228 | La Lettre du Cancérologue • Vol. XXIII - n° 6 - juin 2014
Les inhibiteurs detyrosine kinase de l’EGFR dansleCBNPC : sont-ils tous identiques ?
MISE AU POINT
L’essai LUX-Lung 7 a comparé l'afatinib et un ITK
réversible de première génération (géfi tinib) chez
les patients EGFR muté en situation de première
ligne. Cet essai de phase II a inclus 316 patients, les
résultats sont attendus pour 2015 (3). Une étude de
phase II est en cours (CTONG 0901 ASIE) comparant
l’activité du géfi tinib et de l'erlotinib sur les différents
exons. Dans cet essai, 70 patients présentant une
mutation EGFR au niveau de l'exon 21 seront rando-
misés entre géfi tinib et erlotinib : l’objectif principal
est le taux de réponse tumorale (NCT01024413).
Différence de données
pharmacologiques
entre erlotinib et géfi tinib
Alors que la différence d’effi cacité entre Asiatique et
Caucasien n’est pas élucidée, la délétion de l’exon 19
semble de meilleure sensibilité comparée à la muta-
tion L858R (exon 21), mais cette donnée n’est pas
retrouvée dans tous les essais de phase III (1, 2).
Également, des études plus récentes ont montré une
variation de sensibilité aux différents ITK selon les
exons in vitro (17). En pratique clinique, l’erlotinib
est prescrit à sa dose maximale tolérée (DMT), alors
que le géfi tinib n’est prescrit qu’à 1/3 de sa DMT.
In vitro, 250 mg de géfi tinib correspondent à 25 mg
d’erlotinib, c’est d’ailleurs une des raisons qui avait
été évoquée lors de la négativité de l’étude ISEL
par rapport à l’étude BR.1 réalisée avec respective-
ment géfi tinib et erlotinib dans une population non
sélectionnée (18).
Existe-t-il une différence
de sensibilité des ITK
en fonction du type
de mutation EGFR ?
Des différences d’effi cacité en fonction du type de
mutation EGFR ont été mises en évidence avec les
ITK de première génération, celles-ci sont réper-
toriées dans le tableau II (19). Concernant l’acti-
vité de l’afatinib sur les mutations inhabituelles,
les données ont été analysées sur les 3 études
LUX-Lung 2, LUX-Lung 3 et LUX-Lung 6, soit
75 patients (12,5 % du recrutement total). On
retiendra seulement 14 mutations T790M,
23 exons 20 et 38 cas de mutations diverses (compo-
sites entre L861Q, G719X, S768I). Comme pressenti,
la SSP est médiocre chez les patients porteurs d’une
mutation T790M ou d’une insertion de l’exon 20
(2,9 et 2,7 mois respectivement). Pour le groupe
des autres mutations très hétérogènes (présence de
doubles mutations faible/bonne sensibilité), la SSP
de 10,7 mois n’est donc pas le refl et de l’effi cacité de
l’afatinib sur les mutations non communes. D’autre
part, dans l’essai LUX-Lung 6, la SSP médiane passe
Tableau I. Essais de phase III comparant en première ligne un inhibiteur de tyrosine kinase de l’EGFR et un doublet à base de sel de platine chez les patients
porteurs d’une mutation EGFR.
Étude (réf.) n ITK Chimiothérapie Taux de réponse (%) Survie sans progression
(mois)
Survie globale
(mois)
IPASS
(5)
261 Géfi tinib Carboplatine/paclitaxel 71 versus 47
p < 0,001
9,5 versus 6,3; HR = 0,48 ;
p < 0,001; IC95 : 0,36-0,64
21,6 versus 21,9
non signifi catif
First-SIGNAL
(6)
42 Géfi tinib Cisplatine/gemcitabine 85 versus 38
p = 0,001
8 versus 6,3; HR = 0,54 ;
p = 0,001; IC95 : 0,269-1,1
27,2 versus 25,9
non signifi catif
WJTOG
(7)
172 Géfi tinib Cisplatine/docétaxel 62 versus 32
p < 0,0001
9,2 versus 6,3; HR = 0,49 ;
p < 0,0001; IC95 : 0,336-0,71
35,5 versus 38,8
non signifi catif
NEJ002
(8)
230 Géfi tinib Carboplatine/paclitaxel 74 versus 31
p < 0,001
10,8 versus 5,4; HR = 0,30 ;
p < 0,001; IC95 : 0,22-0,41
30,5 versus 23,6
non signifi catif
OPTIMAL
(11)
154 Erlotinib Carboplatine/gemcitabine 83 versus 36
p < 0,0001
13,7 versus 4,6; HR = 0,16 ;
p < 0,0001; IC95 : 0,10-0,26
22,6 versus 28,8
non signifi catif
EURTAC
(12)
173 Erlotinib Multiples options autorisées 65 versus 16
p < 0,0001
10,4 versus 5,1; HR = 0,33 ;
p < 0,0001; IC95 : 0,23-0,49
22,9 versus 22,1
non signifi catif
LUX-Lung3
(3)
345 Afatinib Cisplatine/pémétrexed 56 versus 23
p = 0,001
11,1 versus 6,9; HR = 0,58 ;
p = 0,001; IC95 : 0,43-0,78
Non rapportée
LUX-Lung6
(3)
364 Afatinib Cisplatine/gemcitabine 67 versus 23
p < 0,0001
11 versus 5,6; HR = 0,28 ;
p < 0,0001; IC95 : 0,20-0,39
Non rapportée

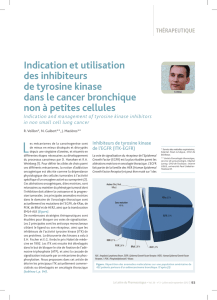
Figure. Principales toxicités retrouvées dans les essais de phase III évaluant un inhibiteur
de tyrosine kinase en première ligne (23).
80
90
100
10
20
30
40
50
60
70
0Rash tous grades ParonychiesDiarrhée tous grades Mucite tous grades Transaminases
Géfi tinib IPASS Géfi tinib WJTOG
Géfi tinib First-SignalGéfi tinib NEJ002
Erlotinib OPTIMALAfatinib LUX-Lung 3
Erlotinib EURTAC Afatinib LUX-Lung 6
La Lettre du Cancérologue • Vol. XXIII - n° 6 - juin 2014 | 229
MISE AU POINT
de 11,1 à 13,6 mois en ne gardant que les mutations
communes, ce qui confi rme l’impact négatif de ces
mutations rares sur l’effi cacité de l’afatinib (3, 20).
Métastases cérébrales
et méningite carcinomateuse
En l’absence de métastases cérébrales préexis-
tantes, l’encéphale est un site fréquent de
progression sous ITK, car leur concentration dans
le liquide céphalo rachidien (LCR) est inférieure à
la concentration plasmatique, ce qui entraîne un
“effet sanctuaire” au niveau cérébral. Le taux de
pénétration dans le LCR du géfitinib est environ
de 1 % contre 2,5 à 13 % pour l’erlotinib, ce qui
pourrait expliquer une meilleure activité de l’erlo-
tinib dans les atteintes méningées et cérébrales. Ce
meilleur passage méningé pourrait expliquer que
des patients traités par erlotinib à la suite d'une
progression sous géfitinib aient obtenu une réponse
partielle cérébrale dans quelques cas décrits dans
la littérature, sans pour autant avoir actuellement
entraîné de modifications des recommandations
de prescription (21).
Infl uence des inhibiteurs
de la pompe à protons
Comme précisé dans le tableau III, le pH gastrique a
une infl uence sur l’absorption de l’erlotinib. Cepen-
dant, une étude réalisée rétrospectivement dans
l’essai BR.21 sur le taux plasmatique d’erlotinib en
fonction de l’utilisation ou non d’antiacide n’a pas
montré de modifi cation signifi cative de celui-ci entre
les 2 groupes de patients (22).
Différences de toxicité
La différence majeure entre les ITK de première et
de deuxième génération repose sur la toxicité de ces
derniers. Les effets indésirables rapportés dans les
essais de phase III sont résumés dans la fi gure. Le
rash est l’effet indésirable le plus commun, puisque
retrouvé dans 71 à 89 % des cas en fonction des ITK
(tous grades confondus). Par contre, les effets indési-
rables cutanés de grade 3 sont moins fréquents avec
le géfi tinib (2-5,3 %) et l’erlotinib (2-13 %) qu’avec
l’afatinib (14,6-16,2 %). La diarrhée est commune
avec le géfi tinib et l’erlotinib (34,2-48 et 25-57 %
respectivement), alors qu’elle est quasiment constante
Tableau III. Caractéristiques produits des 3 inhibiteurs de tyrosine kinase disponibles sur le
marché (1, 2).
Caractéristiques Géfi tinib Erlotinib Afatinib
Dose maximale tolérée (mg) 800-1 000 150 50
Présentation (mg) 250 150, 100, 25 50, 40, 30, 20
Biodisponibilité (%) 59
Non modifi ée
par les repas
60
Augmentée
par les repas
–
Diminuée
par les repas
Effet du pH gastrique Aucun Diminue l’ASC Non évalué
Concentration minimale
inhibitrice IC50 in vitro
EGFR 3 nM
HER2 1 830 nM
EGFR 0,5 nM
HER2 512 nM
EGFR 0,5 nM
HER2 14 nM
Effet du tabac Aucun Diminue l’ASC Aucun
Demi-vie d’élimination (h) 41 36 37
Élimination hépatique (%) 96 90 85
ASC: aire sous la courbe.
Tableau II. Effi cacité des inhibiteurs de tyrosine kinase de l’EGFR de première génération (erlo-
tinib ou géfi tinib) dans les CBNPC avec mutations rares (19).
Nombre
depatients
Type de mutation de l’EGFR Taux de réponse
(%)
SSP
(mois)
SG
(mois)
278 Classique (exon 19 ou L858R) 74,1 8,5 19,6
11 Insertions exon 20 0 1,4 4,8
15 G719 (simple ou complexe) 53,3 8,1 16,4
15 L861 (simple ou complexe) 60 6 15,2
20 Mutation rare combinée avecdélétion
exon 19 ou L858R
60 5,3 18,8
15 Mutation rare SANS combinaison avec
délétion exon 19, L858R, G719 ou L861
20 1,6 11,1
SG: survie globale; SSP: survie sans progression.
 6
6
 7
7
1
/
7
100%