L’ Les traitements par voie percutanée de l’insuffisance mitrale M

MISE AU POINT
L’
insuffisance mitrale est une cause importante de
morbimortalité cardiovasculaire à travers le monde
(1). En cas de fuite mitrale sévère non ischémique,
la chirurgie réparatrice est la technique préférée, car elle permet
une correction complète de la fuite avec préservation de l’appa-
reil sous-valvulaire mitral et de la fonction ventriculaire gauche
(VG) sans augmenter le risque thrombogène, le remplacement
valvulaire n’étant réalisé qu’en dernier recours. L’indication opé-
ratoire est formelle en cas de fuite symptomatique, justifiée en
cas de signe de dysfonction VG asymptomatique, et a été récem-
ment recommandée en cas de fuite sévère paucisymptomatique
et sans dysfonction VG (2). Cette tendance à la correction pré-
coce (“early surgery”) oblige le chirurgien à réaliser le geste de
réparation avec une morbimortalité opératoire minimale. C’est
dans cette perspective que des techniques percutanées moins inva-
sives ont récemment vu le jour, permettant d’éviter le risque opé-
ratoire de la chirurgie à cœur ouvert avec clampage aortique et
circulation extracorporelle.
En cas de fuite mitrale ischémique ou fonctionnelle, la dysfonc-
tion VG existe, par définition, dès la première présentation cli-
nique. Ces patients ont un risque opératoire important et l’asso-
ciation d’une plastie mitrale aux pontages coronaires aggrave le
pronostic opératoire pour une correction dont les résultats sont
variables et peu prévisibles (3). De plus, dans ce cas, l’aggrava-
tion du pronostic apparaît dès la présence d’une fuite mitrale
modérée qui favorise l’aggravation du remodelage VG (4) et la
survenue de signes d’insuffisance cardiaque (5). Ainsi, le traite-
ment chirurgical de ce type de fuite est grevé d’une morbimor-
talité significative pour un résultat incertain. Le traitement per-
cutané, s’il s’avère possible et efficace, semble pallier ces deux
déficits et répondre à un besoin clinique réel et grandissant
compte tenu du vieillissement de la population et du nombre accru
de patients en insuffisance cardiaque terminale ou en prétrans-
plantation. C’est dans cette optique que la majorité des disposi-
tifs testés l’ont été principalement sur des modèles expérimen-
taux d’insuffisance mitrale ischémique ou fonctionnelle, ou sur
des patients présentant le plus souvent des cardiopathies évoluées
avec insuffisance mitrale fonctionnelle.
Nous proposons d’étudier ici tous les moyens non chirurgicaux
permettant de faire régresser la fuite mitrale et d’améliorer le pro-
nostic de ces patients.
La Lettre du Cardiologue - n° 394 - avril 2006
25
Les traitements par voie percutanée
de l’insuffisance mitrale
Percutaneous mitral valve repair: state of the art
●
E. Messas*
* Unité fonctionnelle de cardiologie adulte, hôpital Necker-Enfants malades,
Paris.
■L’insuffisance mitrale est une cause importante de mor-
bimortalité cardiovasculaire à travers le monde.
■La tendance actuelle est à la correction précoce (“early
surgery”), qui oblige le chirurgien à réaliser le geste de
réparation avec une morbimortalité opératoire minimale.
C’est dans cette perspective que des techniques percuta-
nées moins invasives ont récemment vu le jour, permet-
tant d’éviter le risque opératoire majeur de la chirurgie à
cœur ouvert.
■Deux techniques font l’objet d’études cliniques de
phases I et II : l’Evalve®(équivalent de la technique d’Al-
fieri en percutané) et le dispositif Coapsys®(tige trans-
ventriculaire avec deux palettes aux extrémités).
■D’autres techniques sont en cours de développement pré-
clinique : le “ballon-patch” et l’annuloplastie percutanée.
■Le succès de cette nouvelle voie thérapeutique dépen-
dra du développement de l’imagerie 3D en temps réel,
pouvant guider le geste de façon précise et reproductible,
et du choix de la technique de réparation, qui devra gar-
der les grandes lignes de la philosophie de la plastie mitrale
chirurgicale : identifier le mécanisme de dysfonction val-
vulaire avant de réparer la valve.
Mots-clés : Insuffisance mitrale - Traitement percutané -
Échocardiographie - Nouveaux dispositifs.
Keywords: Mitral regurgitation - Percutaneous repair -
Echocardiography - New devices.
Points forts

La Lettre du Cardiologue - n° 394 - avril 2006
26
DISPOSITIFS NON SPÉCIFIQUES
Utilisation des traitements percutanés de l’insuffisance
cardiaque
En cas de bloc de branche gauche (tronculaire ou distal du fait
de la fibrose) avec déphasage inter- et surtout intraventriculaire,
certaines études ont mis en évidence une possibilité de régres-
sion ou de diminution de la fuite mitrale après stimulation multi-
site. Plusieurs mécanismes sont proposés pour expliquer cet effet :
resynchronisation des piliers mitraux, effets antiremodelage, ou
augmentation de l’inotropisme VG se traduisant par une aug-
mentation de la pente dp/dt (calculée sur le tracé du Doppler
continu de la fuite). L’échographie doppler cardiaque peut aider
au réglage des délais favorisant la diminution de la fuite mitrale
fonctionnelle (6). D’autres alternatives plus récentes et moins
codifiées sont en cours d’évaluation. Des études pilotes menées
avec le dispositif CorCap®Cardiac Support (Acorn Cardiovas-
cular), et consistant à envelopper d’une “chaussette” le ventri-
cule afin de limiter la dilatation du VG pour des patients en insuf-
fisance cardiaque terminale, donnent aussi des résultats
prometteurs (7).
Infarctus septal en cas de myocardiopathie hypertrophique
La technique classique du traitement de l’obstruction intra-VG
résistante au traitement médical est la chirurgie par myomecto-
mie. De nombreuses techniques percutanées ont récemment vu le
jour et ont connu un essor important. L’alcoolisation septale par
voie percutanée permet une régression de l’obstruction avec dimi-
nution de l’effet venturi et donc de la fuite mitrale par SAM (mou-
vement systolique antérieur de la valve mitrale) (8). D’autres tech-
niques sont en cours d’évaluation afin d’obtenir des résultats plus
précis et moins invasifs (en termes de pic de troponine), comme
la pose de coil intracoronaire permettant l’oblitération des artères
septales perforantes. Cette dernière technique est en cours d’éva-
luation et devrait permettre aussi, par diminution de l’accéléra-
tion sous-aortique, une diminution de la fuite mitrale (9).
DISPOSITIFS DÉDIÉS AU TRAITEMENT
DE L’INSUFFISANCE MITRALE (IM)
Dispositifs avec développements cliniques débutés
●
La première technique est une tentative de réparation d’Alfieri par
voie percutanée. Il s’agit soit d’une suture directe (Edwards®E2E
repair), soit de la pose d’un clip (EVEREST repair), le but étant d’ob-
tenir une réduction de l’IM par la création de deux orifices mitraux,
équivalent d’un “Alfieri”. Seule la “edge to edge repair” (EVE-
REST) a été appliquée dans une étude présentée lors de la dernière
session de l’American College of Cardiology (ACC, Orlando, 2005)
à 27 patients porteurs d’IM importante (une minorité était fonc-
tionnelle). La procédure est réalisée par voie transseptale sous écho-
graphie et radioscopie afin de mettre en place le clip sur les bords
libres de la portion médiane des deux feuillets mitraux, réalisant ainsi
un double anneau mitral (figure 1). Un protocole très précis est uti-
lisé afin de standardiser les coupes ETO requises pour une visuali-
sation et une aide optimale de l’échographiste, afin de positionner
au mieux le clip sans gêner les structures avoisinantes.
Vingt patients ont subi l’intervention complète (90 % d’IM dégé-
nératives, 10 % d’IM ischémiques) avec un suivi de 30 jours ;
17 patients ont été implantés avec succès, avec diminution immé-
diate de la fuite mitrale (≤2+ chez 13 patients). Il n’y a pas eu
de complications majeures de l’intervention, mis à part un cas de
détachement de clip nécessitant une procédure chirurgicale. Deux
autres patients ont eu une plastie mitrale pour résultats incom-
plets de la procédure. Les 14 patients restants n’ont pas eu à subir
de reprise chirurgicale à 30 jours. Le temps moyen de la procé-
dure oscille entre 160 et 200 minutes. Cette technique semble
donc prometteuse, mais elle nécessite probablement encore
quelques ajustements.
Ce travail préliminaire va être suivi par EVEREST II, travail pros-
pectif, randomisé (chirurgie ou plastie percutanée) et multicen-
trique (10).
On comprend aisément qu’une des limitations majeures de cette
technique est le guidage échographique 2D et non 3D dans le ven-
tricule. Les promoteurs de cette technique devront donc s’attacher
à un meilleur guidage de leur système de largage afin de rendre la
technique moins dangereuse et surtout plus reproductible.
●
La deuxième technique, testée par une équipe indienne de New
Delhi et par une équipe de New York, utilise le dispositif Coap-
sys®(Myocor). Des résultats préliminaires ont été présentés lors
de la dernière session de l’ACC, portant sur 23 patients porteurs
d’une IM ischémique fonctionnelle. Le principe est de diminuer
le diamètre antéropostérieur ventriculaire et annulaire en rap-
prochant le pilier du plan de projection de l’anneau mitral, ce qui
permet de réduire les forces de tractions et la fuite mitrale
(figure 2). Vingt-trois patients avec fuite mitrale ischémique ≥
2+ devant subir un pontage ont été inclus dans cette étude ; 13
patients ont été traités par Coapsys®et comparés à 10 contrôles.
Les caractéristiques cliniques et échographiques de base sont
comparables dans les deux groupes. À un an, on retrouve une
MISE AU POINT
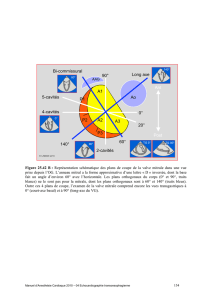
Figure 1. Description du dispositif Evalve
®
.
A: mécanisme d’action du dispositif qui permet de larguer le clip par voie
antérograde avec fixation des segments médians des deux feuillets mitraux.
B: vue de face du cathéter (d’après Feldman T. J Am Coll Cardiol 2005;
46(11):2134-40).

La Lettre du Cardiologue - n° 394 - avril 2006
27
MISE AU POINT
nette diminution de la fuite mitrale dans le groupe Coapsys®
(degré de la fuite à un an : 1,15 ± 0,99 versus 2,00 ± 0,82 dans
le groupe contrôle ; p < 0,05). Ces résultats intéressants doivent
être confirmés par de futures études multicentriques. Cependant,
les images échographiques montrent une nette akinésie septale
en regard du stabilisateur du dispositif. On sera donc attentif à la
conservation de la fraction d’éjection dans les études à venir (11).
DISPOSITIFS EXPÉRIMENTAUX
Application d’une contrainte externe
Une autre solution à cœur battant, proposée par l’équipe de
R.A. Levine (Boston), est l’application d’un dispositif externe
qui repositionne les piliers et réduit la fuite mitrale (14). Un patch
en dacron est placé à cœur battant sur la région du pilier infarci
et un ballon est placé entre le patch et le myocarde. L’inflation
du ballon permet de déplacer antérieurement le pilier postérieur
vers l’anneau mitral avec diminution de la traction des feuillets
sous visualisation échocardiographique (figure 3).
Figure 3. Principe d’action du “ballon-patch”.
Figure 2. Description des insertions du dispositif Coapsys
®
.
A, B : localisation des deux extrémités du dispositif en regard des artères
coronaires, palette postérieure entre les deux marginales (A), palette anté-
rieure sous l’insertion septale du ventricule droit (B) ; C: vue chirurgicale du
petit axe ventriculaire en coupe transmitrale : localisation de l’extrémité pos-
térieure du dispositif au niveau de l’anneau en regard du segment médian de
la petite valve ; D: coupe grand axe du VG avec visualisation de la tige trans-
ventriculaire du dispositif se positionnant sous les feuillets mitraux.
L’extrémité antérieure se place sur le septum interventriculaire sous l’inser-
tion ventriculaire droite (d’après Fukamachi K. ASAIO J 2005;51:17-21).
●
Une troisième technique en cours de développement est l’an-
nuloplastie percutanée utilisant le sinus coronaire comme sup-
port. Cette technique utilise la position du sinus coronaire entou-
rant le segment postérieur de l’anneau mitral afin de diminuer le
diamètre antéropostérieur de celui-ci. Dans une étude expéri-
mentale menée par la Cleveland Clinic sur un modèle ovin d’IM
ischémique chronique, la pose percutanée de ce dispositif dans
le sinus coronaire réduisait la fuite mitrale (planimétrie du jet
passant de 5,4 ± 2,6 cm2à 1,3 ± 0,9 cm2) grâce à une diminution
du diamètre antéropostérieur de l’anneau et de la surface sous-
latente de la valve mitrale.
Des études humaines sont en cours, plus particulièrement au
Venezuela et en Europe. Cinq cas ont été récemment décrits et
publiés par une équipe canadienne qui semble retrouver des résul-
tats encourageants avec quatre implantations réussies et une
réduction de la fuite mitrale, celle-ci passant du grade 3,0 ± 0,7
à 1,6 ± 1,1. Les auteurs ne rapportent pas de complications signi-
ficatives de la procédure (12).
Cependant, on est en droit de s’interroger sur l’avenir de cette tech-
nique alors même que l’annuloplastie postérieure partielle chirurgi-
cale présente des taux de récidive de fuite mitrale de 30 à 50 % (13).
A
B
C
D
Patch
Gonflement
du ballon
Restauration de
la coaptation
Feuillets avec
traduction apicale
Une fuite mitrale est produite chez le mouton soit par ligature
des deux premières marginales et de l’interventriculaire posté-
rieure (IM aiguë, n = 3), soit par ligature des deuxième et troi-
sième marginales (IM chronique, n = 7). Quand la fuite mitrale
est obtenue, un patch de dacron est suturé sur la zone infarcie,
identifiée par sa couleur. L’inflation à l’aide de sérum physiolo-
gique d’un ballon oblong placé en parallèle au grand axe ventri-
culaire, entre le patch et le myocarde, permet de déplacer la zone
infarcie, vers le centre de la cavité ventriculaire (figure 4). L’écho-
graphie réalisée pendant la procédure permet de guider le geste
en évaluant, en temps réel, l’efficacité de l’inflation du ballon sur
la coaptation mitrale. Les résultats sont concluants, avec une dimi-
nution significative de la fraction de régurgitation mitrale en fin
de procédure (p < 0,001).
En cas d’IM chronique, l’étude par courbes pression-volume ne
retrouve pas de diminution de l’élastance (pente de la relation
pression-volume télésystolique) témoignant de la conservation
Figure 4. Vue échographie apicale 3 cavités couplée au Doppler couleur.
Avant inflation Après inflation

La Lettre du Cardiologue - n° 394 - avril 2006
28
de la fonction contractile globale du ventricule gauche. La courbe
pression-volume télédiastolique est affectée de façon variable en
parallèle avec la variation de l’inflation du ballon au cours du
temps, avec une tendance (non significative) à la diminution de
la compliance (p = 0,06).
De plus, ce “ballon-patch” n’entraîne pas de trouble de la ciné-
tique segmentaire, et l’évaluation par microsphères du débit coro-
naire dans la partie non nécrosée retrouve une perfusion normale.
Une autre technique en cours d’évaluation est la transplantation
de myoblastes périphériques autologues. L’hypothèse sous-
jacente est que la transplantation cellulaire, en limitant le remo-
delage ventriculaire, peut aussi en limiter les effets sur les modi-
fications géométriques de l’appareil mitral, responsables de l’IM
ischémique. Ce “patch biologique” aurait l’avantage de pouvoir
être appliqué par voie percutanée.
Afin de tester cette hypothèse, un infarctus inférobasal est créé
chirurgicalement chez 13 moutons, produisant une IM isché-
mique chronique à 8 semaines. À ce stade, les animaux sont ran-
domisés pour injections intramyocardiques de myoblastes auto-
logues en culture (230 millions de cellules, 65 % positifs au CD 56)
(n = 6) ou de milieu de culture (n = 7). Les paramètres échogra-
phiques (3D et 2D) sont comparables entre les deux groupes à
l’état basal et en pré-Tx. On note un effet favorable de la greffe
de cellules à 2 mois post-Tx (c’est-à-dire 4 mois après l’infarc-
tus) avec une diminution de la progression de la fuite mitrale
(volume régurgitant : – 1,83 ± 0,32 ml versus 5,9 ± 0,7 ml dans
le groupe contrôle ; p < 0,0001) et de la fraction d’éjection
(2,01 ± 0,94 % versus – 4,86 ± 2,23 % dans le groupe contrôle ;
p = 0,02), et une amélioration du score de cinétique segmentaire
du VG (– 0,25 ± 0,11 versus 0,13 ± 0,03 dans le groupe contrôle ;
p < 0,01). La transplantation de myoblastes squelettiques auto-
logues atténue le remodelage local avec une diminution de la pro-
gression de la distance pilier-anneau mitral (– 0,41 ± 0,09 cm
versus 0,44 ± 0,12 dans le groupe contrôle ; p < 0,001) et une
tendance à la diminution de la progression du volume télésysto-
lique (23,3 ± 3,5 ml versus 35,4 ± 4,2 ml dans le groupe
contrôle ; p = 0,055). Ces résultats sont à placer dans la pers-
pective d’une application clinique en cas d’annuloplastie mitrale
et de pontage coronaire. L’injection de myoblastes squelettiques
autologues dans la région sous-jacente au pilier pourrait permettre
une régression du remodelage local, et ainsi améliorer le résul-
tat de l’annuloplastie (14).
CONCLUSION
Le traitement par voie percutanée de l’insuffisance mitrale répond
à un besoin clinique réel correspondant à une variété de patients
parcourant le spectre de présentation clinique de la maladie (du
patient asymptomatique à l’insuffisant cardiaque avec dysfonc-
tion VG). Le succès de cette nouvelle voie thérapeutique dépen-
dra du développement de l’imagerie 3D en temps réel, pouvant
guider le geste de façon précise et reproductible, et du choix de
la technique de réparation, qui devra garder les grandes lignes de
la philosophie de la plastie mitrale chirurgicale : identifier le méca-
nisme de dysfonction valvulaire avant de réparer la valve. ■
Bibliographie
1. Otto CM, Salerno CT. Timing of surgery in asymptomatic mitral regurgitation.
N Engl J Med 2005;352(9):928-9.
2. Enriquez-Sarano M, Avierinos JF, Messika-Zeitoun D et al. Quantitative
determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med
2005;352(9):875-83.
3. Hung J, Papakostas L, Tahta SA et al. Mechanism of recurrent ischemic mitral
regurgitation after annuloplasty: continued LV remodeling as a moving target.
Circulation 2004;110 (11 Suppl. 1):II85-90.
4. Grigioni F, Enriquez-Sarano M, Zehr KJ, Bailey KR, Tajik AJ. Ischemic mitral
regurgitation: long-term outcome and prognostic implications with quantitative
Doppler assessment. Circulation 2001;103:1759-64.
5. Gillinov AM, Wierup PN, Blackstone EH et al. Is repair preferable to replace-
ment for ischemic mitral regurgitation? J Thorac Cardiovasc Surg 2001;
122:1125-41.
6. Scwhammenthal E, Popescu AC, Popescu BA et al. Acute effect of cardiac
resynchronization therapy on functional mitral regurgitation in advanced systolic
heart failure. J Am Coll Cardiol 2003;41:765-70.
7. Kleber FX, Sonntag S, Krebs H et al. Follow-up on passive cardiomyoplasty
in congestive heart failure: influence of the Acorn cardiac support device on left
ventricular function. J Am Coll Card 2001;37:1043A.
8. Achouh P, Messas E, Fabiani JN. Mouvement systolique antérieur de la valve
mitrale. Encycl Méd Chir. Paris : Éd. Elsevier, Techniques chirurgicales, Thorax
42-720,2003,8.
9. Lafont A, Durand E, Brasselet C et al. Percutaneous transluminal septal coil
embolisation as an alternative to alcohol septal ablation for hypertrophic obs-
tructive cardiomyopathy. Heart 2005;91(1):92.
10. Feldman T, Wasserman HS, Herrmann HC et al. Percutaneous mitral valve
repair using the edge-to-edge technique: six-month results of the EVEREST
phase I clinical trial. J Am Coll Cardiol 2005;46(11):2134-40.
11. Fukamachi K, Inoue M, Popovic Z et al. Optimal mitral annular and subval-
vular shape change created by the Coapsys®device to treat functional mitral
regurgitation. ASAIO J 2005;51:17-21.
12. Webb JG, Harnek J, Munt BI et al. Percutaneous transvenous mitral annulo-
plasty: initial human experience with device implantation in the coronary sinus.
Circulation 2006;113(6):851-5.
13. Tahta SA, Oury JH, Maxwell JM, Hiro SP, Duran CM. Outcome after mitral
valve repair for functional ischemic mitral regurgitation. J Heart Valve Dis
2002;11(1):11-8.
14. Messas E, Bell A, Morichetti M et al. Can autologous myoblast transplanta-
tion decrease chronic ischemic mitral regurgitation? J Am Coll Cardiol 2006 (in
press).
MISE AU POINT
1
/
4
100%