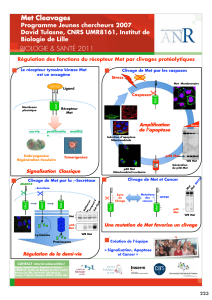
Les grandes voies de transmission du signal en cancérologie :

Dynamique des réseaux de signalisation
et réponse aux thérapies ciblées
Les grandes voies de transmission du signal en cancérologie :
où en sommes-nous ?
Unité "Biologie et Thérapies Innovantes
des Cancers Localement Agressifs" (BioTICLA)
Pascal GAUDUCHON
D.E.S. d’ONCOLOGIE, 20 juin 2014

Hanahan et Weinberg, Cell, 2011
Les caractéristiques des cellules cancéreuses comme cibles thérapeutiques

Changements des voies de signalisation dans les cellules cancéreuses
Altérations génétiques et épigénétiques touchant
des (proto)oncogènes et des gènes suppresseurs de tumeurs
Hanahan et Weinberg
Cell, 2000
Hanahan et Weinberg, Cell, 2000

Signalisation oncogène à partir de l’EGFR
Surexpression Stimulation autocrine
Mutation activatrice
Défaut de
régulation négative Hétérodimérisation
et « dialogue »
Signal oncogène

“Personalized cancer medicine is based on increased knowledge of the cancer
mutation repertoire and availability of agents that target altered genes or pathways”
Mutation Frequencies
in Common Cancers
Dancey et al., Cell, 2012
“Cancer genetics is accelerating the time
from ‘driver mutation discovery’ to ‘clinical proof-of-
concept’ and the approval of new drugs”
Chin et al., Nature medicine (2011)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%