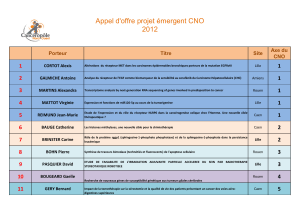
Met Cleavages BIOLOGIE & SANTÉ 2011 Programme Jeunes chercheurs 2007

223
Régulation des fonctions du récepteur Met par clivages protéolytiques
Met Cleavages
Programme Jeunes chercheurs 2007
David Tulasne, CNRS UMR8161, Institut de
Biologie de Lille
BIOLOGIE & SANTÉ 2011
CONTACT :[email protected]
r
Equipe Signalisation, Apoptose et Cancer
UMR8161, Institut de Biologie de Lille/ Institut
Pasteur de Lille, Université Lille Nord de
France, 1 Rue Pr Calmette, BP447, 59021 Lille
Le récepteur tyrosine kinase Met
est un oncogène
survie prolifératio
n
motilité
Embryogenèse
Régénération tissulaire Tumorigenèse
Met
Signalisation Classique
Récepteur
Met
Ligand
Membrane
plasmique
Clivage de Met par les caspases
Clivage de Met par la γ-Secrétase
HGF/SF
Caspases
Stress
Met
Stress
p40 Met
Amplification
de l’apoptose
Met Membranaire
p40 Met
Mitochondrial/nucléaire
Induction d’apoptose
Mitochondriale
Génération
de p40 Met
Met
Régulation de la demi-vie
Met
Met
-
WB Met
p55
Met
Met
Bafilomyci
ne
Composé E
Baf+CpnE
Lysosome
Protéasome
ADAM10
γ-Secrétase
Met
Clivage de Met et Cancer
Met
Zone
de
Clivage
Mutations
des
cancers
Une mutation de Met favorise un clivage
Création de l’équipe
« Signalisation, Apoptose
et Cancer »
R970C
Met R970C
Met
p45
Met
WB Met
WB Met
HGF/SF
1
/
1
100%