L’ Cancer colorectal : nouveautés DOssIeR ThÉmATIque Colorectal cancer: news

106 | La Lettre de l’Hépato-gastroentérologue • Vol. XV - n° 2 - mars-avril 2012
DOSSIER THÉMATIQUE
XXIIIe Journée scientifique
FFCD-PRODIGE
Cancer colorectal : nouveautés
Colorectal cancer: news
J.M. Phelip*, N. Bouarioua*, X. Coulaud*
* Service d’hépato-gastroentéro-
logie et d’oncologie digestive, CHU
de Saint-Étienne.
L’
année 2011 a été marquée par la présentation
ou la publication des résultats de plusieurs
essais dont certains sont susceptibles de
modifier nos pratiques et d’influencer la stratégie
de prise en charge des cancers colorectaux. Ces
données concernent tant le cancer du côlon que
le cancer du rectum, en adjuvant ou au stade méta-
statique.
Traitements adjuvants
des cancers du côlon
➤
L’ASCO® 2011 a été tout d’abord marquée
par les résultats négatifs des essais NSABP C08
et AVANT (ASCO® 2011, abstracts 3508 et 3509)
concernant l’apport du bévacizumab au FOLFOX4
(ou au XELOX) en traitement adjuvant des cancers
du côlon. En tout, 2 673 patients ont été rando-
misés dans l’essai du NSABP (75 % stade III et
25 % stade II) et 3 451 patients dans l’essai AVANT.
La survie sans progression (SSP) était l’objectif
principal dans les 2 essais. Les HR étaient respec-
tivement de 0,93 (0,81-1,08) [essai NSABP C-08]
et de 1,17 (0,98-1,39) [/FOLFOX4, essai AVANT]
et de 1,07 (0,90-1,28) [/XELOX, essai AVANT]
(figure 1). Le bévacizumab pendant 1 an, associé
à un schéma à base d’oxali platine pendant 6 mois
n’apporte donc pas de bénéfice au schéma FOLFOX4
ou XELOX seuls pendant 6 mois en traitement adju-
vant des cancers du côlon de stade II ou III.
➤
L’association FOLFIRI + cétuximab, efficace au
stade métastatique, a fait l’objet d’un essai de phase III
comparé au FOLFIRI seul dans le cancer du côlon
de stade III (essai NCCTG-NO147). Cet essai a été
prématurément interrompu (n = 146) en raison des
résultats négatifs du FOLFIRI en traitement adjuvant
des cancers du côlon de stade III (essai CALB89803,
PETACC3, ACCORD2) [ASCO® 2011, abstract 3522].
L’objectif principal qui était la SSP à 3 ans apparaît
cependant en faveur de l’association FOLFIRI +
cétuximab (HR = 0,4 [0,2-0,97]). Le bénéfice était
plus marqué dans la population des tumeurs KRAS
sauvage (n = 95) [HR = 0,3 (0,1-1,02)]. Ces résultats
devraient inciter à comparer cette association en
phase III au schéma de référence FOLFOX4.
➤
D. Morton et al. ont présenté à l’ASCO® 2011
(abstract 3568) les résultats d’un essai de phase II
randomisé comparant une chimiothérapie péri-
opératoire (3 cures de FOLFOX4 préopératoire et
9 cures postopératoires) à une chimiothérapie post-
opératoire par 12 cures de FOLFOX4 en traitement
adjuvant de la résection d’un cancer du côlon de
stade T3, avec extension extramurale de la tumeur
de plus de 5 mm ou de stade T4 (bilan scano-
graphique). Il n’y avait pas de différence en termes
de morbimortalité entre les 2 stratégies. Les auteurs
ne rapportaient pas non plus de différence concer-
nant le stade histologique. Il existait en revanche
des taux de résection R0 plus marqués en faveur de
la chimiothérapie péri opératoire (90 % versus 77 % ;
p = 0,04). Ces résultats méritent d’être validés par
un essai de phase III, qui est en cours d’ouverture
en France (PRODIGE 22/ECKINOXE).
➤
Une analyse poolée rétrospective des
essais C-05 à C-08 du NSABP regroupant
3 000 patients avec un cancer du côlon de
stade II (dont 1 542 à haut risque de rechute)
n’a pas retrouvé de bénéfice en termes de survie
sans maladie ou de survie globale à l’utilisation
de l’oxaliplatine associé à une chimiothérapie
à base de 5FU et d’acide folinique, que ce soit
dans la population globale des stades II ou dans la
population particulière des stades II à haut risque
(abstract 3507) [tableau I].
HGE 2(XV) MARS AVRIL 2012.indd 106 04/05/12 15:26

La Lettre de l’Hépato-gastroentérologue • Vol. XV - n° 2 - mars-avril 2012 | 107
Figure 1. Survie sans récidive (SSR) et survie globale (SG) des essais NSABP C-08 et AVANT.
Points forts
Adjuvant
»Pas de bénéfice du bévacizumab dans le traitement adjuvant d’un cancer du côlon.
»
L’ajout d’oxaliplatine à la RCT (5FU) préopératoire n’améliore pas le contrôle local du cancer du rectum
et majore la toxicité. La capécitabine peut remplacer le 5FU.
»La RCT néo-adjuvante du cancer du rectum améliore le contrôle local mais n’améliore pas la survie.
Métastatique
»
Le panitumumab, associé au FOLFOX4, améliore les taux de réponse et la SSP des cancers du côlon
en première ligne métastatique par rapport au FOLFOX4 KRAS sauvage.
»
Une chimiothérapie séquentielle, progressivement intensifiée, est justifiée chez les patients de mauvais
pronostic (âgés, multimétastatiques et à l’état général altéré).
»L’aflibercept (VEGF-Trap) associé au FOLFIRI améliore le pronostic des patients en échec d’une chimio-
thérapie de première ligne à base d’oxaliplatine.
Mots-clés
Cancer colorectal
métastatique
Chimiothérapie
Biothérapies
Traitement adjuvant
Highlights
Adjuvant
»
No benefit of bevacizumab
in the adjuvant treatment of
colon cancer.
»
Association of oxaliplatine
with preoperative RTCT (5FU)
does not improve local control
of rectal cancer and increases
toxicity. Capecitabine can
replace 5FU.
»
Neoadjuvant RTCT of rectal
cancer improves local control
but not survival.
Metastatic
»
Panitumumab associ-
ated with FOLFOX4 in first
metastatic line improves the
response rates and the PFS
of colon cancers compared to
FOLFOX4 alone (KRAS WT).
»
A sequential chemotherapy,
gradually intensified, is justified
for bad prognosis patients (old,
multi-metastatic and with low
performance status).
»
Aflibercept (VEGF-Trap)
associated with fOLFIRI
improves survival for patients
failing in first line oxaliplatine-
based chemotherapy.
Keywords
Adjuvant treatment
Biotherapy
Chemotherapy
Metastatic colorectal cancer
Tableau I. Efficacité de l’oxaliplatine en traitement adjuvant des cancers du côlon de stade II : analyse poolée rétrospective
des essais NSABP C-05 à C-08.
Patients SSM 5 ans (%) ∆ (%) SG 5 ans (%) ∆ (%)
STADE II haut risque
FU/AF 1 100 76,3 + 4,4
NS
86,7 + 3,5
NS
FU/AF + oxaliplatine 442 80,7 90,2
STADE II
FU/AF 909 80,6 + 3,0
NS
89,2 + 2,5
NS
FU/AF + oxaliplatine 549 83,6 91,7
100
100 100
FOLFOX4 FOLFOX4 + bévacizumab XELOX+ bévacizumab
100
Année
Mois Mois
Patients sans maladie (%)
(%)
(%)
Patients en vie (%)
Année
SSR
SSR SG
NSABP C-08
AVANT
SG
60
60 60
60
20
20 20
20
80
80 80
80
40
40 40
40
0
0 0
0
0 02 24 41 1
mFF6 : 1 338 patients, 375 événements
mFF6 + bévacizumab : 1 335 patients, 368 événements
FOLFOX4
(n = 95) FOLFOX4
+ bévacizumab
(n = 960)
XELOX
+ bévacizumab
(n = 952)
HR
(IC95)1,17
(0,98-1,39) 1,07
(0,90-1,28)
mFF6 : 1 341 patients, 224 décès
mFF6 + bévacizumab : 1 337 patients, 218 décès
HR = 0,93 ; IC95 : 0,81-1,08 ; p = 0,34 HR = 0,96 ; IC95 : 0,79-1,15 ; p = 0,64
3 35
66 66
5
FOLFOX4
(n = 955) FOLFOX4
+ bévacizumab
(n = 960)
XELOX
+ bévacizumab
(n = 952)
Événements HR
(IC95)115 (12 %) 151 (16 %)
1,31
(1,03-1,67)
145 (15 %)
1,27
(0,99-1,62)
HGE 2(XV) MARS AVRIL 2012.indd 107 04/05/12 15:26

108 | La Lettre de l’Hépato-gastroentérologue • Vol. XV - n° 2 - mars-avril 2012
Cancer colorectal : nouveautés
DOSSIER THÉMATIQUE
XXIIIe Journée scientifique
FFCD-PRODIGE
➤
Ces résultats doivent nous inciter à la plus
grande prudence dans nos indications de chimio-
thérapie adjuvante des cancers du côlon de stade II
car la neurotoxicité dose cumulée à l’oxaliplatine
est, elle, quasi constante.
Traitements adjuvants
des cancers du rectum
➤
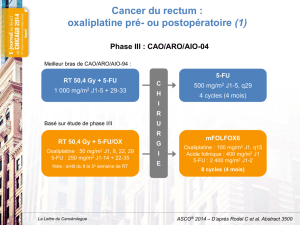
Le bénéfice de l’oxaliplatine associé à une
radiochimiothérapie préopératoire (50,4 Gy +
5FU) apparaît peu probable et augmente la toxicité
digestive (1, 2). Les résultats de l’essai NSABP R-04
(ASCO® 2011, abstract 3503) plaident en ce sens.
Les réponses complètes (RC) qui constituaient
l’objectif principal n’étaient pas différentes (21 %
versus 19 % ; p = 0,46). Les taux de préservation
sphinctérienne, de réduction tumorale étaient
également similaires. La toxicité digestive était
en revanche majorée (15 % versus 7 % de diarrhée
de grade 3-4 ; p = 0,0001). Les résultats de l’essai
allemand CAO/ARO/AIO-04, également présentés
à l’ASCO® 2011 (abstract LBA3505), plaident,
au contraire, pour un bénéfice, en termes de RC,
de l’ajout de l’oxaliplatine au 5FU et à la radio-
thérapie concomitante (16 % versus 13 % ;
p = 0,045). Ces résultats ne permettent cepen-
dant pas d’emporter la conviction car la RC n’était
pas l’objectif principal de cet essai (SSP à 3 ans),
et, curieusement, la toxicité digestive n’était pas
majorée (tableau II). Les résultats concordants des
3 premiers essais cités (ACCORD 12, STAR-01 et
NSABP R-04) ne doivent actuellement pas inciter à
l’utilisation de l’oxaliplatine dans cette indication.
➤
L’analyse exploratoire de l’essai NSABP
R-04 a, par ailleurs, montré qu’il n’y avait pas
de différence entre le 5FU et la capécitabine,
associés à la radiothérapie en termes de RC, de
préservation sphinctérienne et de toxicité diges-
tive (tableau III). La capécitabine peut donc
remplacer favorablement le 5FU associé à la radio-
thérapie néo-adjuvante des cancers du rectum
(ASCO® 2011, abstract 3503).
➤
L’analyse poolée des données de survie de
l’essai FFCD 9203 et EORTC 22921 a été présentée
par F. Bonnetain à l’ASCO® 2011 (abstract 3506).
Elle suggère qu’en dehors du meilleur contrôle
local démontré indépendamment dans ces 2 essais,
la radiochimiothérapie néo-adjuvante n’améliore
pas le pronostic des patients atteints d’un cancer
du rectum de stade T3 ou T4. La SSP à 3 ans était
de 64,3 % dans le groupe radiochimiothérapie néo-
adjuvante et de 60,6 % dans le groupe radiothérapie
seule (p = 0,49) [tableau IV].
Tableau II. L’oxaliplatine associé à la radiochimiothérapie néo-adjuvante des cancers du rectum : résultats des essais NSABP R-04 et CAO/ARO/AIO-04.
Études NSABP R-04 CAO/ARO/AIO-04
Oxaliplatine
(%)
Sans
oxaliplatine (%) pOxaliplatine
(%)
Sans oxaliplatine
(%) p
pRC 21 19 0,46 pRC 16 13 0,045
Préservation sphinctérienne 60 64 0,28 ypT0 18 13 0,48
Réduction tumorale 19 23 0,48 Préservation sphinctérienne 69 71 NS
Diarrhée de grade 3-4 15 7 0,0001 Diarrhée de grade 3-4 812 –
Tableau III. Équivalence de la capécitabine et du 5FU en traitement néo-adjuvant du cancer du
rectum : résultats de l’essai NSABP R-04.
5FU
(%)
Capécitabine
(%) p
pRC 19 22 0,12
ypT0 61 63 0,56
Préservation sphinctérienne 21 23 0,62
Diarrhée de grade 3-4 11 11 0,86
Tableau IV. Analyse pronostique des essais FFCD 9203 et EORTC 22921 poolées.
RT-CT préopératoire
(%)
RT préopératoire
(%) p
pRC 11 4 < 0,0001
Contrôle local à 3ans 92,3 84,7 < 0,0001
SSP 3ans 64,3 60,6 0,49
Diarrhée de grade 3-4 66,3 65,9 0,66
HGE 2(XV) MARS AVRIL 2012.indd 108 04/05/12 15:26

Figure 2. Schéma de l’essai stratégique FFCD 2000-05 (côlon métastatique non résécable)
[coordinateur : M. Ducreux].
LV-5FU
simplifié
5FU
ou capécitabine
ou phase I
1re ligne
Phase III
n = 570
Objectif : SSP
R
FOLFOX6
FOLFIRI
2e ligne
FOLFIRI
FOLFOX6
Avec étude
biologique satellite
3e ligne
La Lettre de l’Hépato-gastroentérologue • Vol. XV - n° 2 - mars-avril 2012 | 109
DOSSIER THÉMATIQUE
Cancers colorectaux
métastatiques
➤
Les résultats actualisés de l’essai PRIME évaluant
le panitumumab en première ligne métastatique,
associé au FOLFOX4 dans la population des KRAS
sauvages ont été présentés à l’ASCO® (abstract
3510). Ils montrent un bénéfice en termes de
réponses objectives (57 % versus 48 % ; p = 0,02),
de SSP (10 mois versus 8,6 mois ; p = 0,01). Il n’y
avait cependant pas de bénéfice en survie globale
(23,9 mois versus 19,7 mois ; p = 0,17) mais 25 %
des patients du bras FOLFOX4 seul ont reçu après
la première ligne un anti-EGFR contre 13 % dans le
bras combiné (tableau V). Ces résultats ont permis
au panitumumab d’obtenir une AMM en première
ligne métastatique quand il est associé au schéma
FOLFOX4.
➤Chez les patients dont la maladie métastatique
n’est pas résécable, l’intérêt d’une chimiothérapie
de première ligne optimisée (associant de l’irino-
técan ou de l’oxaliplatine au 5FU ou à la capécita-
bine) reste débattu. Les résultats de l’essai FFCD
2000-05 (figure 2) ont été publiés au cours de
l’année 2011 (3). Ils montrent qu’une stratégie
d’optimisation d’emblée (traitement combiné)
n’apporte pas de bénéfice par rapport à une chimio-
thérapie d’intensité progressivement croissante
en cas d’échappement (traitement séquentiel).
La médiane de SSP après 2 lignes était en effet simi-
laire dans les 2 bras de traitement : respectivement
10,5 mois (traitement séquentiel) et 10,3 mois
(traitement combiné) [p = 0,61]. Six décès toxiques
sont survenus dans le bras “combiné”. La toxicité
hématologique et non hématologique de grade 3-4
était également majorée dans le bras “combiné”.
Il faut noter que, compte tenu des critères d’inclu-
sion, plus de 50 % des patients avaient un état
général altéré (OMS 1 ou 2) et que la quasi-totalité
d’entre eux avaient 2 ou plus de 2 organes envahis par
des métastases. Ces résultats, qui concordent avec
les données des essais FOCUS (4) et CAIRO (5),
incitent à ne pas proposer de chimiothérapie
d’emblée optimisée (oxaliplatine ou irinotécan)
chez des patients, âgés, dont l’état général est altéré,
qui sont polymétastatiques et dont le pronostic est,
par voie de conséquence, spontanément sombre. Ces
stratégies devront être réévaluées avec des chimio-
thérapies cytotoxiques associées aux thérapeutiques
ciblées qui n’étaient pas utilisées dans ces travaux.
➤Le statut KRAS est fortement prédictif de l’effi-
cacité des anti-EGFR dont le bénéfice n’est observé
que dans la population “non mutée” (KRAS sauvage).
Une analyse exploratoire des données poolées des
essais CRYSTAL et OPUS suggère cependant que la
mutation G13D de l’oncogène KRAS aurait un effet
pronostique défavorable mais ne serait pas prédic-
tive de non-réponse au cétuximab (ASCO® 2011,
abstract 3511). Dans ce sous-groupe de patients, les
taux de réponses objectives étaient de 40 % avec
l’association FOLFOX4 ou FOLFIRI + cétuximab et
de 22 % avec la chimiothérapie seule (p = 0,07).
Il n’y avait cependant pas d’amélioration du
pronostic des patients. Ces données doivent être
validées sur une plus large série, d’autant que Peeters
et al. ont rapporté à l’ESMO 2011 (abstract LBA33)
les résultats d’une analyse rétrospective de 3 essais
randomisés ayant évalué le panitumumab (PRIME,
20050185 et 20020408) avec des résultats néga-
tifs concernant la mutation G13D. L’association du
panitumumab avec le FOLFOX apparaissait même
délétère, comme dans l’ensemble du sous-groupe
de patients KRAS muté.
➤L’analyse de la cohorte ARIES de 2 032 patients
ayant reçu du bévacizumab associé à une chimio-
thérapie cytotoxique suggère que le rapport
Tableau V. Étude PRIME : panitumumab associé au FOLFOX4 en première ligne du cancer
colorectal métastatique.
KRAS sauvage (n = 656)
FOLFOX4 +
panitumumab (n=325)
FOLFOX4
(n=331) HR (IC95) p
RO (%) 57,0 48,0 1,47 (1,07-2,04) 0,02
SSP (mois) 10,0 8,6 0,80 (0,67-0,97) 0,01
SG (mois) 23,9 19,7 0,88 (0,73-1,06) 0,17
HGE 2(XV) MARS AVRIL 2012.indd 109 04/05/12 15:26

110 | La Lettre de l’Hépato-gastroentérologue • Vol. XV - n° 2 - mars-avril 2012
Cancer colorectal : nouveautés
DOSSIER THÉMATIQUE
XXIIIe Journée scientifi que
FFCD-PRODIGE
bénéfi ce/risque du bévacizumab persiste quel que
soit l’âge des patients, y compris pour ceux de plus de
80 ans, que ce soit en première ou en seconde ligne
(ASCO® 2011, abstract 3625). En analyse multivariée,
les patients de plus de 70 ans, traités en première
ligne métastatique, avaient cependant un risque de
mortalité accru, toutes causes de décès confondues,
mais leur SSP ne différait pas de celle des patients
de moins de 70 ans.
➤
L’afl ibercept, nouvel inhibiteur de l’angiogenèse
(VEGF-Trap) ciblant le VEGF-A, le VEGF-B et le PIGF,
a fait l’objet d’une évaluation en phase III, associé
au FOLFIRI (versus FOLFIRI seul) chez 1 226 patients
en échec d’une première ligne à base d’oxaliplatine.
Une stratifi cation était réalisée sur la délivrance
antérieure du bévacizumab (30 % des patients).
Les données de survie présentées au WCGC 2011
sont en faveur de l’association (réduction de 19 %
du risque relatif de décès (p = 0,003) et réduction de
24 % du risque relatif de progression, p < 0,0001).
Ce bénéfi ce s’observait dans tous les sous-groupes,
et en particulier, que les patients aient ou pas reçu
du bévacizumab en première ligne et quel que soit
leur état général (OMS 0, 1 ou 2). Un traitement
antérieur par bévacizumab n’augmentait pas la
toxicité qui était similaire à celle connue avec le
bévacizumab (ESMO 2011, abstract 6LBA). Cette
molécule se présente donc comme une nouvelle
thérapeutique ciblée anti-angiogénique effi cace
dans le cancer colorectal métastatique dont le
développement en première ligne est attendu.
➤
La résection de la tumeur primitive (non compli-
quée) en cas de métastases synchrones fait débat.
B.S. Lin et al. ont rapporté à l’ASCO® 2011 (abstract
3564) les résultats d’une large étude rétrospective
sur 12 239 patients. La résection de la tumeur primi-
tive, réalisée chez 76,6 % des patients, s’est révélée
être un critère pronostique. La survie globale chez
les patients “réséqués” était de 17 mois versus 8 mois
chez ceux qui ne l’étaient pas (p < 0,0001).
La survie relative était également améliorée :
18 mois versus 9 mois (p < 0,0001). En analyse
multivariée, après ajustement sur les principaux
facteurs pronostiques (âge, sexe, site de la tumeur
primitive, chirurgie des métastases et statut socio-
économique), la résection de la tumeur primitive
restait un critère pronostique majeur. Le bénéfi ce
était observé tant pour les cancers du côlon que
pour ceux du rectum. Ces données, déjà rappor-
tées dans des études de plus faible effectif, doivent
être validées en prospectif car il existe de nombreux
facteurs confondants non pris en compte dans ce
travail (différenciation tumorale, nombre d’organes
concernés, importance de l’envahissement hépatique
et caractère menaçant des métastases). Un essai de
phase III commence au sein du groupe PRODIGE.
Conclusion
Le traitement adjuvant des cancers du côlon n’a pas
évolué depuis l’avènement du FOLFOX4, qui reste le
schéma de référence pour les tumeurs de stade III.
Le bévacizumab n’apporte pas de bénéfi ce supplé-
mentaire. La radiochimiothérapie des cancers du
rectum a fait l’objet d’un certain nombre de mises au
point. Elle n’améliore pas le pronostic des patients.
Son rôle dans le contrôle local est confi rmé et ne
nécessite pas l’ajout d’oxaliplatine au 5FU qui semble
n’apporter que de la toxicité supplémentaire.
Après le cétuximab, le panitumumab fait la preuve
de son intérêt en première ligne dans les cancers
colorectaux métastatiques KRAS sauvage et a obtenu
une AMM associé à l’oxaliplatine.
La publication récente de l’essai stratégique
“FFCD 2000-05” rappelle que le 5FU seul a sa place
en première ligne des cancers colorectaux dans la
population des patients de pronostic spontané-
ment sombre (personnes âgées, métastases multi-
sites maladie non résécable, état général altéré).
Cette stratégie séquentielle doit être évaluée avec
les biothérapies. ■
1. Gérard JP, Azria D, Gourgou-Bourgade S et al. Compa-
rison of two neoadjuvant chemoradiotherapy regimens
for locally advanced rectal cancer: results of the phase III
trial ACCORD 12/0405-PRODIGE 2. J Clin Oncol 2010;28:
1638-44.
2. Aschele C, Cionini L, Lonardi S et al. Primary tumor
response to preoperative chemoradiation with or without
oxaliplatin in locally advanced rectal cancer: pathologic
results of the STAR-01 randomized phase III trial. J Clin Oncol
2011;29:2773-80.
3. Ducreux M, Malka D, Mediboure J et al. Sequential versus
combination chemotherapy for the treatment of advanced
colorectal cancer (FFCD 2000-05): an open-label, rando-
mised, phase 3 trial. Lancet Oncol 2011;12:1032-44.
4. Seymour MT, Maughan TS, Ledermann JA et al. Different
strategies of sequential and combination chemotherapy for
patients with poor-prognosis advanced colorectal cancer
(MRC FOCUS): a randomised controlled trial. Lancet 2007;
370:143-52.
5. Koopman M, Antonini NF, Douma J et al. Sequential
versus combination chemotherapy with capecitabine,
irinotecan, and oxaliplatin in advanced colorectal cancer
(CAIRO): a phase III randomised controlled trial. Lancet
2007;370:135-42.
Références bibliographiques
L’auteur déclare avoir un conflit
d’intérêts avec les laboratoires
Merck, Roche, Amgen, Novartis,
Chugai, Ipsen.
HGE 2(XV) MARS AVRIL 2012.indd 110 04/05/12 15:26
1
/
5
100%