Le bevacizumab (Avastin ) dans le traitement du cancer colorectal métastatique ®

Les progrès réalisés dans la connaissance de la biologie des tumeurs ont permis le développement de nouveaux traite-
ments. Le bevacizumab est un anticorps monoclonal humanisé recombinant dirigé contre le VEGF (vascular endothelial
growth factor) : il inhibe la liaison du VEGF à ses récepteurs situés à la surface des cellules endothéliales. La neutralisa-
tion de l’activité biologique du VEGF réduit la vascularisation des tumeurs, inhibant la croissance tumorale. Il a démontré
une importante activité antitumorale dans des modèles de cancers réalisés chez des souris nude porteuses de xénogreffes,
en particulier sur les cancers du côlon, du sein, du pancréas et de la prostate.
Sa tolérance et son efficacité dans le cancer colorectal métastatique en première ligne thérapeutique ont été évaluées
dans plusieurs études cliniques randomisées, combinant bevacizumab et une chimiothérapie à base de 5-FU-acide
folinique (AF) associée ou non à l’irinotécan.
Une étude randomisée de phase II évaluant le bevacizumab en association à une chimiothérapie 5-FU-AF chez 104 patients
avait suggéré qu’il augmentait significativement le taux de réponse objective (40 % versus 17 %) et la durée de sur-
vie sans progression (9 mois versus 5,2 mois) par rapport à la chimiothérapie seule (1).
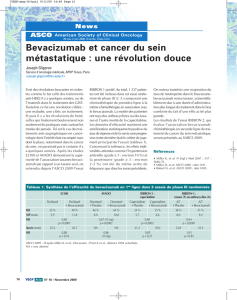
Dans un essai multicentrique de phase III en double aveugle, 813 malades étaient randomisés pour recevoir soit une
association 5-FU-AF-irinotécan (selon le schéma américain hebdomadaire IFL) et un placebo, soit la même chimio-
thérapie associée au bevacizumab (5 mg/kg i.v. toutes les deux semaines) (2). De plus, 110 patients ont reçu une asso-
ciation 5-FU-AF hebdomadaire et bevacizumab (bras interrompu conformément au protocole lorsque la tolérance de
l’association bevacizumab-IFL a été établie). L’efficacité du traitement dans le bras bevacizumab-IFL était significati-
vement supérieure à celle constatée dans le bras placebo-IFL. La survie médiane était augmentée de 30 % (20,3 mois
versus 15,6 mois ; p < 0,001), la survie sans progression de 70 % (10,6 mois versus 6,2 mois ; p < 0,001), et le taux
de réponse au traitement était de 44,8 % versus 34,8 % (p = 0,004).
Une autre étude de phase II randomisée en double aveugle a été menée chez 209 patients pour qui un traitement de
première ligne par irinotécan n’avait pu être retenu pour des motifs variés (âge, antécédents de radiothérapie pelvienne,
etc.) (3). Les patients recevaient une association 5-FU-AF + placebo ou bevacizumab. L’adjonction de bevacizumab
était associée à une prolongation significative de la survie sans progression (9,2 mois versus 5,5 mois), et à une pro-
longation de la survie globale, mais non significative dans cette étude aux effectifs moindres.
Le bevacizumab est indiqué en traitement de première ligne chez les patients atteints de cancer colorectal métastatique,
en association à une chimiothérapie intraveineuse par 5-FU et acide folinique avec ou sans irinotécan.
Il s’agit de flacons de 100 mg et 400 mg de bevacizumab à diluer avec une solution injectable de chlorure de sodium à
0,9 % jusqu’à un volume total de 100 ml. Les perfusions de bevacizumab ne doivent pas être administrées ou mélangées
avec des solutions de glucose (du fait d’une dégradation de la concentration). La dose recommandée est de 5 mg/kg
de poids corporel, administrée une fois tous les 14 jours en perfusion intraveineuse et sous surveillance médicale. La dose
initiale doit être administrée en 90 minutes ; si la première perfusion est bien tolérée, la deuxième perfusion peut
l’être en 60 minutes et, en cas de bonne tolérance, les perfusions ultérieures en 30 minutes. La dose initiale doit être
administrée après la chimiothérapie, les doses suivantes avant ou après la chimiothérapie.
Le profil de tolérance est fondé sur des données recueillies chez des patients atteints de cancer colorectal métastatique,
mais aussi de cancer du poumon, du sein ou de la prostate, qui ont reçu le bevacizumab en monothérapie ou associé
à une chimiothérapie. Les événements indésirables les plus fréquemment observés étaient une asthénie, une diarrhée
et des nausées. Les événements indésirables les plus graves étaient des perforations gastro-intestinales, des hémorragies,
des thromboembolies artérielles.
–Une perforation gastro-intestinale a été observée chez 1,4 % à 2,0 % des patients traités par bevacizumab pour
cancer colorectal métastatique. Le tableau clinique allait du pneumopéritoine de résolution spontanée sans traitement
à la perforation colique d’évolution fatale. La présence d’une inflammation intra-abdominale serait un facteur de risque
(ulcère gastrique, nécrose tumorale, diverticulite, etc.).
Le bevacizumab (Avastin®) dans le traitement
du cancer colorectal métastatique
B. Landi, L. Lamare, M. Bensoussan
Hôpital européen Georges-Pompidou, Paris
De quoi
s’agit-il ?
Bevacizumab et
cancer colorectal
métastatique
Intitulé de l’AMM
Présentation
Administration
Effets
indésirables
Fiche
Bevacizumab et cancer colorectal métastatique
N°34
Fiche
technique
La lettre de l’hépato-gastroentérologue - n° 5 - vol. VIII - septembre-octobre 2005 241

–Un saignement postopératoire ou des complications de la cicatrisation des plaies ont été observés chez 10 à 20 % des
patients ayant subi une intervention chirurgicale majeure alors qu’ils étaient traités par bevacizumab.
–Une hypertension artérielle, tous grades confondus, est survenue chez 22,4 à 32,0 % des patients traités par
bevacizumab pour cancer colorectal. Une hypertension artérielle justifiant un traitement antihypertenseur par voie
orale a été observée chez 11,0 à 16,0 % des patients traités par bevacizumab.
–Une protéinurie a été observée chez 23,3 % des patients, de grade 1 dans la majorité des cas, sans insuffisance
rénale. Sa physiopathogénie et son génie évolutif doivent encore être précisés.
–Une hémorragie liée au cancer colorectal a été observée chez 1 à 3 % des patients traités par bevacizumab, sans
augmentation significative de l’incidence des événements hémorragiques sévères par rapport au bras témoin. En
revanche, des hémorragies cutanéomuqueuses sont fréquentes, le plus souvent des épistaxis de grade 1.
–Au cours des essais cliniques dans le cancer colorectal métastatique, si l’incidence globale des événements thrombo-
emboliques a été comparable dans le groupe de patients traités par bevacizumab, l’incidence des événements thrombo-
emboliques artériels a été plus importante que dans le groupe témoin.
–Il est indispensable avant la prescription de préciser les antécédents cardiovasculaires ou hémorragiques et les
traitements associés (notamment antiagrégants ou anticoagulants). Le médicament est contre-indiqué en cas de méta-
stases cérébrales non traitées (risque hémorragique).
–La survenue d’une réaction à la perfusion est rare (< 3 %), et le pourcentage de réaction allergique sévère de
0,2 % seulement. Il n’est donc pas nécessaire d’administrer systématiquement une prémédication, mais une surveil-
lance clinique est indiquée.
–Le bevacizumab est susceptible d’altérer la cicatrisation des plaies. En pratique, le traitement ne doit pas être ins-
tauré pendant au moins 28 jours après une intervention chirurgicale lourde, ou tant que la plaie chirurgicale n’est pas
cicatrisée. Il doit être suspendu si une intervention chirurgicale est planifiée.
–La surveillance de la pression artérielle est recommandée avant le début et au cours du traitement. En cas d’hyper-
tension artérielle sévère nécessitant un traitement médical, il est nécessaire de suspendre le traitement jusqu’à l’obten-
tion d’un contrôle tensionnel adéquat.
–La surveillance de la protéinurie par analyse d’urine à la bandelette est recommandée avant le début du traitement
et au cours de celui-ci. Une protéinurie des 24 heures est réalisée si la bandelette est positive à deux croix. Si le traite-
ment doit être définitivement arrêté en cas de syndrome néphrotique, la conduite à tenir en cas de protéinurie moins
importante n’est pas encore bien déterminée. Actuellement, on interrompt provisoirement le traitement en cas de
protéinurie supérieure à 2 g/24h.
–Aucune adaptation de la dose n’est nécessaire chez le sujet âgé ; une majoration du risque d’événement thrombo-
embolique artériel au cours du traitement a toutefois été observée chez les patients de plus de 65 ans ou en cas d’anté-
cédents thromboemboliques.
–La tolérance et l’efficacité du bevacizumab n’ont pas été étudiées chez les patients insuffisants rénaux ou hépatiques.
Le bevacizumab dispose d’une AMM européenne depuis janvier 2005, est disponible à l’hôpital depuis avril, et inscrit
depuis juillet sur la liste des spécialités prises en charge en sus des prestations d’hospitalisation. Son efficacité, notam-
ment sur la survie, est indéniable. Cependant, peu de médecins ont encore l’expérience de sa prescription. Il convient
d’évaluer la transposabilité des données des essais à la pratique clinique (avis de la Commission de transparence). En
effet, le mode d’administration du 5-FU (en bolus) et de l’irinotécan dans le schéma IFL n’est ni optimal ni de pra-
tique courante en Europe. De plus, il serait logique de mieux définir les sous-groupes de patients en tirant le plus
bénéfice.
Des résultats présentés à l’ASCO de 2005 suggèrent que le bevacizumab augmente aussi l’efficacité d’une chimio-
thérapie de type FOLFOX dans un essai de deuxième ligne, des essais de première ligne étant en cours. Un autre
essai suggère son efficacité même à un stade plus tardif en association au cétuximab (Erbitux®) et à l’irinotécan. Enfin,
un essai randomisé en situation adjuvante en association au FOLFOX est en cours (essai AVANT).
1. Kabbinavar F, Hurwitz HI, Fehrenbacher L et al. Phase II, randomized trial comparing bevacizumab plus fluorouracil (FU)/leuco-
vorin (LV) with FU/LV alone in patients with metastatic colorectal cancer. J Clin Oncol 2003;21:60-5.
2. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal
cancer. N Engl J Med 2004;350:2335-42.
3. Kabbinavar FF, Schulz J, McCleod M et al. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic
colorectal cancer: results of a randomized phase II trial. J Clin Oncol 2005;23:3697-705.
Fiche
Bevacizumab et cancer colorectal métastatique
N°34
Précautions
d’emploi
Perspectives
dans le cancer
colorectal
Références
Fiche
technique
La lettre de l’hépato-gastroentérologue - n° 5 - vol. VIII - septembre-octobre 2005
242
1
/
2
100%