D Génétique et expression phénotypique des polyposes liées à APC et MUTYH

206 | La Lettre de l’Hépato-gastroentérologue • Vol. XVI - n° 5 - septembre-octobre 2013
DOSSIER
Polypose adénomateuse
familiale
Génétique et expression
phénotypique des polyposes
liées à APC et MUTYH
Familial adenomatous polyposis and MUTYH-associated
polyposis: genetics and phenotype
J.H. Lefèvre*
* Service de chirurgie générale et
digestive, hôpital Saint-Antoine
(AP-HP), université Pierre-et-Marie-
Curie, Paris.
D
ès 1721, la présence de très nombreux polypes
au niveau du côlon était identifiée comme
pathologique. La polypose adénomateuse
familiale (PAF) est caractérisée par l’apparition de
centaines, voire de milliers de polypes pendant
ou après l’adolescence, et représente un risque
de cancer colorectal majeur avant 50 ans. Cette
polypose colique peut être associée à d’autres
lésions, notamment des polypes du tube digestif
haut (à risque dégénératif), des tumeurs desmoïdes
et d’autres atteintes extra-intestinales à potentiel
malin ou non. En 2002, une autre forme géné-
tique partageant des similitudes cliniques, la MAP
(MUTYH-Associated Polyposis), a été décrite.
L’ensemble des atteintes définit le champ d’expres-
sion phénotypique de la polypose. Cette expression
est soumise à de nombreuses variations en termes
de sites atteints, de sévérité et de cancer associé.
Elle dépend partiellement de la génétique.
Génétique
Génétique de la PAF
La PAF est liée à une mutation constitutionnelle du
gène APC (1). Le gène APC, situé sur le chromosome 5,
est un gène suppresseur de tumeur de la catégorie
gatekeeper, c’est-à-dire régulant et bloquant le cycle
cellulaire. Constitué de 15 exons avec une séquence
de 8 532 paires de bases codant pour une protéine
de 2 843 acides aminés qui contribue, entre autres
fonctions, à la régulation de la prolifération cellulaire
et au maintien de l’apoptose à travers son interaction
avec la β-caténine. La PAF est de transmission auto-
somique dominante avec une pénétrance complète (la
présence de la mutation entraîne systématiquement
l’apparition du phénotype). Cette maladie explique
environ 1 % des cancers colorectaux. Le risque de
transmission à la descendance est de 50 %. Dans
10 à 30 % des cas, on observe une néomutation.
Des cas de néomutation en mosaïque ont également
été décrits et ne sont pas rares (20 % des néomuta-
tions) [2]. Leur mise en évidence repose sur l’analyse
génétique du tissu colique sain.
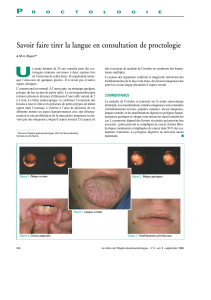
La perte de fonction de la protéine nécessite une
inactivation somatique (mutation ponctuelle, délé-
tion, etc.) du deuxième allèle (figure 1).
Apparition
des symptômes
de la maladie
2e événement
Mutation héritée présente dans
toutes les cellules de l’organisme
Mutation germinale
APC
APC
APC
Mutation somatique
Figure 1. Génétique de la polypose adénomateuse familiale.
HGE 5(XVI) SEPT OCT 2013.indd 206 22/10/13 11:45

La Lettre de l’Hépato-gastroentérologue • Vol. XVI - n° 5 - septembre-octobre 2013 | 207
Points forts
»
La polypose adénomateuse familiale (PAF) est liée au gène APC et de transmission autosomique dominante.
»
Le syndrome MAP
(MUTYH-Associated Polyposis)
est lié au gène MUTYH et de transmission autosomique
récessive.
»Le risque de cancer colorectal est de 100 % pour la PAF et très élevé pour le syndrome MAP.
»
Chez les patients colectomisés, les tumeurs duodénales et les tumeurs desmoïdes dont devenues
les principales causes de mortalité.
Mots-clés
Polypose
adénomateuse
familiale
APC
MUTYH
Cancer colorectal
Highlights
»
Familial adenomatous polyp-
osis (FAP) is caused by the APC
gene and is inherited as an
autosomal dominant disease.
»
The MUTYH-Associated
Polyposis (MAP) syndrome is
caused by the MUTYH gene and
is inherited as an autosomal
recessive disease.
»
The colorectal cancer risk is
100% for FAP and very high for
MAP syndrome.
»
In patients undergoing colec-
tomy, duodenal and desmoid
tumors are the main cause of
mortality.
Keywords
Familial adenomatous
polyposis (FAP)
APC
MUTYH
Colorectal cancer
Génétique de la MAP
En 2002, N. Al-Tassan et son équipe rapportent le cas
d’une famille anglaise où 3 enfants sur 7 présentaient
des polypes nombreux et des cancers colorectaux tous
découverts avant 50 ans (3). Les parents ne présen-
taient aucun antécédent de cancer. Tout le gène APC
fut séquencé sans qu’aucune mutation congénitale
soit retrouvée, mais il existait 18 mutations acquises,
dont 15 (83 %) étaient des transversions (remplace-
ment d’un doublet G:C par un doublet T:A). Dans ces
tumeurs, les mutations bialléliques retrouvées inac-
tivaient la protéine APC. Cette découverte conduisit
l’équipe à étudier les 3 gènes du système BER impli-
qués dans la réparation des lésions induites par la
7,8-dihydro-8-oxoguanine (8-oxoG) et conduisant
à des transversions G:C→T:A. Seul le gène MUTYH
(GeneID : 4595) présentait des mutations congénitales :
Tyr165Cys et Gly382Asp. Chaque enfant malade était
hétérozygote composite. Tous les autres membres
sains de la famille présentaient une absence de muta-
tion ou étaient hétérozygotes pour une des mutations.
La protéine MUTYH, codée par le gène MUTYH, est
une ADN glycosylase du système de réparation par
excision de bases (Base Excision Repair [BER]) qui joue
un rôle majeur dans la réparation des lésions oxyda-
tives de l’ADN. La 8-oxoG est une lésion oxydative
fréquente de l’ADN qui peut être causée au cours
du métabolisme cellulaire normal ou à la suite d’un
stress oxydant environnemental.
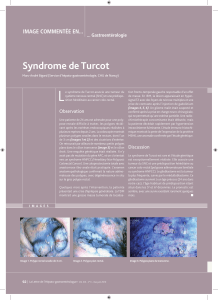
Le syndrome MAP est de transmission autosomique
récessive avec mutation biallélique des allèles de
MUTYH à la naissance (figure 2). L’absence d’activité
de MUTYH entraîne l’accumulation de transversion
G:C→T:A sur le gène APC, notamment au niveau
des séquences GAA, ce qui conduit à un codon stop.
Ce sont ces transversions qui vont finir par inac-
tiver somatiquement APC, entraînant l’apparition
de polypes puis d’un cancer colique.
Les mutations les plus fréquemment observées dans
la littérature sont Y165C et G382D (nouvellement
dénommées Y179C et G396D). Ces mutations ont
une fréquence d’environ 1 % dans les populations
caucasiennes et représentent environ 70 % des
patients ayant un syndrome MAP. Récemment, sous
l’égide de l’Institut national du cancer (INCa), une
expertise très complète a été publiée (4).
La fréquence des mutations varie en fonction des
origines géographiques des patients : E480X est
fréquente chez les patients indiens, la mutation
c.1227_1228dup (p.Glu396-GlyfsX43) est très
souvent retrouvée chez les patients provenant
d’Afrique du Nord (5). Dans la population géné-
rale, 2 % des personnes seraient porteuses d’une
mutation monoallélique du gène MUTYH, et 0,01
à 0,02 %, d’une mutation biallélique.
Conseil génétique
Le diagnostic de la polypose adénomateuse est
clinique et endoscopique. La recherche de muta-
tions constitutionnelles sur le gène APC ou MUTYH
sera obligatoirement faite au cours d’une consul-
tation d’oncogénétique dédiée et sera utile pour
confirmer l’implication d’un gène dans la pathologie
du patient, surtout en cas de forme atypique (atté-
nuée, sans antécédents familiaux ni signes extra-
digestifs). Dans les formes typiques de PAF, le taux
de détection de mutation sur APC est de l’ordre de
90 %. La fréquence des mutations bialléliques du
gène MUTYH est évaluée entre 14 et 25 % chez les
patients atteints d’une polypose adénomateuse non
liée à APC, mais variable en fonction de la sévérité
de la polypose.
Accumulation d’erreurs sur
d’autres gènes dans certaines
cellules et principalement
APC et K-ras...
Système BER
déficient
Polypes coliques
nombreux
Cancer
Mutation biallélique héritée présente
dans toutes les cellules de l’organisme
Mutation germinale
MUTYH
Mutation somatique
Figure 2. Génétique du syndrome MAP (MUTYH-Associated Polyposis).
HGE 5(XVI) SEPT OCT 2013.indd 207 22/10/13 11:45

208 | La Lettre de l’Hépato-gastroentérologue • Vol. XVI - n° 5 - septembre-octobre 2013
Génétique et expression phénotypique des polyposes liées à APC et MUTYH
DOSSIER
Polypose adénomateuse
familiale
Selon le mode de transmission, le conseil génétique
est très différent :
➤
PAF : le risque est de 50 % pour la fratrie et pour
les enfants. Le test génétique est proposé à tous les
apparentés du premier degré à partir de l’âge de 11 à
12 ans, car, pour les sujets porteurs, la surveillance
est recommandée à partir de cet âge.
➤
MAP : le risque est de 25 % pour la fratrie ; il
est très faible pour la descendance (sauf en cas de
consanguinité). Le test génétique est proposé en
premier lieu à la fratrie du sujet atteint et, plus géné-
ralement, à tous les apparentés du premier degré
dès lors qu’ils sont majeurs (car il n’y a pas de risque
de développer une polypose dans l’enfance). Les
seuls apparentés exclus de la surveillance de type
“risque élevé” sont ceux pour lesquels on sait avec
certitude, à l’issue du test génétique, qu’ils ne sont
pas porteurs bialléliques des mutations délétères
identifiées dans leur famille. Le risque de cancer
colorectal pour les enfants d’un patient porteur
d’une mutation biallélique est équivalent à celui
d’un individu ayant un antécédent de cancer dans
sa famille au premier degré.
Pour la PAF, on peut également orienter les patients
désireux d’avoir des enfants indemnes vers les tech-
niques de diagnostic prénatal ou préimplantatoire.
Expression phénotypique
de la PAF
Polypose
◆Épidémiologie et histoire naturelle
Polypes coliques
Sur le plan endoscopique, la PAF classique se traduit
par l’apparition de centaines voire de milliers de
polypes adénomateux dans le côlon et le rectum
pendant ou après l’adolescence. Son expression est
très variable d’une mutation à l’autre, mais égale-
ment d’un individu portant la même mutation à
l’autre. Cette expression phénotypique est un critère
déterminant dans la décision chirurgicale.
Le nombre de polypes a été identifié comme un
facteur prédictif de survenue de cancer ; on consi-
dère actuellement que le risque de cancer augmente
nettement lorsque le seuil de 1 000 polypes est
atteint (6). De même, le nombre de polypes rectaux
s’avère être un facteur de risque de cancer rectal.
Le risque de cancer colorectal lorsqu'il y a plus
de 30 polypes rectaux est 4,6 fois plus grand que
lorsqu'il y en a moins de 10. Mais l’inverse est aussi
vrai : un nombre de polypes rectaux inférieur à 5 est
associé à une maladie modérée et, donc, à un faible
risque de cancer rectal.
La taille des polypes doit aussi être prise en compte
dans l’appréciation de la sévérité de la maladie. Une
taille inférieure à 5 mm n’est associée qu’à un faible
risque de dégénérescence. Sur le plan histologique,
les polypes à risque sont, comme dans la population
générale, les polypes à composante villeuse et en
dysplasie de haut grade.
Cancer colorectal
Les registres européens montrent que le risque de
développer un cancer colorectal est très faible (1,3 %)
avant 20 ans et nul avant 10 ans (tableau) [7]. Ces
chiffres sont confirmés par une autre étude rétro-
spective nord-américaine portant sur 26 registres
mondiaux, qui a retrouvé 14 cas de patients âgés de
moins de 20 ans, dont 1 de moins de 10 ans, soit
1 cas pour 471 patients.
Lésion du tractus digestif supérieur
Les manifestations digestives extracoliques sont
dominées par l’atteinte du tube digestif haut, princi-
palement le duodénum et l’ampoule de Vater. Il
constitue le site extracolique avec le plus fort risque
de cancer ; le risque de développer un adénocarci-
nome du duodénum ou de l’ampoule de Vater est,
Tableau. Proportion de patients atteints de PAF présentant un cancer colorectal avant l’âge de 20 ans.
Registre Nombre Nombre de cancers colorectaux
0-10 ans 11-15 ans 16-20 ans
Pays-Bas 106 0 1 1
Danemark 190 0 0 3
Allemagne 524 0 1 7
St. Mark’s Hospital 96 0 0 3
Finlande 157 0 0 1
Total 1 073 02 (0,2 %) 15 (1,3 %)
HGE 5(XVI) SEPT OCT 2013.indd 208 22/10/13 11:45

La Lettre de l’Hépato-gastroentérologue • Vol. XVI - n° 5 - septembre-octobre 2013 | 209
DOSSIER
selon les estimations, 130 à 300 fois plus élevé chez
les personnes atteintes de PAF que dans la popula-
tion générale (8).
◆Polypose duodénale et périampullaire
La polypose duodénale touche plus de 90 % des
patients porteurs de PAF (8). L’âge moyen de décou-
verte d’un cancer du duodénum est de 52 ans. Les
polypes se développent préférentiellement, par
ordre croissant, au niveau de l’ampoule de Vater, du
duodénum proximal et distal et du jéjunum proximal.
Sur le plan endoscopique, les polypes duodénaux
apparaissent petits, plans ou sessiles ; la majorité
des lésions se situe dans les segments D2 et D3, et
épargne le bulbe duodénal avec une atteinte préfé-
rentielle de la zone périampullaire.
Une endoscopie avec vision latérale associée à une
coloration par indigo-carmin est l’examen de réfé-
rence pour le dépistage de ces polypes.
La gravité de l’atteinte duodénale est évaluée par
le score endoscopique et anatomopathologique de
Spigelman. Ce score prend en compte le nombre des
polypes, leurs tailles, leurs types histologiques et
leurs degrés de dysplasie (9). Il comprend 5 stades
allant de 0 à 4, les stades 0 à 2 définissant une
polypose modérée et les stades 3 et 4, une polypose
duodénale sévère.
Plusieurs études ont montré qu’il y avait une aggra-
vation de la polypose duodénale avec le temps.
Cette progression est loin d’être systématique, et
de nombreux cas de stabilité prolongée, voire d’amé-
lioration spontanée des lésions duodénales, ont
été rapportés. Enfin, la classification de Spigelman
semble être un outil peu sensible, ne permettant pas
de dépister l’ensemble des carcinomes duodénaux.
F. Caillié et al. rapportent une série de 19 duodéno-
pancréatectomies céphaliques avec préservation
pylorique pour polypose duodénale sévère. L’examen
histologique définitif retrouvait 7 carcinomes invasifs
dont un seul avait été diagnostiqué avant l’opéra-
tion, c’est-à-dire que 32 % des malades opérés sans
néoplasie diagnostiquée avant l’opération présen-
taient a posteriori un cancer (10). Cela doit être pris en
compte dans la surveillance et le choix thérapeutique.
Le risque cumulé de transformations carcinomateuses
reste cependant limité, de l’ordre de 4 à 10 % à 75 ans.
◆Dystrophie glandulokystique et adénomes
de l’estomac
L’estomac est fréquemment le siège d’une poly-
pose glandulokystique, qui atteint près de 50 % des
patients atteints de polypose. Elle prédomine dans le
fundus et se présente sous la forme de polypes de 1 à
5 mm de diamètre, semi-sessiles, de la même couleur
que la muqueuse gastrique. Histologiquement, ils
correspondent à une dilatation kystique de la glande
fundique sans dysplasie (11). Bien que quelques cas
de dysplasie et cancer aient été décrits, on ne consi-
dère pas que la polypose glandulo kystique présente
un risque de dégénérescence.
L’estomac peut aussi être le siège d’adénomes.
Ceux-ci prédominent dans l’antre et touchent
7 à 14 % des cas (11). L’histoire naturelle de ces
adénomes n’est pas bien connue, mais le risque
d’adénocarcinome de l’antre dans les popula-
tions occidentales ne semble pas plus élevé : seuls
quelques cas ont été rapportés (11).
◆Atteinte de l’intestin grêle
Des polypes jéjunaux et iléaux sont présents dans
30 à 60 % des cas. Ces polypes sont générale-
ment infracentimétriques, et prédominent dans le
jéjunum. L’anatomopathologie de ces polypes n’est
pas connue et peut correspondre à des hyperplasies
lymphoïdes folliculaires plus qu’à des adénomes. Les
adénocarcinomes du jéjunum restent rarissimes. En
revanche, des polypes iléaux sont observés après
chirurgie colique prophylactique.
Après coloproctectomie et anastomose iléoanale
Après anastomose iléoanale (AIA), le risque de
développer des polypes du réservoir iléal est de
75 % des cas à 15 ans. Dans une série prospective
de 33 patients colectomisés pour PAF, Thompson-
Fawcett et al. ont montré que 33 % des patients
sans polypes macroscopiques présentaient des
microadénomes sur des biopsies réalisées de façon
systématique (12).
Le risque de développer un adénocarcinome dans
le réservoir reste cependant très faible : très peu de
cas sont rapportés dans la littérature. De plus, dans
la majorité d'entre eux, il est difficile de distinguer
les adénocarcinomes développés sur les adénomes
récurrents du réservoir, ceux de la zone transition-
nelle au niveau de l’anastomose et ceux qui se
développent sur la muqueuse rectale restante. Il
n’existe pas de recommandation concernant la
place de la surveillance de l’intestin grêle chez les
patients porteurs de PAF avant et après une colec-
tomie totale.
Après colectomie totale et anastomose iléorectale
L’incidence des adénomes iléaux dans l’anse affé-
rente a peu été étudiée. C.J. Groves et al. (13) ont
retrouvé 2 % d’adénomes iléaux en amont d’une
anastomose iléorectale et 5 % de microadénomes
HGE 5(XVI) SEPT OCT 2013.indd 209 22/10/13 11:45

210 | La Lettre de l’Hépato-gastroentérologue • Vol. XVI - n° 5 - septembre-octobre 2013
Génétique et expression phénotypique des polyposes liées à APC et MUTYH
DOSSIER
Polypose adénomateuse
familiale
sur des biopsies iléales aléatoires. Il est probable
qu’une partie de ces polypes appartiennent en fait
au rectum.
Tumeurs desmoïdes
Les tumeurs desmoïdes touchent 10 à 25 % des
patients atteints de PAF (14). Dans une étude menée
par la Cleveland Clinic, sur 132 patients atteint de
PAF et décédés, elles représentaient la deuxième
cause de mortalité tous patients confondus (11 %)
et la première cause de mortalité chez ceux ayant
subi une coloproctectomie totale et une AIA.
L’origine exacte de ces tumeurs – néoplasie ou
processus réactionnel – a longtemps été contro-
versée. En effet, il s’agit d’une tumeur ne métas-
tasant jamais, dont la croissance est très variable
d’un cas à l’autre. Certaines sont stables, d’autres
régressent, et certaines progressent rapidement. En
revanche, elles ne présentent pas de vraie capsule,
envahissent et compriment les organes voisins et
récidivent dans près de 50 % des cas. Sur le plan
histologique, elles correspondent à une proliféra-
tion de fibroblastes matures, ou myofibroblastes,
avec peu de mitoses et aucune atypie cellulaire.
Enfin, il a été démontré que ces tumeurs n’expri-
maient pas la télomérase, ce qui constitue un
argument de plus en faveur d’un processus non
néoplasique (la télomérase étant exprimée par les
cellules cancéreuses et les cellules souches).
Il était donc difficile de classer ces tumeurs. Mais
2 études récentes ont démontré que les tumeurs
desmoïdes ont une origine monoclonale et sont
donc, par définition, de vrais néoplasmes (14).
Enfin, des précurseurs de ces lésions ont été mis en
évidence, qui passent par plusieurs stades avant de
devenir une tumeur mature mimant la physiopatho-
logie du cancer du côlon.
Sur le plan clinique, les tumeurs desmoïdes touchent
préférentiellement la paroi antérieure abdominale
et la cavité péritonéale. Elles surviennent tôt dans
l’histoire du malade : l’âge médian au diagnostic est
de 31 ans (14).
Une étude rétrospective européenne s’est inté-
ressée aux facteurs de risque de tumeur desmoïde ;
elle a inclus les registres de 5 pays et portait sur
387 patients présentant une tumeur desmoïde.
En analyse multivariée, 3 facteurs indépendants
de risque de développer une tumeur desmoïde
ressortaient : une histoire familiale de tumeur
desmoïde, la chirurgie et le site de la mutation
(au-delà du codon 1444=extrémité 3′) [14].
L’évolution de ces lésions est très variable :
10 % régressent spontanément, 50 % restent stables,
30 % ont des cycles de croissance et décroissance
et 10 % progressent rapidement.
Autres affections de la PAF
◆Thyroïde
Le troisième cancer le plus fréquent chez les patients
ayant une PAF est le cancer de la thyroïde. Le risque
d’atteinte thyroïdienne est évalué à 2 à 3 % durant
la vie (7). Il touche davantage les femmes (ratio
femmes-hommes : 17:1) et apparaît plus généra-
lement durant la deuxième ou troisième décennie
(entre 20 et 30 ans). Le type histologique est le
carcinome papillaire, et le pronostic est identique
à celui de la population générale. Certains auteurs
recommandent de dépister les cancers de la thyroïde
chez les femmes atteintes de PAF par un examen
clinique annuel associé ou non à une échographie.
◆Foie
Les hépatoblastomes ont une prévalence atteignant
1 % des patients ayant une PAF, touchant préféren-
tiellement les garçons et survenant dans la majorité
des cas entre 6 mois et 3 ans. Ils se présentent géné-
ralement sous la forme d’une masse abdominale
et d’une altération de l’état général. Le diagnostic
est confirmé par le taux élevé d’α-fœtoprotéine. Le
pronostic très sombre est principalement corrélé au
caractère complet de l’exérèse initiale. L’associa-
tion d’une chimiothérapie néo-adjuvante (le plus
souvent par cisplatine et doxorubicine) a permis
d’améliorer la prise en charge des hépatoblastomes
en rendant résécables des lésions qui ne l’étaient pas
initialement. Malgré cela, 25 % des enfants touchés
décèdent. Certains auteurs préconisent un dépis-
tage pour les enfants de familles atteintes de PAF,
avec imagerie et dosage de l’α-fœtoprotéine tous
les 3 mois durant les 4 premières années de vie.
◆Système nerveux central
L’atteinte du système nerveux central (SNC) dans
la polypose est historiquement connue sous le nom
de syndrome de Turcot. Il faut préciser que l’atteinte
du SNC s’observe aussi dans le syndrome de Lynch
(HNPCC) et diffère des lésions observées dans la
PAF. L’atteinte du SNC est principalement repré-
sentée par les médulloblastomes, qui correspondent
à 80 % des tumeurs cérébrales rencontrées dans la
PAF. Des astrocytomes et des épendymomes ont
aussi été décrits.
HGE 5(XVI) SEPT OCT 2013.indd 210 22/10/13 11:45
 6
6
 7
7
1
/
7
100%