L Naissance prématurée : évolution et prise en charge respiratoire après la période

La Lettre du Pneumologue • Vol. XIII - n° 2 - mars-avril 2010 | 53
MISE AU POINT
Naissance prématurée :
évolution et prise en charge
respiratoire après la période
néonatale
Patient born preterm: respiratory evolution and care after
the neonatal period
S. Blanchon*
* Service de pneumologie pédiatrique ;
centre de référence des maladies
respiratoires rares, hôpital Armand-
Trousseau, Paris.
L
e taux de prématurité est en constante augmen-
tation. Le suivi de grandes cohortes a permis
d’améliorer la connaissance et la prise en charge
des patients nés prématurés. En France, l’étude de la
cohorte EPIPAGE, qui a suivi principalement l’évolu-
tion neurologique, a eu un fort retentissement dans
la communauté médicale, mais également auprès
du grand public. L’évolution pulmonaire, bien que
déterminante dans la mortalité et la morbidité à
court, moyen et long termes, est moins bien connue.
Physiologie, définitions,
épidémiologie
Le poumon est, avec le cerveau, l’organe dont la
maturation est la plus tardive. L’organogenèse
pulmonaire se développe principalement au troi-
sième trimestre de grossesse et se poursuit plusieurs
années après la naissance. Le poumon est fonctionnel
à partir du développement des premières barrières
alvéolo-capillaires, à 23-25 semaines d’aménorrhée
(SA). Les premières alvéoles apparaissent à 30-32 SA,
mais leur multiplication se poursuit jusqu’à l’âge
de 18 à 24 mois, et la surface d’échange gazeux
augmente jusqu’à l’âge adulte. Les complications
d’une naissance prématurée sont donc largement
représentées par les pathologies pulmonaires. En
période néonatale, les conséquences respiratoires
d’une naissance prématurée sont une immaturité
de l’ensemble de la fonction respiratoire (voies
aériennes supérieures, poumon, système cardio-
vasculaire, système neurologique et musculaire) et
une sensibilité accrue aux agressions. Les réponses
physiologiques, notamment inflammatoires, à ces
agressions sont autant de nouvelles agressions
pulmonaires. Après la période néonatale, une inflam-
mation pulmonaire chronique autoentretenue et une
alvéolisation, qui se poursuit dans un contexte de
contrainte non physiologique de ventilation et de
perfusion, persistent. La sévérité de l’atteinte pulmo-
naire dépend de nombreux facteurs : susceptibilité
génétique, degré de prématurité, existence d’une
complication néonatale pulmonaire (maladie des
membranes hyalines, infection) ou extrapulmonaire
(sepsis, canal artériel persistant, cardiopathie, etc.),
présence d’une malformation pulmonaire congé-
nitale (hypoplasie, hernie diaphragmatique, etc.),
lésions iatrogènes dues à la ventilation mécanique
et à l’oxygénothérapie, et état nutritionnel. Cette
atteinte pulmonaire peut évoluer vers une absence
totale de symptôme ou vers une dysplasie broncho-
pulmonaire (DBP) de sévérité variable.
La DBP a été décrite en 1967 par Northway et al.
comme une conséquence de l’oxygénothérapie et de
la ventilation assistée chez les enfants prématurés
atteints de maladie des membranes hyalines (1).
Sur le plan histologique, le poumon se caractérisait
alors par des anomalies structurales des bronches
terminales, une musculeuse épaissie, un paren-
chyme hétérogène associant zones d’emphysème,
de comblement alvéolaire et de fibrose. Grâce aux

54 | La Lettre du Pneumologue • Vol. XIII - n° 2 - mars-avril 2010
Points forts
»La sévérité initiale de la dysplasie bronchopulmonaire (DBP) [déterminée par les besoins en oxygène à
36 semaines d’aménorrhée (SA) pour une naissance avant 32 SA, ou à 56 jours pour une naissance à partir
de 32 SA] est un bon reflet de l’évolution à moyen et long termes.
»
Les 2 premières années, notamment l’hiver, sont à haut risque de décompensations sévères, le plus
souvent d’origine infectieuse. La pathogénie inclut l’œdème pulmonaire, l’hyperréactivité bronchique et
l’hypertension artérielle pulmonaire (HTAP).
»
L’évolution à long terme est satisfaisante. Un asthme à l’âge adulte persistera dans les cas les plus sévères.
»
La prise en charge de la DBP associe une éviction des facteurs aggravants, une immunothérapie anti-VRS,
une oxygénothérapie, des diurétiques, des bronchodilatateurs et une corticothérapie, qui doit être limitée
aux doses minimales efficaces.
Mots-clés
Œdème pulmonaire
Hyperréactivité
bronchique
HTAP
Décompensations
infectieuses
Corticothérapie
Highlights
»
The initial severity of
bronchopulmonary dysplasia
(BPD) [defined as the level
of oxygen requirement at 36
weeks gestational age if born
before 32 weeks, or at 56 days
if born at/after 32 weeks] gives
a good prediction of long term
evolution.
»
The first 2 years, especially
in winter, are at high risk of
severe decompensation, usually
post infectious. The symptom-
atology includes the pulmonary
oedema, the bronchial hyper-
reactivity and the pulmonary
hypertension.
»
The long term evolution is
usually good. The most severe
patients will be asthmatic even
in adulthood.
»
The BPD care will need: evic-
tion of the aggravating factors,
anti-RSV immunotherapy,
oxygen therapy, diuretics,
bronchodilatators, corticoste-
roids that need to be used at
minimal dose.
Keywords
Pulmonary oedema
Bronchial hyperreactivity
Pulmonary hypertension
Infectious decompensations
Corticosteroid
progrès thérapeutiques (surfactant exogène, corti-
cothérapie) et à une diminution de la iatrogénie
(amélioration des techniques de ventilation, limi-
tation de l’oxygénothérapie), des enfants de plus
en plus prématurés et hypotrophes survivent, et les
lésions pulmonaires sont modifiées. Depuis 1998
est décrite la “nouvelle DBP” caractérisée par la
prédominance de l’atteinte alvéolaire (alvéoles
moins nombreuses et plus grandes par défaut de
septation, développement moindre du lit capillaire
alvéolaire) et par la diminution de l’atteinte des voies
aériennes (2). La DBP se définit aujourd’hui par une
oxygénodépendance à 28 jours de vie. Sa sévérité est
définie par le niveau d’oxygénodépendance à 36 SA
pour une naissance avant 32 SA, ou à 56 jours de vie
pour une naissance à partir de 32 SA (tableau I) [3].
Cette définition fondée uniquement sur la durée
d’oxygénothérapie est critiquable, mais le niveau
de sévérité est un bon reflet de l’évolution à moyen
et long termes.
En France, l’incidence de la prématurité (naissance
avant 37 SA) et de la grande prématurité (nais-
sance avant 32 SA) est en constante augmenta-
tion : respectivement 4,8 % et 1,0 % en 1998,
7,2 et 1,8 % en 2003. Environ 55 000 enfants naissent
prématurément chaque année en France. Le taux de
DBP reste étroitement lié au degré de prématurité :
67 % des enfants pour un poids de naissance (PN)
inferieur à 750g, 30% pour un PN allant de 750 g
à 1 200 g, 1 % pour un PN compris entre 1 200 g
et 1 500 g (4). L’incidence de la DBP est globalement
stable, mais celle de la DBP sévère est en décrois-
sance (– 11 % par an entre 1994 et 2002 aux États-
Unis) [5].
Évolution
En l’absence de DBP ou en cas de DBP légère, l’évo-
lution à moyen et long termes est très favorable. Les
patients sont asymptomatiques, mais gardent une
susceptibilité aux infections et un risque accru de
décompensation éventuellement sévère. En cas de
DBP modérée à sévère, l’évolution à moyen et long
termes est marquée par une détresse respiratoire
chronique plus ou moins sévère, associant une part
de surcharge pulmonaire par œdème lésionnel et une
part de spasticité par hyperréactivité bronchique.
Cette symptomatologie chronique sera entrecoupée
de décompensations par poussées d’œdème pulmo-
naire, d’hypertension artérielle pulmonaire (HTAP)
ou de bronchospasme. D’une manière générale,
on peut considérer les 2 premières années de vie
(notamment les 2 premiers hivers) comme la période
à haut risque de décompensation aiguë. Durant ces
2 premières années, le taux d’hospitalisations est
d’environ 50 % pour les enfants nés prématurés
avec une DBP sévère, de 25 % pour les enfants nés
prématurés sans DBP et de 3 % pour les enfants
nés à terme sans DBP (tableau II) [6-8]. Le taux
d’hospitalisations est identique pour l’“ancienne” et
la “nouvelle” DBP (9). Les causes d’hospitalisations
avant l’âge de 2 ans des enfants nés prématurés sont
respiratoires dans 35 à 65 % des cas, principalement
d’origine infectieuse, avec présence du virus respi-
ratoire syncytial (VRS) dans 14 % des cas (10, 11).
L’état de ces patients s’améliorera progressivement,
notamment grâce à la fabrication régulière de paren-
chyme pulmonaire sain et à l’augmentation de la
surface d’échange gazeux dans les premières années
de vie. À long terme, le taux d’hospitalisations est
le même quel que soit le terme de naissance ou les
antécédents de DBP (12). Mais, plusieurs études
montrent qu’une hyperréactivité bronchique persiste
jusqu’à l’âge adulte chez les anciens prématurés,
notamment s’ils ont présenté une DBP : wheezing,
toux chronique, essoufflement, recours aux bron-
chodilatateurs (tableau III) [6, 12].
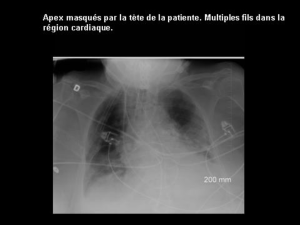
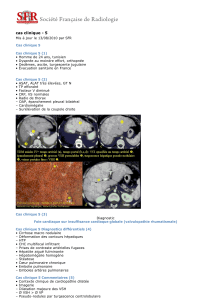
Sur le plan radiologique, la caractéristique principale
du poumon des enfants nés prématurés est l’hétérogé-
néité du parenchyme. Elle associe zones de distension
ou d’emphysème, zones d’atélectasies, opacités peu
systématisées et fibroses localisées (figures 1-3, p. 56).
Tableau I. Définition de la dysplasie bronchopulmonaire.
Oxygénodépendance à 28 jours de vie
ET
Âge gestationnel < 32 SA ≥ 32 SA
Point d’évaluation 36 SA 56 j de vie
DBP légère Air ambiant
DBP modérée Besoin O2 < 30 %
DBP sévère Besoin O2 ≥ 30 % ou pression positive
DBP : dysplasie bronchopulmonaire ; SA : semaine d’aménorrhée.

La Lettre du Pneumologue • Vol. XIII - n° 2 - mars-avril 2010 | 55
MISE AU POINT
Ces lésions s’améliorent progressivement, avec une
corrélation radiographie/clinique assez pauvre. Le
suivi radiologique est donc peu informatif en dehors
de la recherche de cause aiguë de décompensation. La
comparaison aux clichés antérieurs est indispensable
pour l’interprétation radiologique.
Sur le plan fonctionnel, le suivi est fondé sur la
pléthysmographie, la spirométrie et les épreuves
d’effort. La spirométrie utilise les techniques clas-
siques à partir de 5-7 ans, les techniques d’oscilla-
tions forcées et d’interruption de débit à partir de
3 ans et, éventuellement, la technique de compres-
sion thoraco-abdominale avant 3 ans. Les épreuves
d’effort sont pratiquées à partir de 5-7 ans et utilisent
principalement la consommation maximale d’oxy-
gène du corps par minute (VO
2max
) et le seuil venti-
latoire (mesure de l’aptitude aérobie du patient).
Ces mesures ayant l’avantage d’être reproductibles,
sont intéressantes pour le suivi. Elles permettent de
dépister des lésions minimes et d’évaluer le handicap
social et la qualité de vie. Les explorations fonction-
nelles respiratoires (EFR) des enfants nés prématurés
peuvent montrer un syndrome obstructif prédo-
minant en distal, une distension thoracique, une
diminution de la compliance, une hyperréactivité
bronchique parfois réversible et une baisse de la tolé-
rance à l’effort. La fonction respiratoire se normalise
progressivement avec l’âge, et les derniers critères
à se normaliser sont les débits distaux et le volume
résiduel (VR) [tableau IV].
En l’absence de DBP ou en cas d’antécédent de DBP
légère, la fonction respiratoire est normale à long
terme (6, 13). En cas d’antécédent de DBP modérée,
la fonction respiratoire à long terme est peu patholo-
Tableau II. Hospitalisations avant 2 ans.
Études
Gross, 1998 (6) Chien, 2002 (7) Smith, 2004 (8)
Population Pas de DBP
à terme
Pas de DBP
≤ 32 SA
DBP modérée
≤ 32 SA
Pas de DBP
< 1 000 g
DBP sévère
< 1 000 g
Pas de DBP
≤ 32 SA
DBP modérée
≤ 32 SA
Taux d’ hospitalisation à 1 an 309/1 359 (23 %) 118/238 (49 %)
Taux d’ hospitalisation à 2 ans 3/108 (3 %) 14/53 (26 %) 23/43 (53 %) 17/27 (63 %) 17/20 (85 %)
Tableau III. Évolution clinique.
Études
Gross,1998 (6) Vrijlandt, 2005 (12)
Âge 7 ans 19 ans
Population Terme de naissance ≤ 32 SA Terme de naissance ≤ 32 SA Terme de naissance ≤ 32 SA
et/ou PN ≤ 1 500 g
Terme de naissance ≤ 32SA
et/ou PN ≤ 1 500 g
Antécédent de DBP Non DBP modérée Non DBP modérée
Critères augmentés (p < 0,05)
par rapport aux patients nés
à terme et eutrophes
Wheezing
, toux chronique
Wheezing
, toux chronique,
pneumonie, utilisation de β2+
Wheezing
aigu, gêne à
l’effort, asthme
Wheezing
persistant,
wheezing
aigu - gêne à l’effort, asthme
PN : poids de naissance.
Tableau IV. Évolution des explorations fonctionnelles respiratoires.
Absence de DBP DBP légère DBP modérée DBP sévère
Études
Gross, 1998 (6) Koumbourlis, 1996 (13) Gross, 1998 (6) Doyle, 1996 (14) Halvorsen, 2004 (15) Robin, 2004 (16) Jacob, 1998 (17)
PN 1 179 g 1 100 g 1 173 g 1 000 g 887 g 900 g 1 100 g
Terme 28 SA 29 SA 28 SA 27 SA 27 SA 26,4 SA 28 SA
VM/O26 j/7 j 10 j/40 j 34 j/77 j 23 j/85 j 25 j/72 j 51 j/306 j 56 j/631 j
Âge à l’évaluation 7 ans 8 ans 15 ans 7 ans 11 ans 17,7 ans 5,6 ans 10 ans
CV 104 % 95 % 103 % 93% – 101 % 91 % 83 %
VEMS 98 % 98 % 97 % 83% 89 % 87 % 76 % 63 %
DEM25-75 84 % 73 % 77 % 66% 75 % 78 % 74 % 40 %
VR 130 % 125 % 113 % 133% 104 % 123 % 124 % 180 %
CV : capacité vitale ; DEM : débit expiratoire médian ; PN : poids de naissance ; VEMS : volume expiratoire maximal par seconde ; VM/O2 : durée de ventilation mécanique/
durée d’oxygénothérapie à la naissance ; VR : volume résiduel.

Figure 1. DBP sévère chez un enfant âgé de 1 an.
Figure 2. DBP sévère chez un enfant âgé de 2 ans.
Figure 3. DBP sévère chez un enfant âgé de 6 ans.
56 | La Lettre du Pneumologue • Vol. XIII - n° 2 - mars-avril 2010
Naissance prématurée : évolution et prise en charge
respiratoire après la période néonatale
MISE AU POINT
gique : volume expiratoire maximal par seconde (VEMS)
normal, diminution des débits distaux (DEM25-75 entre
66 et 75 % de la valeur théorique) et, éventuellement,
distension thoracique minime (VR entre 104 et 133 %
de la valeur théorique) [6, 14, 15]. Ces anomalies se
normalisent à l’âge adulte (15). En cas d’antécédent de
DBP sévère, la fonction respiratoire reste pathologique
à l’âge adulte, avec un syndrome obstructif impor-
tant (VEMS entre 63 et 76 % de la valeur théorique)
et une distension thoracique (VR entre 124,5 et 180 %
de la valeur théorique) [16, 17]. Les épreuves d’effort
montrent des atteintes fonctionnelles peu liées à la
sévérité initiale de la DBP, mais qui sont dans la majo-
rité des cas subnormales à l’âge scolaire (18).
Prise en charge
Les patients nés prématurés nécessitent une évaluation
clinique et fonctionnelle régulière. Certaines règles de
vie sont indispensables : éviction du tabac, mise en
collectivité après 6 mois, éviction des malades conta-
gieux de l’entourage, vaccinations antipneumococcique
et antigrippale. À chaque consultation, le médecin doit
rechercher, en complément de son examen pulmo-
naire, une hypertension artérielle (HTA), une patho-
logie ORL (amygdales volumineuses, infections ORL
récidivantes), des troubles de la déglutition, un reflux
gastro-œsophagien, des difficultés alimentaires qui
sont souvent les premiers signes d’une gêne respiratoire
et une limitation de l’activité physique. Il doit impérati-
vement évaluer la croissance (effets indésirables d’une
corticothérapie, dénutrition par difficultés alimentaires
et hypercatabolisme, résistance à la GH (hormone de
croissance) des enfants hypercapniques chroniques).
L’immunothérapie anti-VRS par palivizumab (Synagis®)
a vu ses indications restreintes récemment par la Haute
Autorité de santé (19). Elle est administrée en injection
intramusculaire de 15 mg/kg toutes les 4 semaines
d’octobre à février (5 injections au total). Les indica-
tions sont, en France :
– enfant né à 32 SA ou moins, âgé de moins de
6 mois au début de l’épidémie de VRS et présen-
tant une DBP ;
– enfant né à 32 SA ou moins, âgé de moins de 2 ans
au début de l’épidémie de VRS, présentant une DBP
ayant nécessité un traitement dans les 6 derniers
mois ;
– enfant âgé de moins de 2 ans au début de l’épi-
démie de VRS et présentant une cardiopathie congé-
nitale avec retentissement hémodynamique.
Les décompensations aiguës des patients nés préma-
turés, ayant ou non présenté une DBP, sont poten-
tiellement sévères et brutales, notamment pour les
nourrissons les plus jeunes. Elles sont le plus souvent
d’origine infectieuse, et nécessitent la réalisation
des examens suivants : bilan inflammatoire, bilan
microbiologique (recherche de virus et mycoplasme
sur sécrétions nasales, hémoculture en cas de fièvre,
etc.), gaz du sang ainsi que radiographie de thorax à
Références
bibliographiques
1.
Northway WH Jr, Rosan RC,
Porter DY. Pulmonary disease
following respirator therapy of
hyaline-membrane disease: bron-
chopulmonary dysplasia. N Engl
J Med 1967;276: 357-68.
2.
Hussain NAZ, Siddiqui
NH, Stocker JR. Pathology of
arrested acinar development
in postsurfactant bronchopul-
monary dysplasia. Hum Pathol
1998;29:710-7.
3.
Jobe AH, Bancalari E. Bron-
chopulmonary dysplasia.
Am J Respir Crit Care Med
2001;163:1723-72.
4.
Bancalari E, Claure N,
Sosenko IRS. Bronchopulmonary
dysplasia: changes in pathogen-
esis, epidemiology and definition.
Semin Neonatol 2003;8:63-71.
5.
Smith VC, Zupancic JA,
McCormick MC et al. Trends
in severe bronchopulmonary
dysplasia rates between 1994
and 2002. J Pediatr 2005;
146(4):469-73.
6.
Gross SJ, Iannuzzi DM, Kveselis
DA, Anbar RD. Effect of preterm
birth on pulmonary function
at school age: a prospective
controlled study. J Pediatr
1998;133(2):188-92.
7.
Chien YH, Tsao PN, Chou
HC, Tang JR, Tsou KI. Rehospi-
talization of extremely-low-
birth-weight infants in first
2 years of life. Early Hum Dev
2002;66(1):33-40.
8.
Smith VC, Zupancic JA,
McCormick MC et al. Rehospi-
talization in the first year of life
among infants with broncho-
pulmonary dysplasia. J Pediatr
2004;144(6):799-803.
9.
Brissaud O, Babre F, Pedespan
L et al. Rehospitalization of
very preterm infants in the
first year of life. Comparison of
2 groups: 1997 and 2002. Arch
Pediatr 2005;12(10):1462-70.
10.
Resch B, Pasnocht
A,Gusenleitner W, Müller W.
Rehospitalisations for respiratory
disease and respiratory syncytial
virus infection in preterm infants
of 29-36 weeks gestational age.
J Infect 2005;50(5):397-403.
11.
Giacoia GP, Venkataraman
PS, West-Wilson KI, Faulkner
MJ. Follow-up of school-age
children with bronchopul-
monary dysplasia. J Pediatr
1997;130(3):400-8.
12.
Vrijlandt E, Gerritsen J,
Boezen HM, Duiverman EJ and

La Lettre du Pneumologue • Vol. XIII - n° 2 - mars-avril 2010 | 57
MISE AU POINT
comparer aux clichés antérieurs. Une hospitalisation
est préférable. La prise en charge associe un traitement
symptomatique (désobstruction rhinopharyngée, kiné-
sithérapie respiratoire, oxygénothérapie ou assistance
ventilatoire, arrêt éventuel de l’alimentation, etc.) et
éventuellement anti-infectieux (antibiotique, antiviral,
immunothérapie anti-VRS hors AMM). En cas de DBP,
un traitement spécifique peut être indiqué :
– en cas de surcharge pulmonaire : furosémide
(Lasilix
®
) 1 mg/kg en intraveineux direct, à renouveler
si besoin, et restriction hydrique ;
– en cas de signes spastiques : aérosols de salbutamol
(Ventoline
®
) et/ou d’ipratropium (Atrovent
®
) dont les
fréquences et les durées dépendent de la sévérité et de
l’évolution (aucune étude n’a cependant pu démontrer
leur efficacité dans ce cadre) ;
– quel que soit le mode de décompensation : cortico-
thérapie courte (3 à 5 jours) à 2 mg/kg x 1/j.
En cas de DBP symptomatique (symptomatologie chro-
nique, décompensations répétées, hospitalisation), un
traitement de fond peut être proposé. Il doit être adapté
en permanence à l’évolution clinique du patient, qui,
nécessairement, associera des périodes d’aggravation
et d’amélioration. Les thérapeutiques à proposer sont :
– une oxygénothérapie à domicile en cas d’hypoxie
persistante ou d’HTAP. La durée quotidienne (souvent
supérieure à 15 h/j) et le débit (souvent faible, inferieur
à 1 l/mn) sont adaptés pour une oxymétrie transcu-
tanée cible supérieure à 92 %. Cette oxymétrie est
contrôlée 1 fois par mois, éventuellement à domicile,
par un enregistrement continu durant des phases
d’éveil, d’alimentation et de sommeil (20) ;
– une ventilation non invasive en cas d’insuffisance
respiratoire chronique sévère hypercapnique ;
– des bronchodilatateurs (salbutamol, terbutaline) en
cas de symptomatologie spastique. Son efficacité est
très variable d’un patient à l’autre, et doit être vérifiée
cliniquement avant d’être poursuivie. Son intérêt peut
être étayé par des EFR, bien qu’elles soient difficiles
à réaliser chez les nourrissons. Les posologies ou les
modalités d’administration (nébulisations, aérosol
doseurs) sont identiques à celles de la bronchite chro-
nique obstructive (BPCO) ;
– une corticothérapie. Elle doit être facilement pres-
crite dans la première année de vie, puis en cas de
dysplasie sévère (plus de 3 épisodes de dyspnée par
an, corticothérapie courte, à forte dose et fréquente).
Il convient de privilégier les nébulisations aux voies
générales et de chercher la posologie minimale efficace.
Le praticien doit garder en tête les risques majeurs
d’effets indésirables des doses cumulées reçues par les
patients atteints de DBP : diminution de l’alvéolisation
pulmonaire, HTA, rétinopathie, anomalie neurologique
à long terme, retard de croissance, diabète. Les poso-
logies ou les modalités d’administration (voie orale,
nébulisations, aérosol doseurs) sont identiques à celles
de l’asthme (21) ;
– des diurétiques en cas de surcharge pulmonaire chro-
nique ou de décompensations répétées. La spirono-
lactone (Aldactone
®
, 5 mg/kg/j en 2 prises) a montré
son efficacité sur la fonction respiratoire et l’oxygéno-
dépendance dans la première année de vie (22). En
seconde intention, l’hydrochlorothiazide (Esidrex
®
)
peut être proposé.
La nature et la fréquence du suivi dépendent de l’âge, de
la sévérité initiale et de l’évolution clinique. En l’absence
de DBP, les enfants nés prématurés ne nécessitent pas
de suivi pneumologique spécifique. En cas de DBP,
un suivi pneumologique est souhaitable durant les 2
premières années de vie, les plus à risque de décom-
pensations. Les enfants peu ou non symptomatiques
nécessitent un suivi pneumologique tous les 4 à 6 mois
dans les 2 premières années de vie. Les enfants les plus
symptomatiques (traitement de fond, symptomato-
logie chronique, décompensations répétées, hospita-
lisations, etc.) ont besoin d’un suivi pneumologique au
long cours, tous les 2 à 3 mois dans la première année
de vie, puis selon l’évolution. Au-delà de 2-3 ans, seuls
les enfants encore symptomatiques nécessitent un suivi
particulier, qui sera identique à celui d’un enfant asth-
matique. Le rôle du scanner thoracique est controversé
et réservé aux enfants les plus symptomatiques étant
donné le peu d’impact thérapeutique. De même, en
cas de persistance des symptômes respiratoires, des
EFR peuvent êtres proposées dès 3-4 ans (mesure des
volumes et résistances) et vers 5-7 ans pour des EFR
complètes.
Conclusion
Les conséquences pulmonaires de la prématurité se sont
modifiées avec l’arrivée de la “nouvelle DBP”. Ces consé-
quences ne sont plus seulement la DBP des 2 premières
années de vie, mais une “maladie pulmonaire chronique
postnéonatale” évoluant jusqu’à l’âge adulte. En effet, la
définition de la DBP fondée sur l’unique oxygénodépen-
dance est aujourd’hui très critiquée, notamment parce
qu’elle rassemble sous un même nom des pathologies
très différentes dans leur présentation et leur évolu-
tion. Une meilleure compréhension du développement
pulmonaire et des mécanismes d’agression permettra
de développer de nouveaux axes thérapeutiques. Il s’agit
notamment de diminuer une corticothérapie, certes
efficace, mais dont les effets délétères à long terme
sont de mieux en mieux connus. ■
the Dutch POPS-19 Collabora-
tive Study Group. Gender differ-
ences in respiratory symptoms in
19 years old adults born preterm.
Respir Res 2005;13;6:117.
13.
Koumbourlis AC, Motoyama
EK, Mutich RL et al. Longitudinal
follow-up of lung function from
childhood to adolescence in
prematurely born patients with
neonatal chronic lung disease.
Pediatr Pulmonol 1996;21(1):28-
34.
14. Doyle LW, Ford GW, Olinsky
A, Knoches AM, Callanan C. Bron-
chopulmonary dysplasia and very
low birthweight: lung function at
11 years of age. J Paediatr Child
Health 1996;32(4):339-43.
15.
Halvorsen T, Skadberg
BT, Eide GE et al. Pulmonary
outcome in adolescents of
extreme preterm birth: a regional
cohort study. Acta Paediatr
2004;93(10):1294-300.
16. Robin B, Kim YJ, Huth J et al.
Pulmonary function in broncho-
pulmonary dysplasia. Pediatr
Pulmonol 2004; 37(3):236-42.
17.
Jacob SV, Coates AL, Lands
LC et al. Long-term pulmonary
sequelae of severe broncho-
pulmonary dysplasia. J Pediatr
1998;133(2):193-200.
18.
Jacob SV, Lands LC, Coates AL
et al. Exercise ability in survivors
of severe bronchopulmonary
dysplasia. Am J Respir Crit Care
Med 1997;155(6):1925-9.
19.
Commission de transparence
de l’HAS. Avis du 19 décembre
2007 concernant le palivizumab.
20.
Kotecha S, Allen J. Oxygen
therapy for infants with chronic
lung disease. Arch Dis Child Fetal
Neonatal Ed 2002;87:F11-F14.
21.
Pediatrics AAo, Society CP.
Postnatal corticosteroids to treat
or prevent chronic lung disease
in preterm infants. Pediatrics
2002;109:330-8.
22.
Kao LC, Durand DJ, McCrea
RC et al. Randomized trial of
long-term diuretic therapy for
infants with oxygen-dependent
bronchopulmonary dysplasia. J
Pediatr 1994; 124(5 Pt 1):772-81.
1
/
5
100%