le point sur... - E

CORDIAM
MAI / JUIN 2015
Lipotoxicité et cardiomyopathie
du patient diabétique
Xavier Prieur - INSERM U1087 Nantes
xavier[email protected]r
LE POINT SUR...
Le syndrome métabolique et le diabète
sont des facteurs de risque majeurs
pour les maladies cardiovasculaires.
En plus des maladies coronariennes,
les patients obèses et diabétiques
présentent une forte prévalence des
cardiomyopathies non ischémiques.
Ces pathologies sont fortement corrélées avec
le diabète, l’insulino-résistance et le taux d’hémo-
globine glyquée.
Sur le plan clinique, cette cardiomyopathie se
caractérise par une hypertrophie ventriculaire
gauche et une dysfonction diastolique associée à
un défaut de remplissage [1,2].
L’obésité elle même entraine un remodelage cardiaque
qui se traduit aussi par une hypertrophie ventriculaire
gauche et une dysfonction diastolique [3].
Sur le plan mécanistique, la physiopathologie n’est
pas établie. Différents travaux s’accordent à dire
que ces anomalies sont liées à une dysfonction du
métabolisme cardiaque dans le contexte diabétique
et insulino-résistant. Une meilleure compréhension
des mécanismes impliqués pourrait permettre
l’identification de nouvelles pistes pharmaceutiques.
Dans cette revue, nous allons nous intéresser aux
altérations du métabolisme cardiaque identifiées
dans le diabète de type 2 puis nous nous
concentrerons sur le rôle délétère d'un excès de
lipides, ou lipotoxicité, au niveau du myocarde [3].
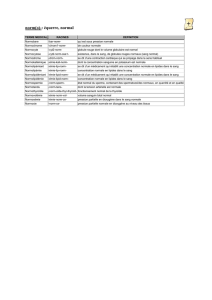
Expansion du tissu adipeux
et lipotoxicité
L’obésité se caractérise par une expansion du tissu
adipeux. Cependant, de nombreuses publications
montrent que les adipocytes ne sont plus fonctionnels
chez les patients obèses et insulino-résistants. Le tissu
adipeux des patients obèses se caractérise par la présence
d’adipocytes hypertrophiques et insulino-résistants
ainsi qu’une infiltration macrophagique qui altèrent le
fonctionnement du tissu [4]. Ces adipocytes ne sont plus
en mesure de stocker les lipides correctement et vont,
par conséquent, relarguer des acides gras libres (AGL) en
grande quantité dans la circulation.
L’augmentation de la concentration des AGL circulants
va favoriser leur dépôt dans différents organes tels que
le pancréas, le foie, les muscles et le cœur. Ces dépôts
ectopiques de lipides vont activer des voies de stress qui
vont affecter le fonctionnement de ces organes, c’est le
phénomène de lipotoxicité (Figure 1) [5,6].
18
OBÉSITÉ ET LIPOTOXICITÉ.
L’obésité est associée
à un stade de « saturation »
du tissu adipeux.
Les lipides ne pouvant
plus être stockés
dans ce dernier,
ils se déposent de manière
ectopique dans d’autres
organes et ils en perturbent
le fonctionnement.
Ce phénomène est appelé
la lipotoxicité.
Figure 1

MAI / JUIN 2015
19
CORDIAM
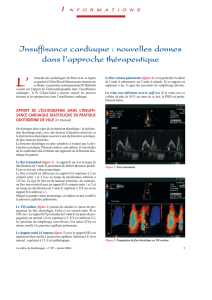
Figure 2A
Augmentation du contenu
intra-myocardique des lipides
En 2004, des premières études ont mis en évidence
la présence de dépôts ectopiques de lipides chez des
patients obèses et diabétiques. Ces dépôts étaient plus
marqués chez les patients ayant subi un infarctus du
myocarde [7]. Cette étude portait sur un petit nombre
de patients du fait qu'elle nécessitait des biopsies
cardiaques. En parallèle, des études sur des cœurs de
souris obèses ont mis en évidence une accumulation de
triglycérides associée à une dysfonction diastolique [8].
Cette accumulation est liée à une perturbation
profonde du métabolisme énergétique cardiaque. En
effet, le besoin énergétique est assuré à 80% par les
lipides et 20% par les glucides. Cette consommation
de glucides est plus marquée en situation post-
prandiale car l’internalisation du glucose au niveau
cardiaque est stimulée par l’insuline (Figure 2A).
Cette stimulation est quasiment abolie dans le cœur
des souris obèses et insulino-résistantes, alors qu'au
contraire, l’internalisation des acides gras y est
augmentée [9].
Pour les études cliniques humaines, l’utilisation de
l’IRM a permis quelques années plus tard, de confir-
mer que le diabète de type 2 était associé à une aug-
mentation du contenu lipidique intra-myocardique
[10]. Cette étude portant sur 38 patients diabétiques
a montré que le contenu cardiaque en triglycérides,
étant positivement corrélé au ratio E/A (flux mitral,
onde E = relaxation du ventricule, onde A = contrac-
tion de l’oreillette), permet de prédire une dysfonction
diastolique.
De nombreuses autres études ont confirmé ces
données dans différentes cohortes.
Récemment, une étude pilote utilisant la tomogra-
phie par émissions de positons a mis en évidence que
l’internalisation des acides gras libres était augmen-
tée dans le cœur des patients insulino-résistants [11].
Les méthodes d’IRM ont aussi permis de mettre en
évidence la présence de dépôts adipeux péricardique
et épicardique [12]. Ils se distinguent des dépôts
ectopiques intra-myocardique : il s’agit de tissus adipeux
et les TG y sont stockés dans des adipocytes. Cependant,
des analyses IRM concordantes démontrent que la
quantité de tissu adipeux péricardique et épicardique
est également fortement corrélée avec une dysfonction
diastolique [13]. L’ensemble de ces données a permis
de montrer qu'au niveau cardiaque, le diabète se traduit
par une baisse de l’utilisation du glucose au profit d’une
augmentation de l’internalisation des lipides, et que
l’accumulation de lipides était fortement corrélée à la
dysfonction diastolique.
Effet de la prise en charge
de l’obésité et du diabète sur
la dysfonction diastolique
L’obésité altère de nombreux paramètres cardiaques.
L’effet de la perte de poids sur la fonction cardiaque,
que ce soit suite à des modifications du régime
alimentaire ou suite à une chirurgie bariatrique, est
insuline
signalisation
glut4
glucose
glycolyse
ATP
AG
AG Acyl-coA
20%
80%
CD36
Figure2A
MÉTABOLISME CARDIAQUE.
EN CONDITION
PHYSIOLOGIQUE,
Les acides gras (AG)
sont les substrats énergétiques
cardiaques préférentiels (80%),
ils sont internalisés par
le transporteur CD36 puis
vont être catabolisés au niveau
mitochondrial par la béta-
oxydation. En situation post-
prandiale, le glucose est
internalisé via le transporteur
insulino-dépendant Glut4,
et constitue environ 20% de
l’apport énergétique global.

CORDIAM
MAI / JUIN 2015
20
LE POINT SUR...
variable selon le paramètre étudié. Par exemple
la pression ventriculaire selon les études peut être
diminuée ou inchangée, après une perte de poids
[14]. Au contraire, la perte de poids est de manière
constante associée avec une baisse de la masse du
ventricule gauche et une amélioration de la fonction
diastolique [14,15].
Les antidiabétiques ont pour rôle premier de rétablir
l’équilibre glycémique. La réduction de l’hémoglobine
glyquée a des effets bénéfiques sur les risques d’infarctus
[16]. Des études ont caractérisé l’effet de la metformine
et des thiazolidinediones (TZD) sur la cardiomyopathie
du patient diabétique mais le lien reste mal établi.
Une étude portant sur 78 patients diabétiques de
type 2 naïfs, traités par la metformine (2g/jour) ou
la pioglitazone (30mg/jour), a mis en évidence que la
pioglitazone améliore le volume en fin de diastole mais
ne modifie ni la masse du ventricule, ni le ratio E/A.
Dans cette même étude, la metformine n’a pas d’effet
bénéfique sur ces paramètres [17].
Une étude portant sur des diabétiques de type 2
naïfs conclut également à des effets bénéfiques de la
pioglitazone [18].Cependant, une autre étude a conclu
à l’absence d’effets de la pioglitazone sur la fonction
diastolique mais le groupe contrôle était constitué de
patients asymptomatiques traités par la metformine, de
ce fait ces études ne sont pas comparables [19].
Chez des rats hypertendus SHHF, la metformine
améliorait les paramètres diastoliques et diminuait
l’accumulation intramyocardique de triglycérides [20].
Les effets de la metformine n’étant pas clairement
établis chez l’homme, une nouvelle étude, MET-DIME
est en cours de réalisation avec pour but d’évaluer si
la metformine améliore les paramètres cardiaques chez
des patients atteints de syndrome métabolique et naïfs
de tout traitement [21].
En conclusion, alors que les effets de la perte de poids
sur la fonction diastolique sont très clairs, les effets
des insulinosensibilisateurs, que ce soit la metformine
ou la pioglitazone, sont encore mal documentés et
de nouvelles études cliniques sont nécessaires pour
évaluer leur effets cardiaques. Les effets des nouveaux
anti-diabétiques, inhibiteurs de DPP4 et analogues du
GLP1 notamment, sur la fonction diastolique, n’ont
pas encore été rapportés. Des études complémentaires
sont attendues, surtout qu’une augmentation du
risque d’hospitalisation a été récemment mise en
évidence dans l’étude SAVOR avec la saxagliptine [22].
De plus, une meilleure compréhension des mécanismes
moléculaires impliqués dans la dysfonction diastolique
associée au diabète permettrait de mieux prédire
les effets d’un traitement donné en fonction de son
mécanisme d’action.
De l’accumulation des lipides
à la dysfonction cardiaque
Diverses études ont cherché à établir le lien mécanistique
entre les perturbations métaboliques et la dysfonction
cardiaque. Dans un premier temps, des chercheurs ont
mis en évidence un paradoxe énergétique : les cœurs de
souris obèses consomment plus d’acides gras mais la
production d’énergie sous forme d’ATP est diminuée.
Ce paradoxe oriente vers un défaut entre le catabolisme
des acides gras (béta-oxydation) et la production d’ATP.
Les chercheurs ont montré qu’il existait une dysfonction
mitochondriale et qu’au lieu de produire de l’ATP, les
mitochondries produisaient des espèces réactives de
l’oxygène (ERO) qui vont générer un stress oxydant [23].
Ce phénomène qui consiste à avoir des mitochondries
actives sans production d’ATP s’appelle le découplage ;
dans le contexte de la lipotoxicité cardiaque, l’origine du
découplage n’est pas établie.
D’autres études se sont intéressées aux espèces lipidiques
accumulées au niveau cardiaque. En effet, de nombreux
travaux ont mis en évidence que les triglycérides n’étaient
pas eux-mêmes toxiques mais que d’autres espèces lipi-
diques étaient à l’origine de la lipotoxicité [24]. Toujours
sur la base d’études animales, deux espèces de lipides in-
terviendraient : les diacylglycérols (DAG) et les céramides
[25]. Les diacylglycérols [26] et les céramides [27] ont été
impliqués dans l’insulino-résistance. Ces lipides activent
des kinases, de la famille des protéines kinases C (PKC),
qui vont phosphoryler un des acteurs de la voie de signa-
lisation de l’insuline, le substrat du récepteur de l'insuline
IRS1, et vont favoriser sa dégradation. La dégradation
d’IRS1 va empêcher la transduction du signal cellulaire
de l’insuline et donc son action biologique. L’accumu-
lation de ces espèces lipidiques peut ainsi directement
contribuer à l’insulino-résistance cardiaque et à la perte
de capacité du cœur d’internaliser et d’oxyder le glucose.
Ces résultats sont particulièrement intéressants car ils
proposent des nouvelles pistes thérapeutiques contre
l’insulino-résistance cardiaque. En effet, la myriocine,
un inhibiteur de la synthèse des céramides, réduit
la mortalité dans un modèle murin de lipotoxicité
cardiaque [28]. De plus, l’adiponectine, une hormone
insulino-sensibilisatrice produite par le tissu adipeux,

MAI / JUIN 2015
21
CORDIAM
active au niveau cardiaque une enzyme qui dégrade les
céramides. Cette action prévient les effets lipotoxiques
cardiaques [28].
Dans l’ensemble, ces données montrent que, dans
un contexte d’obésité et de diabète de type 2,
des concentrations élevées en acides gras libres
favorisent leur dépôt ectopique au niveau cardiaque.
L’accumulation de lipides va entraîner la production
d’espèces lipotoxiques comme les diacylglycérols et les
céramides qui vont perturber la voie de signalisation de
l’insuline, contribuant à l’insulino-résistance cardiaque,
et qui par conséquent vont altérer la capacité du cœur à
utiliser le glucose comme substrat énergétique.
De plus, une dysfonction mitochondriale, dont l’origine
est mal comprise, altère la production d’ATP et augmente
la production d’espèces réactives de l’oxygène. La baisse
de production d’ATP entraine un déficit énergétique
alors que la production d’espèces réactives de l’oxygène
génère un stress qui va altérer la structure des protéines
cardiaques en en modifiant la structure (nitrosylation,
carbonylation…), affectant ainsi la fonction contractile
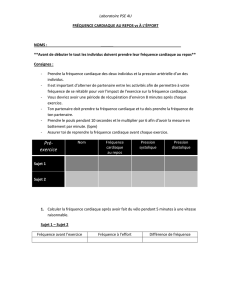
cardiaque (Figure 2B) [29].
Conclusion
La cardiomyopathie non ischémique caractérisée par
une dysfonction diastolique présente une prévalence
élevée chez les patients diabétiques. Les mécanismes
impliqués dans cette pathologie sont mal compris
mais un dysfonctionnement du métabolisme
énergétique cardiaque est mis en cause. Depuis une
dizaine d’année, des travaux ont mis en évidence que
l’insulino-résistance, caractéristique du diabète de
type 2, était associée à une baisse de l’utilisation du
glucose au profit des acides gras. L’internalisation
accrue des acides gras entraîne une accumulation
intra-myocardique de triglycérides, une accumulation
de lipides lipotoxiques comme les céramides et les
diacylglycérols et un stress oxydant.
Les espèces lipotoxiques ont d’une part pour effet
de parasiter la voie de signalisation de l’insuline,
contribuant ainsi à l’insulino-résistance cardiaque, et
d'autre part de stimuler des voies de stress, pouvant
aboutir à l’apoptose des cardiomyocytes. Des pistes
thérapeutiques visant à inhiber la synthèse ou à activer
la dégradation de ces espèces lipotoxiques ont été
testées avec succès dans des modèles animaux. D’autre
part, le stress oxydant va générer des espèces réactives
de l’oxygène qui peuvent entraîner des modifications
covalentes des protéines qui, à terme, peuvent affecter
la fonction cardiaque.
L’avancée des connaissances dans ce domaine
pourrait permettre l’identification de nouvelles
cibles moléculaires et ainsi ouvrir la voie à de nou-
veaux traitements pour la prise en charge des car-
diomyopathies du patient diabétique.
MÉTABOLISME
CARDIAQUE.
DANS UN CONTEXTE
INSULINO-RÉSISTANT,
le transport du glucose
est affecté et l’internalisation
des acides gras
est augmentée, ce qui va
favoriser un dépôt
ectopique de lipides,
l’accumulation d’espèces
lipotoxiques, diacylglycérol
(DAG) et céramides,
et la formation d’espèces
réactives de l’oxygène
(ERO).
Figure 2B

CORDIAM
MAI / JUIN 2015
22
RéféRences
1 Taegtmeyer, H., McNulty, P. and Young, M. E. (2002) Adaptation and maladaptation of the heart in diabetes: Part I: general concepts. Circulation 105, 1727-1733
2 Young, M. E., McNulty, P. and Taegtmeyer, H. (2002) Adaptation and maladaptation of the heart in diabetes: Part II: potential mechanisms. Circulation 105, 1861-1870
3 Abel, E. D., Litwin, S. E. and Sweeney, G. (2008) Cardiac remodeling in obesity. Physiol Rev 88, 389-419
4 Prieur, X., Roszer, T. and Ricote, M. (2009) Lipotoxicity in macrophages: evidence from diseases associated with the metabolic syndrome. Biochim Biophys Acta
5 Virtue, S. and Vidal-Puig, A. (2008) It's not how fat you are, it's what you do with it that counts. PLoS Biol 6, e237
6 Virtue, S. and Vidal-Puig, A. (2010) Adipose tissue expandability, lipotoxicity and the Metabolic Syndrome--an allostatic perspective. Biochim Biophys Acta 1801, 338-349
7 Sharma, S., Adrogue, J. V., Golfman, L., Uray, I., Lemm, J., Youker, K., Noon, G. P., Frazier, O. H. and Taegtmeyer, H. (2004) Intramyocardial lipid accumulation in the failing human heart
resembles the lipotoxic rat heart. FASEB J 18, 1692-1700
8 Christoersen, C., Bollano, E., Lindegaard, M. L., Bartels, E. D., Goetze, J. P., Andersen, C. B. and Nielsen, L. B. (2003) Cardiac lipid accumulation associated with diastolic dysfunction in
obese mice. Endocrinology 144, 3483-3490
9 Mazumder, P. K., O'Neill, B. T., Roberts, M. W., Buchanan, J., Yun, U. J., Cooksey, R. C., Boudina, S. and Abel, E. D. (2004) Impaired cardiac eciency and increased fatty acid oxidation in
insulin-resistant ob/ob mouse hearts. Diabetes 53, 2366-2374
10 Rijzewijk, L. J., van der Meer, R. W., Smit, J. W., Diamant, M., Bax, J. J., Hammer, S., Romijn, J. A., de Roos, A. and Lamb, H. J. (2008) Myocardial steatosis is an independent predictor of
diastolic dysfunction in type 2 diabetes mellitus. J Am Coll Cardiol 52, 1793-1799
11 Labbé, S. M., Grenier-Larouche, T., Noll, C., Phoenix, S., Guérin, B., Turcotte, E. E. and Carpentier, A. C. (2012) Increased myocardial uptake of dietary fatty acids linked to cardiac dysfunc-
tion in glucose-intolerant humans. Diabetes 61, 2701-2710
12 Gaborit, B., Kober, F., Jacquier, A., Moro, P. J., Cuisset, T., Boullu, S., Dadoun, F., Alessi, M. C., Morange, P., Clément, K., Bernard, M. and Dutour, A. (2012) Assessment of epicardial fat
volume and myocardial triglyceride content in severely obese subjects: relationship to metabolic prole, cardiac function and visceral fat. Int J Obes (Lond) 36, 422-430
13 Nyman, K., Granér, M., Pentikäinen, M. O., Lundbom, J., Hakkarainen, A., Sirén, R., Nieminen, M. S., Taskinen, M. R., Lundbom, N. and Lauerma, K. (2013) Cardiac steatosis and left
ventricular function in men with metabolic syndrome. J Cardiovasc Magn Reson 15, 103
14 Alpert, M. A., Omran, J., Mehra, A. and Ardhanari, S. (2014) Impact of obesity and weight loss on cardiac performance and morphology in adults. Prog Cardiovasc Dis 56, 391-400
15 Vest, A. R., Heneghan, H. M., Agarwal, S., Schauer, P. R. and Young, J. B. (2012) Bariatric surgery and cardiovascular outcomes: a systematic review. Heart 98, 1763-1777
16 Seferović, P. M., Milinković, I., Ristić, A. D., Seferović Mitrović, J. P., Lalić, K., Jotić, A., Kanjuh, V., Lalić, N. and Maisch, B. (2012) Diabetic cardiomyopathy: ongoing controversies in 2012.
Herz 37, 880-886
17 van der Meer, R. W., Rijzewijk, L. J., de Jong, H. W., Lamb, H. J., Lubberink, M., Romijn, J. A., Bax, J. J., de Roos, A., Kamp, O., Paulus, W. J., Heine, R. J., Lammertsma, A. A., Smit, J.
W. and Diamant, M. (2009) Pioglitazone improves cardiac function and alters myocardial substrate metabolism without aecting cardiac triglyceride accumulation and high-energy phosphate
metabolism in patients with well-controlled type 2 diabetes mellitus. Circulation 119, 2069-2077
18 Ordu, S., Ozhan, H., Alemdar, R., Aydin, M., Basar, C., Caglar, O., Yazici, M. and Yalcin, S. (2010) Pioglitazone improves ventricular diastolic function in patients with diabetes mellitus: a
tissue Doppler study. Acta Cardiol 65, 401-406
19 Naka, K. K., Pappas, K., Papathanassiou, K., Papamichael, N. D., Kazakos, N., Kanioglou, C., Makriyiannis, D., Katsouras, C. S., Liveris, K., Tsatsoulis, A. and Michalis, L. K. (2010) Lack
of eects of pioglitazone on cardiac function in patients with type 2 diabetes and evidence of left ventricular diastolic dysfunction: a tissue doppler imaging study. Cardiovasc Diabetol 9, 57
20 Cittadini, A., Napoli, R., Monti, M. G., Rea, D., Longobardi, S., Netti, P. A., Walser, M., Samà, M., Aimaretti, G., Isgaard, J. and Saccà, L. (2012) Metformin prevents the development of
chronic heart failure in the SHHF rat model. Diabetes 61, 944-953
21 Ladeiras-Lopes, R., Fontes-Carvalho, R., Bettencourt, N., Sampaio, F., Gama, V. and Leite-Moreira, A. F. (2014) METformin in DIastolic Dysfunction of MEtabolic syndrome (MET-DIME) trial:
rationale and study design : MET-DIME trial. Cardiovasc Drugs Ther 28, 191-196
22 Scirica, B. M., Bhatt, D. L., Braunwald, E., Steg, P. G., Davidson, J., Hirshberg, B., Ohman, P., Frederich, R., Wiviott, S. D., Homan, E. B., Cavender, M. A., Udell, J. A., Desai, N. R.,
Mosenzon, O., McGuire, D. K., Ray, K. K., Leiter, L. A., Raz, I. and SAVOR-TIMI 53 Steering Committee and Investigators (2013) Saxagliptin and cardiovascular outcomes in patients with type
2 diabetes mellitus. N Engl J Med 369, 1317-1326
23 Boudina, S., Sena, S., Theobald, H., Sheng, X., Wright, J. J., Hu, X. X., Aziz, S., Johnson, J. I., Bugger, H., Zaha, V. G. and Abel, E. D. (2007) Mitochondrial energetics in the heart in obesity-
related diabetes: direct evidence for increased uncoupled respiration and activation of uncoupling proteins. Diabetes 56, 2457-2466
24 Listenberger, L. L., Han, X., Lewis, S. E., Cases, S., Farese, R. V., Ory, D. S. and Schaer, J. E. (2003) Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proc Natl
Acad Sci U S A 100, 3077-3082
25 Demarco, V. G., Ford, D. A., Henriksen, E. J., Aroor, A. R., Johnson, M. S., Habibi, J., Ma, L., Yang, M., Albert, C. J., Lally, J. W., Ford, C. A., Prasannarong, M., Hayden, M. R., Whaley-
Connell, A. T. and Sowers, J. R. (2013) Obesity-related alterations in cardiac lipid prole and nondipping blood pressure pattern during transition to diastolic dysfunction in male db/db mice.
Endocrinology 154, 159-171
26 Savage, D. B., Petersen, K. F. and Shulman, G. I. (2007) Disordered lipid metabolism and the pathogenesis of insulin resistance. Physiological Reviews 87, 507-520
27 Summers, S. A. (2006) Ceramides in insulin resistance and lipotoxicity. Prog Lipid Res 45, 42-72
28 Park, T. S., Hu, Y., Noh, H. L., Drosatos, K., Okajima, K., Buchanan, J., Tuinei, J., Homma, S., Jiang, X. C., Abel, E. D. and Goldberg, I. J. (2008) Ceramide is a cardiotoxin in lipotoxic car-
diomyopathy. J Lipid Res 49, 2101-2112
29 Wende, A. R. and Abel, E. D. (2010) Lipotoxicity in the heart. Biochim Biophys Acta 1801, 311-319
1
/
5
100%