L’ Cancers du sein RÉTROSPECTIVE PERSPECTIVES

96 | La Lettre du Cancérologue • Vol. XXVI - n° 3 - mars 2017
RÉTROSPECTIVE
PERSPECTIVES
J.Y. Pierga
V. Diéras
Cancers du sein
Breast cancers
J.Y. Pierga*, **, V. Diéras*
* Institut Curie, Paris.
** Université Paris-Descartes.
L’
année 2016 a été marquée par la confirmation
de la place des inhibiteurs de CDK (Cycline-
Dependant Kinase) dans la prise en charge du
cancer du sein exprimant les récepteurs hormonaux
(RH+) au stade métastatique. Une autorisation de
mise sur le marché (AMM) a été obtenue en première
ligne, mais les accords de remboursement arrive-
ront plus tard dans l’année. La prise en charge de
la maladie métastatique tend de plus en plus à
s’améliorer et à se standardiser. Ainsi, les recom-
mandations dans la prise en charge du cancer du
sein métastatique, définies dans le cadre du congrès
de l’ABC3, ont été publiées dans The Breast et dans
Annals of Oncology, définissant de nouveaux stan-
dards internationaux (1, 2).
Biologie
Les données du séquençage de la totalité du génome
de 560 cas de cancer du sein de tous les types ont
été publiées dans Nature par un large consortium
international mené par l’équipe de Cambridge (3). Ce
catalogue exhaustif des mutations et réa rrangements
du génome du cancer du sein permettra de définir de
nouveaux mécanismes impliqués dans l’oncogenèse
mammaire, de déterminer de nouvelles signatures
mutationnelles et il servira donc de référence pour de
multiples travaux à visée cognitive ou thérapeutique.
Les nouveaux continents à explorer sont ceux du
microenvironnement et de l’épi génétique.
Plusieurs études ont montré l’apparition de mutations
du gène codant pour le récepteur aux estrogènes
(ESR1) à la phase métastatique, alors que ce type de
mutations est particulièrement rare au stade initial
du cancer du sein (moins de 1 %). Il semble que ces
mutations soient plus souvent associées à l’exposition
aux inhibiteurs de l’aromatase à la phase avancée de
la maladie et expliqueraient la résistance aux trai-
tements hormonaux. La possibilité de détecter ces
mutations directement sur l’ADN tumoral circulant
(ADNtc) a été mise en évidence. Ces mutations ont été
retrouvées dans 30,6 % des cas et étaient associées à
un pronostic plus mauvais en termes de survie sans
progression et de survie globale. Les mutations d’ESR1
ont été recherchées dans le plasma de patientes
incluses dans 2 études d’hormonothérapie à la phase
métastatique. L’étude SoFEA comparait le fulvestrant
(SERD [Specific Estrogen Receptor Degrader]) à un
inhibiteur de l’aromatase, l’exémestane, et a mis en
évidence une survie identique dans les 2 bras. Un
taux particulièrement élevé de mutations d’ESR1
dans l’ADNtc (39,1 %) a été détecté par une tech-
nique de ddPCR (Digital Droplet Polymerase Chain
Reaction) [4]. La survie sans progression était plus
longue avec l’utilisation du fulvestrant qu’avec celle de
l’exémestane chez les patientes ayant une mutation
de l’ESR1, alors qu’il n’y avait aucune différence entre
les traitements en l’absence de mutation d’ESR1. Dans
l’essai PALOMA-3, qui comparait le fulvestrant seul à
fulvestrant + palbociclib, le bénéfice des 2 bras était
identique, quel que soit le statut mutationnel d’ESR1.
Cela semble montrer l’avantage du fulvestrant sur les
inhibiteurs de l’aromatase en cas de mutation d’ESR1
et confirme une fréquence élevée de mutations d’ESR1
au stade métastatique (entre 25,3 et 39 %). On voit
ainsi se dessiner la possibilité de suivre, dans le sang
des patientes sous hormonothérapie à la phase méta-
statique, l’apparition de marqueurs de résistance au
traitement avant la progression clinique.
Traitement adjuvant
Essai MINDACT
Les signatures génomiques sont de plus en plus utili-
sées pour la prise de décision concernant l’indica-
tion ou non d’une chimiothérapie adjuvante dans le
cancer du sein localisé. Cependant, la valeur pronos-
tique de ces tests ne repose que sur des analyses
rétrospectives. Pour la première fois, ont été publiées
les données d’un essai prospectif visant à valider
la signature de 70 gènes, dite MammaPrint®, dans
le cadre de l’étude MINDACT (Microarray In Node
negative Disease May Avoid ChemoTherapy), ont
été publiées (5). De 2007 à 2011, 11 288 patientes
atteintes d’un cancer du sein opéré, sans atteinte
ganglionnaire ou ayant entre 1 et 3 ganglions atteints
(pN1a) ont été “screenées” pour cette étude ;

La Lettre du Cancérologue • Vol. XXVI - n° 3 - mars 2017 | 97
Risque clinique (c)
Logiciel Adjuvant online !
Risque génomique (g)
Signature de 70 gènes ou MammaPrint®
c-Low/g-Low c-High/g-High
(n = 2 745) (n = 1 806)
c-High/g-Low
(n = 1 550)
Discordant
(n = 592)
c-Low/g-High
Randomisation Chimiothérapie
c-High : risque clinique élevé ; c-Low : risque clinique faible ; g-High : risque génomique élevé ; g-Low : risque génomique faible.
Pas de chimiothérapie
Patientes incluses
(n = 6 693)
n = 644
Figure 1. Analyse primaire de la population.
Résumé
6 693 patientes ont été incluses. La question était
de savoir – entre les critères de décision cliniques
habituels (taille tumorale, ganglion, récepteurs
hormonaux, etc.) et la signature génomique détermi-
nant un risque faible ou élevé de récidive – quel est le
meilleur élément de décision pour éviter de faire une
chimiothérapie adjuvante “inutile”, en raison d’une
probabilité de survie sans métastases à distance de
plus de 92 % à 5 ans. Les 2 745 patientes ayant un
risque clinique faible (c-Low) et un risque génomique
faible (g-Low) ne recevaient pas de chimiothérapie
(figure 1). Les 1 806 ayant un risque clinique élevé
(c-High) et un risque génomique élevé (g-High) rece-
vaient une chimiothérapie. Pour celles qui avaient
un risque dissocié entre la clinique et la génomique
(c-Low/g-High : n = 592 ; c-High/g-Low : n = 1 550),
le choix du traitement était randomisé entre utili-
sation du critère clinique ou du critère génomique.
En définitive, après randomisation, 644 patientes
considérées comme étant à risque clinique élevé
mais avec une signature génomique favorable n’ont
pas reçu de chimiothérapie adjuvante (figure 1).
L’analyse, après 5 ans de recul, montre que la survie
sans métastases à distance de ces patientes est supé-
rieure à 92 % (figure 2, p. 98) et qu’elle n’est
pas statistiquement significativement inférieure à
celle des patientes ayant reçu une chimiothérapie
adjuvante. La conclusion de l’étude est que l’utili-
sation de la signature génomique se traduit par une
diminution de la prescription de chimiothérapie, sans
réduction des chances de survie des 1 550 femmes
considérées comme “à haut risque” de rechute selon
les critères cliniques classiques. En tout, 46 % des
patientes ayant un risque clinique considéré comme
élevé auraient pu échapper au traitement grâce au
test, ce qui valide l’hypothèse de départ de l’étude
de réduction du surtraitement par chimiothérapie
adjuvante. Cependant, on note que la survie sans
récidive, qui n’était pas le critère de jugement prin-
cipal de cette étude, est significativement inférieure
en l’absence de chimiothérapie (90 versus 93 %
à 5 ans ; p = 0,026). De plus, pour la population
c-Low/g-High, la signature n’apporte rien de plus. Il
n’y a aucun bénéfice en survie sans métastases ou en
survie sans récidive à recevoir de la chimiothérapie ;
la signature ne doit donc pas être utilisée dans cette
population dite à risque clinique faible.
Prolongation de l’hormonothérapie
L’essai MA.17R a étudié le possible intérêt de
prolonger de 5 ans un traitement adjuvant après
5 ans de létrozole (6). Les patientes pouvaient
L’étude MINDACT est la première à valider de manière prospective la désescalade en chimiothérapie
adjuvante par l’utilisation d’un test génomique. L’étude MA.17R a montré un possible bénéfice de la
prolongation de l’hormonothérapie adjuvante par inhibiteurs de l’aromatase au-delà de 5ans sans être
confirmée clairement par d’autres essais. La classe des inhibiteurs de
cycline-dépendant kinase
s’impose
en première ligne métastatique, associée à l’hormonothérapie dans les tumeurs exprimant les récepteurs
hormonaux, HER2–. La place de l’immunothérapie par les inhibiteurs de
checkpoint
reste encore à définir
dans les cancers du sein,dans les triple-négatifs en particulier.
Mots-clés
Anti-CDK
Test génomique
Nératinib
Pertuzumab
Immunothérapie
Summary
The publication of the results
of the MINDACT study is the
first to validate prospective
de- escalation in adjuvant
chemo therapy using a genomic
test. The MA.17R trial showed
a possible benefit from the
prolongation of adjuvant
hormone therapy with aroma-
tase inhibitors beyond five
years without being clearly
confirmed by other trials. The
class of cyclin-dependent
kinase inhibitors is the first
metastatic line associated with
hormone therapy in hormone
receptor-positive tumors. The
place of immunotherapy by
checkpoint inhibitors remains
to be defined in breast cancer,
in particular in triple negative
breast tumors.
Keywords
Anti-CDK
Genomic test
Neratinib
Pertuzumab
Immunotherapy

98 | La Lettre du Cancérologue • Vol. XXVI - n° 3 - mars 2017
Cancers du sein
RÉTROSPECTIVE
PERSPECTIVES
97,6 (96,9-98,1)
94,8 (92,4-96,4)
95,1 (93,8-96,2)
90,6 (89,0-92,0)
c-Low/g-Low
c-Low/g-High
c-High/g-Low
c-High/g-High
100
2 628
550
1 457
1 689
2 331
484
1 317
1 462
735
136
311
395
33
2
9
11
2 745
Survie sans métastases à distance (%)
592
1 550
1 806
77
32
82
171
80
60
40
20
0
0 2 4 6 8 10
Années
Groupes
discordants
Risque corrigéPatientes à risque (n)
O
N
À 5 ans
Figure 2. Devenir clinique de la population de l’essai MINDACT à 5 ans de suivi : survie
sans métastases à distance dans les 4 groupes.
également avoir déjà reçu du tamoxifène, en adju-
vant avant les 5 premières années de létrozole.
Il s’agissait principalement de patientes ayant
participé à l’essai MA.17, qui comparait après 5 ans
de tamoxifène la prolongation ou non par 5 ans
de létrozole. Cet essai avait montré un bénéfice
en survie sans récidive, puis un gain en survie
globale. C’est à l’issue de ces 5 ans de létrozole
adjuvant que les 1 918 patientes de l’essai MA.17R
étaient randomisées entre létrozole ou placebo
pour 5 ans supplémentaires. L’étude montre un
bénéfice en survie sans maladie, qui passe de 91 à
95 % à 5 ans (HR = 0,66 ; p = 0,01), soit 34 % de
réduction des rechutes. Cette réduction du risque
de récidive porte surtout sur les cancers du sein
controlatéraux (3,2 versus 1,4 %), alors que le
nombre de métastases à distance passe seulement
de 53 à 42 événements, soit une différence d’un
peu plus de 1 %. On n’observait aucune différence
en survie globale (93 versus 94 % à 5 ans). En
ce qui concerne la tolérance, on retrouvait les
effets indésirables attendus avec un inhibiteur
de l’aromatase, les douleurs articulaires passant
de 14 à 18 %. On notait également une augmen-
tation du taux de fractures, qui passait de 9 à
14 % (p = 0,001), sans autre toxicité, en particulier
cardiovasculaire.
L’intérêt de poursuivre l’hormonothérapie après
5 années de tamoxifène a été évalué avec le
tamoxifène et les inhibiteurs de l’aromatase.
Deux études ont démontré que 10 ans de
tamoxifène étaient supérieurs à 5 ans (études
ATLAS et ATTOM). Trois études ont montré que
la poursuite de l’hormono thérapie après 5 ans
de tamoxifène par un inhibiteur de l’aroma-
tase améliorait la survie sans maladie (études
MA.17, NSABP B-33, ABCSG-6a). Trois études,
présentées au congrès de San Antonio 2016, ont
exploré la prolongation de la prise d’un inhibiteur
de l’aromatase après 5 ans d’hormonothérapie
ayant comporté un inhibiteur de l’aromatase :
l’étude DATA, avec l’anastrozole, comparait
un schéma séquentiel de 5 ans (tamoxifène
pendant 2-3 ans suivi par un inhibiteur de l’aro-
matase pendant 3 ans) à un schéma prolongé
(tamoxifène pendant 2-3 ans suivi par un inhibi-
teur de l’aromatase pendant 6 ans) avec la parti-
cipation de 1 912 patientes (7). La poursuite de
l’anastrozole au-delà de 3 ans ne permettait pas
une amélioration significative de la survie sans
maladie. Les analyses rétrospectives suggéraient
qu’un sous-groupe à haut risque (> T1, pN+)
pouvait bénéficier de cette hormonothérapie
prolongée. L’étude IDEAL, testant le létrozole, a
comparé 2 durées différentes d’hormono thérapie
prolongée : 2,5 ans versus 5 ans (8). Cette étude
a inclus 1 824 patientes. Après 5 ans d’hormono-
thérapie, la prolongation du létrozole au-delà de
2,5 ans n’améliorait pas la survie sans maladie.
Cette stratégie d’hormono thérapie prolongée
par un inhibiteur de l’aromatase avait une action
préventive. Le traitement long (5 ans de létrozole)
permettait une réduction absolue de 1 % du risque
de cancer controlatéral par rapport au traitement
court (2,5 ans de létrozole). L’étude NSABP B-42
avec le létrozole a comparé un schéma court (5 ans
d’hormono thérapie avec un inhibiteur de l’aro-
matase ou un schéma séquentiel) à un schéma
long (5 ans d’hormonothérapie avec un inhibi-
teur de l’aromatase ou un schéma séquentiel suivi
par 5 ans de létrozole) [9]. Cette étude a inclus
3 923 patientes. Après 5 ans d’hormono thérapie,
la poursuite du létrozole pendant 5 années supplé-
mentaires n’améliorait pas la survie sans maladie.
En revanche, elle améliorait la survie sans rechute
à distance. Le risque de thrombose vasculaire
artérielle était augmenté, mais pas celui de frac-
ture secondaire à l’ostéoporose. En conclusion,
l’ensemble de ces données ne permet pas de
recommander de façon systématique une prolon-
gation de l’hormono thérapie par un inhibiteur de
l’aromatase ; il faut la discuter au cas par cas chez
les patientes les plus à risque de récidive (atteinte
ganglionnaire et taille tumorale importantes).

100 | La Lettre du Cancérologue • Vol. XXVI - n° 3 - mars 2017
Cancers du sein
RÉTROSPECTIVE
PERSPECTIVES
HER2+
Le nératinib, un inhibiteur de tyrosine kinase (ITK) oral,
a été évalué chez des patientes en situation adjuvante
d’un cancer du sein avec surexpression de HER2. Ce
composé inhibe HER1, -2 et -3. Dans l’essai ExteNET,
les patientes recevaient un traitement adjuvant stan-
dard pour leur carcinome mammaire HER2+, avec
notamment du trastuzumab (10). Elles étaient par la
suite randomisées entre le nératinib (240 mg/j) ou un
placebo pendant 1 an. À 24 mois, la survie sans récidive
est de 91,6 % dans le bras placebo et de 93,9 % dans le
bras nératinib (HR = 0,67 ; IC
95
: 0,50-0,91 ; p = 0,009).
Ce bénéfice de survie semble particulièrement impor-
tant pour la population de patientes ayant une tumeur
RH+ (HR = 0,51 ; IC95 : 0,33-0,77). En ce qui concerne
la toxicité, le nératinib a entraîné 40 % de diarrhées de
grade 3 ou 4 ; 95 % des patientes ont en fait présenté
des diarrhées nécessitant, dans un quart des cas, une
réduction de doses et/ou un arrêt du traitement.
Traitement néo-adjuvant
HER2+
NeoSphere est une étude de phase II en situation
néo-adjuvante évaluant 4 combinaisons de traite
-
ment anti-HER2 (avec une centaine de patientes par
bras) [11]. Le bras standard consistait en une asso-
ciation de trastuzumab et de docétaxel (TD). Les
autres bras étaient : trastuzumab + pertuzumab (PT),
docétaxel + trastuzumab + pertuzumab (PTD) et
docétaxel + pertuzumab (PD). La triple association
PTD permettait d’obtenir près de 46 % de réponse
complète histologique (pCR), ce qui était statistique-
ment supérieur aux autres bras de cet essai (respec-
tivement, 29, 17 et 24 %). La survie sans rechute à
5 ans semble ainsi meilleure dans le bras PTD : 86 %
(IC
95
: 77-91), comparée à 81 % dans le bras TD, 73 %
dans le bras PT et 73 % dans le bras PD (non signi-
ficatif). L’étude confirme qu’une pCR est associée à
une meilleure survie sans récidive. Cependant, il s’agit
d’une étude de phase II dont les effectifs n’ont pas
été calculés pour avoir la puissance nécessaire aux
analyses en survie mais uniquement pour celle requise
pour les analyses menées sur les taux de réponse
histologique. Reposant sur les résultats initiaux de
cette étude qui montrait une augmentation signi-
ficative du taux de réponse, l’association trastu-
zumab, pertuzumab et taxanes en chimiothérapie
néo-adjuvante a obtenu son AMM, mais elle n’est
pas remboursée en France, en attendant d’obtenir
les données de survie de l’essai adjuvant APHINITY
testant l’adjonction du pertuzumab, qui seront dispo-
nibles cette année.
Triple-négatif
L’essai I-SPY 2 se caractérise par un schéma original,
dit “adaptatif”. À partir d’un schéma de randomisation
classique, les auteurs proposent, pour chaque bras et
chaque sous-type moléculaire, une évaluation baye-
sienne de la pCR permettant d’estimer précocement la
probabilité de pCR, qui sera histologiquement validée
en fin d’étude. Dans le bras qui testait carboplatine +
véliparib (inhibiteur de PARP) associés à un schéma
standard (séquentiel d’anthracyclines puis taxanes)
dans les cancers triple-négatifs, la probabilité de pCR
était de 51 %, contre 26 % pour la chimiothérapie
standard seule. Ces résultats se traduisaient par une
supériorité du bras carboplatine + véliparib d’une
probabilité de 99 %, et une probabilité de succès de
88 % pour une phase III (12). Cette hypothèse est
évaluée dans l’essai de phase III Brightness, dont les
résultats seront présentés cette année.
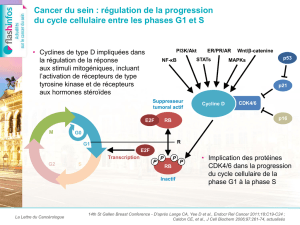
Métastatique
RH+
Le palbociclib est un inhibiteur de CDK4/6 entraî-
nant un blocage de la prolifération cellulaire par
arrêt du cycle en phase G1. PALOMA-2 est une
étude de phase III comparant létrozole + placebo
à létrozole + palbociclib en première ligne méta-
statique chez 666 patientes atteintes d’un cancer
du sein RH+, non réfractaires à une hormono-
thérapie (13). L’étude a atteint son objectif principal :
la survie sans progression était de 24,8 mois avec le
palbociclib versus 14,5 mois dans le bras contrôle
(HR = 0,58 ; IC
95
: 0,46-0,72 ; p < 0,001) [figure 3].
Le bénéfice du palbociclib a été observé dans tous
les sous-groupes, notamment en cas de méta-
stase viscérale. Le profil de tolérance est tout à fait
satisfaisant, similaire à celui observé dans l’étude
PALOMA-3, avec la survenue d’une neutropénie de
grade 3-4 chez 66 % des patientes dans le groupe
palbociclib + létrozole, versus 1 % dans le groupe
létrozole + placebo ; la neutropénie fébrile restait
exceptionnelle (1,8 % des patientes dans le bras
palbociclib). En conclusion, l’addition du palbociclib
au létrozole en première ligne métastatique des
cancers du sein RH+ entraîne une amélioration très

La Lettre du Cancérologue • Vol. XXVI - n° 3 - mars 2017 | 101
RÉTROSPECTIVE
PERSPECTIVES
Palbociclib
+ létrozole
(n = 444)
Placebo
+ létrozole
(n = 222)
100
444
222
395
171
360
148
328
131
295
116
263
98
194 (44)
24,8 (22,1-NR)
137 (62)
14,5 (12,5-17,1)
HR : 0,58 ; IC95 : 0,46-0,72 ; p < 0,001
238
81
154
54
69
22
29
12
10
4
2
2
80
60
40
20
0
0 963 181512 30272421 33
Mois
Patientes à risque (n)
Survie sans progression (%)
Nombre d’événements (%)
SSP médiane (IC95)
Figure 3. PALOMA-2, survie sans progression : évaluation par les investigateurs (popu-
lation en intention de traiter).
significative de la survie sans progression et devient
un standard de la première ligne de traitement.
L’étude MONALEESA-2 évaluait l’adjonction du
ribociclib (LEE011) au létrozole en première ligne
métastatique de cancer du sein RH+, HER2– (14). Un
ensemble de 668 patientes a été randomisé entre
létrozole + ribociclib (600 mg/j 3 semaines sur 4)
et létrozole + placebo. Les patientes n’avaient reçu
aucun traitement antérieur pour la maladie méta-
statique et 59 % avaient une atteinte viscérale. Avec
un suivi médian de 15,3 mois, la première analyse
intermédiaire planifiée montre un bénéfice signifi-
catif en survie sans progression, le HR est de 0,56
(IC
95
: 0,43-0,72). La médiane était de 14,7 mois dans
le bras contrôle et n’était pas atteinte dans le bras
expérimental (p = 0,00000329). Le taux de réponse
objective passait de 28 à 41 % (p = 0,000155).
Le bénéfice a été observé dans tous les sous-groupes.
Le profil de tolérance est similaire à celui d’autres
agents de cette classe, c’est-à-dire une neutropénie
de grade 3-4 dans 60 % des cas, mais seulement
1,5 % de neutropénie fébrile. Ces résultats sont donc
très comparables à ceux du palbociclib dans l’essai
PALOMA-2 (survie sans progression : 24,8 mois,
contre 14,5 mois dans le bras contrôle avec létrozole ;
HR = 0,58). Ces 2 grandes études valident l’intérêt de
cette nouvelle classe de molécules. Cependant, des
questions restent en suspens : validation de biomar-
queurs de résistance et/ou de sensibilité, choix du
partenaire d’hormonothérapie. L’objectif de FALCON,
étude de phase III avec contrôle placebo, était de
confirmer la supériorité en survie sans progression du
fulvestrant sur l’anastrozole chez des patientes méno-
pausées atteintes d’un cancer du sein métastatique
ou localement avancé, exprimant les récepteurs
hormonaux, et n’ayant jamais reçu d’hormonothé-
rapie. Les patientes pouvaient avoir reçu 1 ligne de
chimiothérapie en situation métastatique. En tout,
406 patientes ont été incluses dans l’étude, la majo-
rité était au stade métastatique (87 %), dont plus de
la moitié avec maladie viscérale. Il existe une diffé-
rence significative en survie sans progression en faveur
du fulvestrant : 16,6 versus 13,8 mois (HR = 0,797 ;
IC
95
: 0,637-0,999 ; p = 0,0486). L’effet paraît encore
plus important dans la population sans métastase
viscérale, sous réserve que ce ne soit pas un facteur de
stratification initial. Avec un suivi médian de 25 mois,
il n’existe pas de différence en survie globale. Cette
étude confirme l’activité du fulvestrant en situation
métastatique par rapport à un inhibiteur de l’aro-
matase. À l’heure actuelle, les patientes reçoivent
une hormonothérapie par inhibiteur de l’aromatase
pendant une durée minimale de 5 ans (15).
HER2+
MARIANNE est une étude de phase III en première
ligne du cancer du sein métastatique. Dans cet
essai, il devait y avoir un intervalle de plus de
6 mois depuis la fin du traitement adjuvant ;
1 095 patientes ont été incluses. Trois bras étaient
comparés : le bras standard avec l’association tras-
tuzumab + taxane, et 2 bras expérimentaux avec
T-DM1 + pertuzumab et T-DM1 + placebo (16).
Les 2 bras expérimentaux sont non inférieurs, mais
ne sont pas supérieurs au bras contrôle. Pour le
traitement par T-DM1 seul : HR = 0,91 ; IC95 : 0,73-
1,13 ; p = 0,3. Pour le traitement associant T-DM1 +
pertuzumab : HR = 0,87 ; IC95 : 0,69-1,08 ; p = 0,1.
En termes de survie globale, il n’y a aucune diffé-
rence entre les 3 bras.
L’essai PHEREXA visait à étudier l’efficacité de
l’ajout du pertuzumab à une association trastu-
zumab + capécitabine après progression sous trastu-
zumab + paclitaxel (17). Au total, 224 patientes
ont été randomisées dans le bras trastuzumab +
capécitabine et 228 l’ont été dans le bras trastu-
zumab + pertuzumab + capécitabine. La majorité
des patientes (75 %) a été incluse en deuxième
ligne de traitement métastatique (et 25 % ont été
incluses en première ligne après un échappement
à un traitement adjuvant par trastuzumab). Avec
une médiane de suivi de plus de 25 mois, l’amélio-
ration de la survie sans progression (9 mois dans le
bras contrôle et 11 mois dans le bras expérimental)
n’est pas statistiquement significative (HR = 0,82 ;
IC
95
: 0,65-1,02 ; p = 0,07). Il semble exister tout
de même une amélioration de la survie globale
 6
6
1
/
6
100%