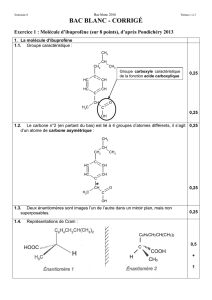
Exercice 1 : Dosage du dioxyde de soufre dans le vin

Origine des noms triviaux des acides
Les noms triviaux des acides ont très souvent comme racine le nom latin ou grec de l'animal, la
plante ou la substance où ces acides se rencontrent en abondance ou ont été trouvés pour la
première fois. En voici quelques exemples:
Formule
Nom
Origine du nom
HCOOH
Acide formique
Du latin formica «fourmi»
CH3-COOH
Acide acétique
Du latin acetum «vinaigre»
CH3-CH2-COOH
Acide propionique
Du grec prôtos «premier» et piôn
«gras»
CH3-(CH2)2-COOH
Acide butyrique
Du latin butyrum «beurre»
CH3-(CH2)4-COOH
Acide caproïque
Du latin caper «chèvre»
CH3-(CH2)14-COOH
Acide palmitique
Du latin palmus «palme»
CH3-(CH2)7-CH=CH-(CH2)7-
COOH
Acide oléique
Du latin oleum «huile»
CH3-(CH2)4-(CH=CH-(CH2)2
-(CH2)6-
COOH
Acide linoléique
Du latin linum «lin»
CO2H-COOH
Acide oxalique
Du grec oxalis «oseille»
Détartrant pour cafetière électrique
Acide tartrique – détartrant de cafetière
C4O6H6 HOOC ─ (CHOH)2 COOH
conservateur organique
CaCO3 + 2H3O+ ⇄ CO2 + Ca2+ + 3H2O
HOOC CH CH COOH
| |
OH OH
acide 1,4-butane-dioïque diol-2,3
1,4-diaïque 2,3-diol butane

Acide sulfamique H2N SO3H
L’acide sulfamique est utilisé comme détartrant de cafetière électrique.
L’acide sulfamique est un acide fort, symbolisé par la formule AH.
On pourra effectuer ce dosage avec une solution de détartrant n’ayant jamais
été utilisée, puis avec une solution ayant déjà été utilisée une ou plusieurs fois
pour nettoyer une cafetière.
Selon Arrhenius : un acide libère des protons
Selon Brönsted : acide dans l’eau
Selon Lewis : un acide est un accepteur d’électrons
Autoprotolyse de l’eau : H2O + H2O = H3O+ + HO-
Ke= 10-14
pKe= 14
pH= - log [H3O+]
acide fort : pH= - log [AH]
acide faible : pH= ½ (pKa – log [H30+])
base forte : pH = pKe + log [A-]
base faible : pH= ½ (pKe + pKa + log [A-])
solution mixte : pH= pKa - log [AH] + log [A-]
acides forts : HCl et H2SO4
base forte : NaOH
Acides aminés (amphotères) :
Acide aminé : COOH _ NH2
/
CH
Acide aminé dans l’eau : COO- _ NH3+
/
CH
Forme acide : COO- _ NH2
/
CH
Forme basique : COOH _ NH3+
/
CH
pH d’un n-acide : pH= pK1 + pK2 + … + pKn
2
Pour obtenir une solution tampon il faut mélanger un acide fort et une base faible conjugués ou inversement.
Le pH d’une solution tampon ne varie pas quand on ajoute de l’acide ou de la base.

Oxydant : capte électrons
Réducteur : cède électrons
Ox + n e- = Red
Le nombre d’oxydations indique, pour un élément engagé dans une combinaison chimique, le nombre d’éléments
gagnés (ou perdus) par rapport à son état fondamental.
- Le nombre d’oxydations d’un élément à son état fondamental est nul. (ex : K)
- Le nombre d’oxydations de chaque atome d’une molécule polyatomique homonucléaire est nul. (ex : H2)
- Le nombre d’oxydations global d’une espèce hétéro-polyatomique est égal à la somme des états
d’oxydation des éléments qui la composent.
- Le nombre d’oxydations global d’une espèce hétéro-polyatomique est égal à sa charge (il est donc nul pour
une molécule). (ex : H20)
- On attribue à l’élément le plus électronégatif une charge négative fictive.
Valeurs à connaître :
H : +1
K : +1
Na : +1
Cl : -1
Oxydant et Réducteur ne sont pas toujours donnés dans le bon ordre, on doit trouver avec les demi-équations.
ADN et ARN sont des macro-molécules et des acides nucléiques qui aboutissent à des protéines.
Les nucléotides sont composés de 3 éléments : base azotée, pentose, acide phosphorique.
Base azotée + pentose = nucléoside
Nucléoside + acide phosphorique = nucléotide
Nucléotide + Nucléotide + … + Nucléotide = ADN ou ARN
Il y a 5 bases azotées : Adénine, Guanine, Thymine, Cytosine, Uracile
2 types de bases azotées :
- pyrimidiques (U,T,C) qui ont en commun le noyau pyrimidique
Uracile : 2 – 4 - dihydroxypyrimidine
Thymine : 2 – 4 – dihydroxy – 5 - méthylpyrimidine
Cytosine : 2 – hydroxy – 4 - aminopyrimidine
- puriques (A,G) qui ont en commun le noyau purique
Adénine : 6 - aminopurine
Guanine : 6 – hydroxy - 2 – aminopurine
Deux pentoses différents : désoxyribose pour l’ADN et ribose pour l’ARN.
L’acide phosphorique (phosphate H3PO4) comporte 3 fonctions acides dont 2 esterifiées et 1 libre.
Les différents éléments sont reliés entre eux :
- liaison ose-base (entre pentose et base azotée) qui est une liaison N-glycosidique formée par élimination
d’une molécule d’eau
- liaison acide phosphorique (entre pentose et phosphate) qui est une liaison ester formée par élimination
d’une molécule d’eau
- liaison phospho-diester (entre nucléotides) qui est une liaison covalente formée par élimination d’une
molécule d’eau

Propriétés des acides nucléiques :
- mêmes propriétés que les acides
- les bases sont basiques et hydrophobes (c’est-à-dire peu solubles dans l’eau)
- les bases absorbent dans les ultraviolets (environ 260 nm) ; effet hyperchrome (augmentation de
l’absorbance lors de la dénaturation de l’ADN)
- les acides nucléiques sont polaires (donc solubles dans l’eau)
- l’ADN peut être dénaturé de manière chimique (en ajoutant de l’acide qui casse les liaisons) ou
enzymatique (en ajoutant des nucléases).
Il existe les endonucléases, les exonucléases, les désoxyribonucléases et les ribonucléases.
Les bases s’assemblent par complémentarité par une liaison non- covalente (liaison hydrogène) :
Entre A et T et A et U il y a une double liaison.
Entre C et G il y a une triple liaison.
L’ADN est une molécule double brin enforme d’hélice.
L’ARN est, le plus souvent, une molécule simple brin.
EXERCICE DOSAGE ACIDE/BASE
On dose 10 mL de solution d’acide chlorhydrique de concentration inconnue par une solution d’hydroxyde de
sodium de concentration 1,0.10-1 mol.L-1. On ajoute à l’acide quelques gouttes de BBT.
On trouve un volume équivalent Veq = 15mL
1- Précisez la nature de la solution titrante, de la solution à doser, le volume de solution dosée.
2- Faire un schéma du montage.
3- Quel est l’intérêt d’ajouter du BBT à l’acide ?
4- Ecrivez l’équation-bilan de la réaction de dosage. Montrez qu’il s’agit d’une réaction acido-basique. Donner ses
caractéristiques.
5- Ecrivez la relation entre quantités de réactifs à l’équivalence ; en déduire la relation permettant de calculer la
concentration de la solution inconnue.
6- Calculez cette concentration.
EXERCICE DOSAGE ACIDE/BASE
On dose 10 mL de solution d’acide chlorhydrique de concentration inconnue par une solution d’hydroxyde de
sodium de concentration 1,0.10-1 mol.L-1. On ajoute à l’acide quelques gouttes de BBT.
On trouve un volume équivalent Veq = 15mL
1- Précisez la nature de la solution titrante, de la solution à doser, le volume de solution dosée.
2- Faire un schéma du montage.
3- Quel est l’intérêt d’ajouter du BBT à l’acide ?
4- Ecrivez l’équation-bilan de la réaction de dosage. Montrez qu’il s’agit d’une réaction acido-basique. Donner ses
caractéristiques.
5- Ecrivez la relation entre quantités de réactifs à l’équivalence ; en déduire la relation permettant de calculer la
concentration de la solution inconnue.
6- Calculez cette concentration.
EXERCICE DOSAGE ACIDE/BASE
On dose 10 mL de solution d’acide chlorhydrique de concentration inconnue par une solution d’hydroxyde de
sodium de concentration 1,0.10-1 mol.L-1. On ajoute à l’acide quelques gouttes de BBT.
On trouve un volume équivalent Veq = 15mL
1- Précisez la nature de la solution titrante, de la solution à doser, le volume de solution dosée.
2- Faire un schéma du montage.
3- Quel est l’intérêt d’ajouter du BBT à l’acide ?
4- Ecrivez l’équation-bilan de la réaction de dosage. Montrez qu’il s’agit d’une réaction acido-basique. Donner ses
caractéristiques.
5- Ecrivez la relation entre quantités de réactifs à l’équivalence ; en déduire la relation permettant de calculer la

concentration de la solution inconnue.
6- Calculez cette concentration.
EXERCICE DOSAGE ACIDE/BASE
On dose 10 mL de solution d’acide chlorhydrique de concentration inconnue par une solution d’hydroxyde de
sodium de concentration 1,0.10-1 mol.L-1. On ajoute à l’acide quelques gouttes de BBT.
On trouve un volume équivalent Veq = 15mL
1- Précisez la nature de la solution titrante, de la solution à doser, le volume de solution dosée.
2- Faire un schéma du montage.
3- Quel est l’intérêt d’ajouter du BBT à l’acide ?
4- Ecrivez l’équation-bilan de la réaction de dosage. Montrez qu’il s’agit d’une réaction acido-basique. Donner ses
caractéristiques.
5- Ecrivez la relation entre quantités de réactifs à l’équivalence ; en déduire la relation permettant de calculer la
concentration de la solution inconnue.
6- Calculez cette concentration.
CORRECTIONS EXERCICES SUR LES DOSAGES
Exercice 1 : Dosage du dioxyde de soufre dans le vin
1) 2) Le diiode de couleur violet se transforme en I-
incolore. On repère donc l’équivalence par ce
changement de couleur.
3) SO2 + 2H2O = SO42- + 2é + 4H+
I2 + 2é = 2 I- .
SO2 + 2H2O + I2 SO42- + 4H+ + 2I-
4)
Xmax = C2V2 = C1Veq
nSO2 = nI2 = C1Veq = 7,8.10-3 x 6,10.10-3 = 4,76.10-5 mol.
5) C2 = nSO2/V2 = 4,76.10-5/25.10-3 = 1,9.10-3mol/L
Cm2 = m(SO2) /V2 = (n SO2 x M (SO2)/V2 = C2 x M(SO2) = 1,9.10-3 x (32,1 + 2 x 16) = 0,12 g/L
= 120 mg/L < 210 mg/L donc le vin est conforme.
SO2
I2
EI
nSO2 = C2V2
nI2 = C1Veq
EF = équiv
C2V2 – xmax = 0
C1Veq – xmax = 0
Solution de I2
C1 = 7,8.10-3mol/L
Veq = 6,10 mL
Vin
C2 = ?
V2 = 25 mL
 6
6
 7
7
 8
8
 9
9
1
/
9
100%