Télécharger le pdf

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 3-4 - mars-avril 2017
66
dossier
Médicaments
et diabète
Thérapies ciblées et diabète
Targeted therapies and diabetes
Bruno Vergès*
* Service endocrino logie-
diabétologie, Inserm CRI
866, CHU de Dijon,
université de Bourgogne ;
Inserm UMR 866, Dijon.
Points forts
Highlights
»
Les inhibiteurs de mTOR ont pris une place importante en
cancérologie. Ils sont à l’origine d’hyperglycémies parfois sévères,
dont l’incidence varie de 13 à 50 %.
»
Ces diabètes induits par les inhibiteurs de mTOR apparaissent
liés à une résistance à l’insuline et à une réduction de l’insulino-
sécrétion.
»Le risque élevé de diabète sous inhibiteurs de mTOR nécessite
une surveillance étroite de la glycémie au cours du traitement.
»
Les inhibiteurs de la tyrosine kinase peuvent être à l’origine
d’hyperglycémies ou d’hypoglycémies.
Mots-clés : Diabète – Inhibiteur mTOR – Inhibiteur de tyrosine
kinase – Thérapie ciblée.
mTOR inhibitors, which are important anti-cancer agents,
may frequently induce hyperglycemias in 13% to 50% of the
patients.
Diabetes induced by mTOR inhibitors seems to be due to both
insulin resistance and reduced insulin secretion.
Because of the high risk of diabetes with mTOR inhibitors, blood
glucose needs to be carefully monitored during treatment.
Tyrosine kinase inhibitors may induce both hyperglycemias
and hypoglycemias.
Keywords: Diabetes – mTOR inhibitor – Tyrosine kinase
inhibitor – Targeted therapy.
L
es thérapies ciblées représentent une approche
moléculaire du traitement du cancer. À la diffé-
rence de la chimiothérapie classique, la thérapie
ciblée a pour objectif de bloquer le fonctionnement
d’une ou de plusieurs protéines des voies de signalisa-
tion impliquées dans la croissance des cellules cancé-
reuses. Parmi les thérapies ciblées, certaines (inhibiteurs
de mTOR, inhibiteurs de tyrosine kinases [ITK]) ont des
effets significatifs sur le métabolisme glucidique et, de
ce fait, peuvent être responsables d’hyperglycémies
et de diabète.
Les inhibiteurs de mTOR et les inhibiteurs
detyrosine kinases en cancérologie
Dans un premier temps, les inhibiteurs de mTOR ont
été utilisés comme médicaments anti-rejets dans le
domaine de la transplantation. Puis, ils ont été déve-
loppés, dans un second temps, comme agents antican-
céreux. Le sirolimus (ou rapamycine) et l’évérolimus, à
faible dose (1,5-3 mg/j) sont utilisés comme traitements
anti-rejets. L’évérolimus à forte dose (5-10 mg/j) et le
temsirolimus sont des médicaments anticancéreux.
Les inhibiteurs de mTOR agissent en inhibant la voie
de signalisation PI3K (PhosphoInositide 3-kinase)-
Akt-mTOR, qui joue un rôle dans la régulation de la
croissance cellulaire. L’évérolimus et le temsirolimus
sont approuvés par les agences de santé pour une uti-
lisation dans le traitement de certains cancers. Ainsi,
l’évérolimus a une autorisation de mise sur le marché
dans les formes avancées de tumeurs pancréatiques
neuroendocrines, de cancers du rein, de cancers du sein
et d’astrocytomes dans le cadre de la sclérose tubéreuse
de Bourneville, et le temsirolimus, dans les cancers du
rein de stade avancé et certains lymphomes (1).
Les ITK sont de petites molécules inhibant les tyrosine
kinases, qui sont des enzymes jouant un rôle important
dans la modulation des voies de signalisation des fac-
teurs de croissance. L’imatinib a une autorisation de mise
sur le marché pour le traitement de la leucémie myéloïde
chronique, de certaines leucémies lympho blastiques
aiguës, des leucémies chroniques à éosinophiles et des
tumeurs stromales gastro-intestinales. Le sunitinib est
utilisé dans le traitement des tumeurs stromales gas-
tro-intestinales, des cancers du rein méta statiques et
des tumeurs neuroendocrines évoluées. Le pazopanib
est prescrit dans certains sarcomes et dans les cancers
du rein métastatiques, et le nilotinib, dans certaines
leucémies myéloïdes chroniques. Le sorafénib est uti-

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 3-4 - mars-avril 2017
67
Thérapies ciblées et diabète
lisé contre le cancer du rein et les cancers thyroïdiens
différenciés résistants à l’iode 131, et le vandétanib,
dans le cancer médullaire de la thyroïde.
Effets des inhibiteurs de mTOR
surlemétabolisme glucidique
En raison de la place importante de mTOR dans la régu-
lation du métabolisme glucidique, les inhibiteurs de
mTOR vont modifier significativement celui-ci et induire
des hyperglycémies.
mTOR est une sérine/thréonine kinase appartenant à
la famille des kinases associée à la PI3K. Elle joue un
rôle important non seulement dans la régulation de
la croissance cellulaire mais aussi dans les métabo-
lismes glucidique et lipidique. mTOR est présent sous
la forme de 2 complexes protéiques distincts, mTORC1
et mTORC2, qui interviennent dans la régulation de la
croissance cellulaire, de la survie cellulaire et du méta-
bolisme (2, 3).
Effets de mTOR sur le métabolisme glucidique
Les effets de mTOR sur l’homéostasie glucidique sont
complexes, avec des résultats opposés selon le niveau
d’activité de mTOR (1, 3). mTORC1 augmente la résis-
tance à l’insuline dans le tissu adipeux en favorisant la
phosphorylation de la sérine sur IRS1 (Insulin Receptor
Substrate 1), ce qui a pour conséquence de réduire l’ac-
tivation de PI3K. L’activité de mTORC1 est augmentée
dans le tissu adipeux, le foie et le muscle des animaux
insulinorésistants, ce qui plaide pour un effet délétère
de mTORC1 sur la sensibilité à l’insuline. Ainsi, dans le
foie, la phosphorylation du résidu sérine d’IRS1 réduit
l’activation de la voie PI3K-Akt, ce qui a pour consé-
quence une augmentation de la néoglucogenèse.
À l’opposé, mTORC1, au niveau musculaire, favorise le
métabolisme oxydatif, et les animaux K.O. pour mTORC1
présentent une réduction de la masse musculaire et des
capacités oxydatives musculaires. Par ailleurs, mTORC1
active la fonction de la cellule β et l’activation constitu-
tive de mTORC1 dans les cellules β améliore l’insulino-
sécrétion en relation avec une augmentation de la taille
et du nombre des cellules β (4).
Effets des inhibiteurs de mTOR sur la glycémie
Les inhibiteurs de mTOR sont à l’origine d’hyperglycé-
mies parfois très significatives. Une hyperglycémie est
rapportée chez 12 à 50 % des patients dans les études
de phase III avec l’évérolimus et le temsirolimus ; la fré-
quence des hyperglycémies majeures (> 13,9 mmol/l)
est comprise entre 4 et 12 % selon les études (1).
Cependant, les données de ces études ne donnent
qu’une vision incomplète du réel effet des inhibiteurs de
mTOR sur le métabolisme glucidique, dans la mesure où
nous ne disposons d’aucune information sur le nombre
de patients traités par des antidiabétiques, sur une
éventuelle intensification du traitement anti diabétique
sous inhibiteurs de mTOR, et parce que les patients dont
le diabète est mal contrôlé sont exclus de ces études.
Par exemple, sous évérolimus, on observe une hyper-
glycémie chez 50 % des patients (contre 23 % dans le
groupe placebo) dans l’étude RECORD-1 concernant le
traitement du cancer du rein métastatique, et chez 13 %
des patients (contre 3 % dans le groupe placebo) dans
l’étude BOLERO-1 concernant le traitement du cancer
du sein avancé (5). Avec le temsirolimus utilisé dans
le cancer du rein métastatique, une hyperglycémie a
été notée chez 26 % des patients (contre 11 % dans le
groupe placebo) dans l’étude Global ARCC et chez 22 %
des patients (contre 5 % dans le groupe placebo) dans
l’étude INTORACT (5).
Dans une méta-analyse incluant 24 études cliniques
portant sur l’évérolimus ou le temsirolimus dans dif-
férents types de cancer et totalisant 4 261 patients, le
risque de développer une hyperglycémie sous inhibi-
teur de mTOR est multiplié par 2,95 (IC95 : 2,14-4,05),
et le risque de développer une hyperglycémie sévère
(grade 3 ou 4), par 5,25 (IC95 : 3,07-9,00) [6].
Pathophysiologie de l’hyperglycémie induite
par les inhibiteurs de mTOR
Les mécanismes moléculaires liant l’inhibition de mTOR
à la survenue de troubles du métabolisme glucidique
sont complexes et imparfaitement connus. M. Laplante
et D.M. Sabatini (3) ont émis l’hypothèse que les inhibi
-
teurs de mTOR exerçaient un effet “Janus” sur le métabo-
lisme glucidique suivant une courbe en U où le manque
aussi bien que l’excès d’activité de mTOR ont un effet
délétère sur le métabolisme glucidique. Ainsi, l’admi-
nistration prolongée d’inhibiteurs de mTOR (sirolimus)
chez les rongeurs est à l’origine d’une hyperglycémie
consécutive à une insulinorésistance et à une baisse de
l’insulinosécrétion. Il a été montré que l’inhibition de
mTORC2 par l’administration chronique d’inhibiteurs de
mTOR abolissait l’effet inhibiteur de PI3K-Akt sur la néo-
glucogenèse. On observe, chez les patients transplantés
rénaux traités de façon chronique par évérolimus, une
diminution de la phosphorylation d’Akt induite par
l’insuline dans les monocytes circulants traduisant une
résistance à l’insuline. Chez l’animal, une diminution de
mTOR par la rapamycine augmente la phosphorylation
de JNK (Jun N-terminal Kinase) 1, 2 et 3, ce qui est sus-
ceptible de réduire l’activation d’IRS1 et, ainsi, de réduire

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 3-4 - mars-avril 2017
68
dossier
Médicaments
et diabète
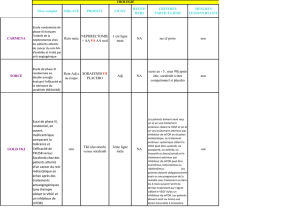
Figure. Effets des inhibiteurs de mTOR sur le métabolisme glucidique.
Insuline / IGF-1
mTORC-1
Glucose
Glucose
mTORC-2
Insulino-résistance
Diminution
de l’insulinosécrétion
mTORC1
Pro-insuline
Insuline
Insuline
Traduction
Prolifération
cellulaire
IRS-1: insulin receptor substrate 1 ; PI3K : phosphoinositide 3-kinase ;
mTORC1: mammalian Target Of Rapamycin Complex 1;
mTORC2 : mammalian Target Of Rapamycin Complex 2.
Néoglucogénèse
mTOR
inhibiteurs
IRS-1/2
Akt
Pi3-Kinase
GLUT-4
mTOR
inhibiteurs
l’activité de la voie de signalisation de l’insuline (7). Chez
les transplantés rénaux, le remplacement des inhibiteurs
de la calcineurine par le sirolimus s’accompagne d’une
augmentation de l’insulino résistance et d’un déficit
d’insulinosécrétion. On peut penser que la réduction
de l’effet stimulant de mTORC1 sur l’insulinosécrétion
est à l’origine de la diminution de la réponse insuli-
nique observée sous inhibiteurs de mTOR. Les effets
des inhibiteurs de mTOR sur le métabolisme glucidique
sont représentés sur la figure.
En 2009, M.H. Kulke et al. ont rapporté que l’utilisation
d’évérolimus chez 4 patients atteints d’insulinomes
sévères avait entraîné une réduction de l’intensité et
de la fréquence des hypoglycémies. Cet effet hyper-
glycémiant “bénéfique” des inhibiteurs de mTOR a
été confirmé par une grande étude réalisée chez des
patients porteurs d’insulinomes métastatiques et appa-
raît comme une preuve supplémentaire de l’effet hyper-
glycémiant de cette classe thérapeutique (8).
Prise en charge des anomalies métaboliques
induites par les inhibiteurs de mTOR
La grande fréquence des anomalies métaboliques
sous traitement par inhibiteurs de mTOR a conduit un
comité d’experts américains (9) et un comité d’experts
français (10) à proposer une démarche diagnostique et
thérapeutique spécifique.
Ainsi, avant toute prescription d’inhibiteur de mTOR,
il sera nécessaire de réaliser un dosage de la glycé-
mie à jeun et de l’HbA1c. En cas d’hyperglycémie à
jeun non diabétique (glycémie à jeun comprise entre
1,10 et 1,26 g/l) ou d’HbA1c comprise entre 6 et 6,5 %,
lors du bilan préthérapeutique, la mise en route d’un
autocontrôle glycémique peut se justifier, en raison du
risque accru de décompensation hyperglycémique.
Chez les patients diabétiques connus, il est conseillé
de renforcer l’autosurveillance glycémique. Une surveil-
lance stricte de la glycémie à jeun sous inhibiteur de
mTOR est nécessaire tous les 15 jours le premier mois
puis 1 fois par mois. L’HbA1c sera renouvelée tous les
3 mois. Il est recommandé de démarrer un traitement
par metformine lorsque la glycémie à jeun dépasse
1,26 g/l, lorsque la glycémie dépasse 2 g/l à n’importe
quel moment ou lorsque l’HbA1c est supérieure à 6,5 %.
Il sera utile de rechercher une cétonurie lorsque la gly-
cémie dépasse 2,5 g/l pour ne pas méconnaître une
décompensation acidocétosique. En cas de contrôle
glycémique insuffisant sous metformine ou lorsque
la glycémie dépasse 2,5 g/l, l’avis rapide d’un endocri-
nologue-diabétologue sera demandé.
Effets des inhibiteurs de la tyrosine kinase
sur le métabolisme glucidique
Les ITK peuvent être à l’origine d’hyperglycémies, mais
aussi d’hypoglycémies. Ainsi, les études cliniques objec-
tivent une fréquence des hyperglycémies de l’ordre de
20 % sous imatinib, de 15 % sous sunitinib, de 38 % sous
nilotinib et de 41 % sous pazopanib. Des hyperglycémies
sévères ont été rapportées chez 2 % des patients sous
pazopanib et 5 % des patients sous nilotinib (1). À l’op-
posé, plusieurs patients traités par imatinib, sunitinib
ou pazopanib ont présenté des hypoglycémies ou une
amélioration d’un diabète préexistant. Les mécanismes
responsables de ces modifications du métabolisme
glucidique sous ITK demeurent inconnus.
En raison de leur effet imprévisible sur la glycémie, un
contrôle étroit est nécessaire chez les patients traités
par ITK. Il sera utile de réaliser avant l’instauration du
traitement par ITK un dosage de la glycémie à jeun et
de l’HbA1c. Au cours du traitement, un dosage de la
glycémie à jeun sera pratiqué toutes les 2 semaines
durant le premier mois puis 1 fois par mois, ainsi qu’un
dosage de l’HbA1c tous les 3 mois. Chez le patient dia-
bétique connu, il faudra renforcer l’autosurveillance
glycémique afin d’adapter le plus rapidement possible le

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XXI - n° 3-4 - mars-avril 2017
69
Thérapies ciblées et diabète
traitement antidiabétique. On insistera aussi sur l’intérêt
d’apprendre au patient (non diabétique) à reconnaître
les signes d’hypoglycémie et d’hyperglycémie (soif).
Conclusion
Les thérapies ciblées en oncologie utilisant les inhibi-
teurs de mTOR et les ITK peuvent entraîner des anoma
-
lies du métabolisme glucidique. Les inhibiteurs de mTOR
sont à l’origine de fréquentes hyperglycémies, voire de
diabètes qui sont parfois sévères. Ces anomalies sont
la conséquence d’une augmentation de la résistance à
l’insuline et d’une réduction de l’insulinosécrétion sous
inhibiteurs de mTOR. Les ITK peuvent être à l’origine
d’hyperglycémies ou d’hypoglycémies. En raison de
l’importance et de la fréquente sévérité des anomalies
glycémiques observées, il est impératif de surveiller de
façon étroite la glycémie en cas de prescription d’inhi-
biteurs de mTOR ou d’ITK.
■L’auteur déclare ne pas avoir
de liens d’intérêts.
1. Vergès B, Walter T, Cariou B. Endocrine side effects of
anti-cancer drugs: effects of anti-cancer targeted thera-
pies on lipid and glucose metabolism. Eur J Endocrinol
2014;170(2):R43-55.
2. Guertin DA, Sabatini DM. Defining the role of mTOR in
cancer. Cancer Cell 2007;12(1):9-22.
3. Laplante M, Sabatini DM. mTOR signaling in growth control
and disease. Cell 2012;149(2):274-93.
4.
Rachdi L, Balcazar N, Osorio-Duque F et al. Disruption of
Tsc2 in pancreatic β cells induces β cell mass expansion and
improved glucose tolerance in a TORC1-dependent manner.
Proc Natl Acad Sci U S A 2008;105(27):9250-5.
5.
Vergès B, Cariou B. mTOR inhibitors and diabetes. Diabetes
Res Clin Pract 2015;110(2):101-8.
6. Sivendran S, Agarwal N, Gartrell B et al. Metabolic compli-
cations with the use of mTOR inhibitors for cancer therapy.
Cancer Treat Rev 2014;40(1):190-6.
7.
Fraenkel M, Ketzinel-Gilad M, Ariav Y et al. mTOR inhibition
by rapamycin prevents β-cell adaptation to hyperglycemia and
exacerbates the metabolic state in type 2 diabetes. Diabetes
2008;57(4):945-57.
8. Kulke MH, Bergsland EK, Yao JC. Glycemic control in
patients with insulinoma treated with everolimus. N Engl J
Med 2009;360(2):195-7.
9. Busaidy NL, Farooki A, Dowlati A et al. Management of
metabolic effects associated with anticancer agents targeting
the PI3K-Akt-mTOR pathway. J Clin Oncol 2012;30(23):2919-28.
10.
Lombard-Bohas C, Cariou B, Vergès B et al. Prise en charge
des troubles métaboliques observés avec évérolimus chez les
patients atteints de tumeurs neuroendocrines bien différenciées
non résécables : propositions d’experts. Bull Cancer (Paris)
2014;101(2):175-83.
Références
www.edimark.fr
Périodique de formation
Revue indexée dans la base
de données internationale
de données internationale
Revue indexée dans la base
de données internationale
1
re
au Cessim
94,8
% des spécialistes
sont des lecteurs réguliers !
*
*
Résultats à l’automne 2016
Société éditrice : EDIMARK SAS
CPPAP : 0417 T 81756 – ISSN : 2100-9619
Mensuel
Prix du numéro : 26 €
Vol. XXI - n° 1-2
janvier-février 2017
L’abonnement,
un engagement fort
dans la vie de votre discipline
page 43
Coordonné par les Prs N. Leveziel (Poitiers)
et P. Gourdy ( Toulouse)
DOSSIER
Mise au point
Autisme et alimentation
Dr J.M. Lecerf (Lille)
L’œil en endocrinologie
L’abonnement,
un engagement fort
dans la vie de votre discipline
page 77
www.edimark.fr
Périodique de formation
Revue indexée dans la base
de données internationale
de données internationale
Revue indexée dans la base
de données internationale
Revue indexée dans la base internationale
ICMJE
Société éditrice : EDIMARK SAS
CPPAP : 0417 T 81756 – ISSN : 2100-9619
Mensuel
Prix du numéro : 26 €
Vol. XXI - n°3-4
Mars-avril 2017
Médicaments
et diabète
Coordonné par le Dr J.M. Lecerf (Lille)
Éditorial & DOSSIER
Cas clinique
Homocystinurie,
challenges à l’âge adulte
Pr J.M. Kuhn (Rouen)
Abonnez-vous sur
www.edimark.fr
Prochain numéro
Parution en juin
Dossier :
Les excès alimentaires
Coordonné par le Dr Jean-Michel Lecerf
(Lille)
1
/
4
100%